






高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应课前预习ppt课件
展开一、物质分类【知识回顾】1.物质由( 元素 )组成,由(分子 )、( 原子 )、( 离子 )构成。2.物质分为(混合物,如空气)和(纯净物,如氧气)。3.纯净物分为(单质)、(化合物)。单质分为(金属单质,由金属元素组成的单质)和(非金属单质,由非金属元素组成的单质)。化合物分为(氧化物)、(酸)、(碱)、(盐)。氧化物按组成元素分为(金属氧化物)与(非金属氧化物),按性质分为(酸性氧化物)和(碱性氧化物)。
【思考与交流】 1.分类标准不同,物质分类结果会相同吗? 2.物质分类还有哪些方法?
将下列物质进行分类:①铁 ②氧气 ③碳 ④二氧化硫 ⑤氢氧化钠 ⑥硫酸铜⑦二氧化碳 ⑧碳酸钠 ⑨镁 ⑩一氧化氮
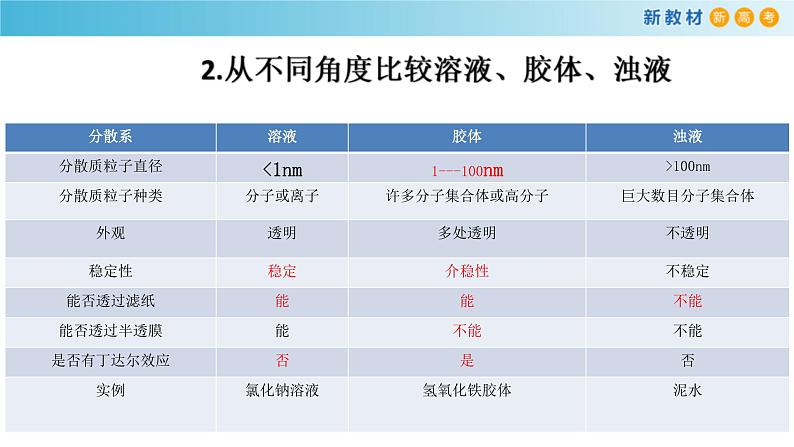
【知识回顾】1.人们根据被分散质的颗粒大小,将分散系分为(溶液)、(浊液)、(胶体)。它们是由一种(或几种)物质(分散质)分散到另一种物质(分散剂)里形成的分散系。
1.胶体的微粒在一定条件下聚集起来变成较大的颗粒,形成沉淀从分散剂中析出的现象叫聚沉。那么聚沉方法有哪些?2.什么叫电泳?3.氢氧化铁胶体如何制备?
1.关于胶体和溶液的区别,下列叙述中正确的是( )A.溶液呈电中性,胶体带有电荷B.溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸C.溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明显光带D.溶液稳定,放置后不会生成沉淀;胶体不稳定,放置会生成沉淀2.氢氧化铁胶体逐滴加入下列溶液,先产生沉淀后沉淀溶解的是( )A.稀硫酸 B.酒精 C.饱和硫酸钠溶液 D.磷酸钠溶液
三、电解质、非电解质【知识回顾】
1.影响溶液导电性强弱因素有哪些?2.什么是强电解质?能举出例子吗?3.什么是弱电解质?能举出例子吗?4.电离方程式遵守什么定律?
1.下列说法正确的是( )A.石墨能导电,所以石墨是电解质B.碳酸钙是电解质C.水难电离,纯水几乎不导电,水是非电解质D.二氧化碳水溶液可以导电,所以二氧化碳是电解质2.写出下列物质在水溶液中的电离方程式KOH HNO3 KHSO4 Na2CO3
四、离子化学方程式 【知识回顾】
1.在溶液中有离子参加的化学反应称为(离子反应)。2.离子方程式和化学方程式都可以用来表示化学反应,但离子方程式所表示的不仅仅是一个反应,而是(一类)反应,并且揭示了这类反应的(实质)。
4.离子方程式书写方法1.正确书写化学方程式例如:HCl+NaOH=NaCl+H2O2.改写化学方程式将易溶于水、易电离的物质改用离子符号表示,难溶于水、挥发性物质和水仍用化学式表示H++Cl-+Na++OH-=Na++Cl-+H2O3.删去未参加反应的离子符号,得到离子方程式将没有参与的氯离子、钠离子删去,得到H++OH-=H2O4.检查离子方程式是否配平根据电荷守恒以及原子种类和数量守恒的原则,检查所写的离子方程式是否配平。
【思考与交流】1.离子化学方程式的写法还有哪些?2.如何除去粗盐中钙离子、镁离子、硫酸根?
1.书写离子化学方程式氢氧化钠溶液与稀硫酸氯化钡溶液与硫酸钠溶液碳酸钙与稀盐酸2.洁厕剂(主要成分为HCl)可用于除去卫生间瓷砖污垢[主要成分有CaCO3、Mg(OH)2],原因是什么?写出相关反应的离子方程式。3.某工厂排出的废水没有特殊颜色,加入OH-有沉淀生成,加入H+有气体生成,推测下列哪一组离子符合这一情况( )A.K+、Mg2+、Cl-、HCO3- B.K+、Cu2+、SO42- 、Na+C.NH4+、CO32-、NO3-、Na+ D.NH4+、Cl-、HCO3- 、K+
五、氧化还原反应 【知识回顾】
4.氧化反应:元素的原子失去电子(或电子对偏离)的反应是氧化反应; 还原反应:元素的原子得到电子(或电子对偏向)的反应是还原反应。5.氧化还原反应的实质是电子转移。 凡是有电子转移(电子得失或偏移)的化学反应都是氧化还原反应;凡是没有电子转移的化学反应都是非氧化还原反应。失去电子→化合价升高:氧化反应;得到电子→化合价降低:还原反应。
6.所含某种(某些)元素化合价降低的反应物称为(氧化剂);氧化剂具有(氧化性)。7.所含某种(某些)元素化合价升高的反应物称为(还原剂);还原剂具有(还原性)。
金属冶炼1.方法:热还原法、金属置换法、电解法2.本质:利用氧化还原反应中的电子转移,使被还原的化合物中的金属元素的化合价从正价降低至0价,生成金属单质。氯气的实验室制法
1.药品:浓盐酸、二氧化锰、氢氧化钠溶液2.原理:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
3.氯气易溶于水且和水反应,故不能用排水法收集。氯气密度比空气大,可以用向上排空气法收集、4.用浓硫酸干燥氯气。用饱和食盐水除去氯气中混有的氯化氢气体。5.氯气制取实验中尾气处理:Cl2+2NaOH=NaCl+NaClO+H2O6.浓盐酸和二氧化锰制取氯气的反应属于氧化还原反应,二氧化锰是氧化剂,浓盐酸是还原剂。7.2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O
1.氧化还原反应特征是什么?本质特征是什么?2.怎么比较氧化剂、还原剂的强弱?3.利用氧化还原反应能否获取物质或能量?4.根据氧化还原反应获取物质,实验室如何制取氯气,反应装置与收集装置各是什么呢?尾气如何处理?
高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应课文内容ppt课件: 这是一份高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应课文内容ppt课件,共10页。PPT课件主要包含了物质的分类,胶体的性质,电解质和非电解质,离子方程式的意义,氧化还原反应等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序课文内容课件ppt: 这是一份高中化学鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序课文内容课件ppt,共42页。PPT课件主要包含了交流与思考,铁盐性质,知识回顾,牛刀小试,硫及其化合物,思考与交流,二氧化硫,浓硫酸,环境问题,氮循环氮固定等内容,欢迎下载使用。
鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序教课课件ppt: 这是一份鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序教课课件ppt,共11页。PPT课件主要包含了知识网络,要点排查等内容,欢迎下载使用。













