
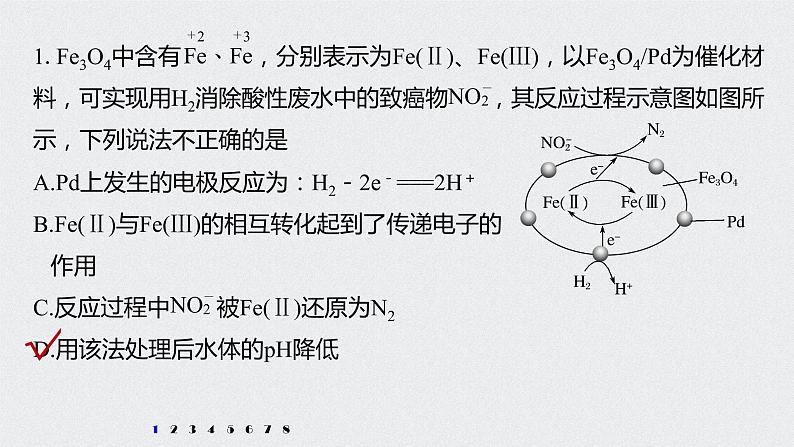




2022高考化学一轮复习(步步高) 第二章 第12讲 专项提能特训1“化工生产”中的物质变化课件
展开解析 由图可知Pd上氢气失电子生成氢离子,所以电极反应为:H2-2e-===2H+,故A正确;Fe(Ⅲ)得电子生成Fe(Ⅱ),Fe(Ⅱ)失电子生成Fe(Ⅲ),则Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用,故B正确;
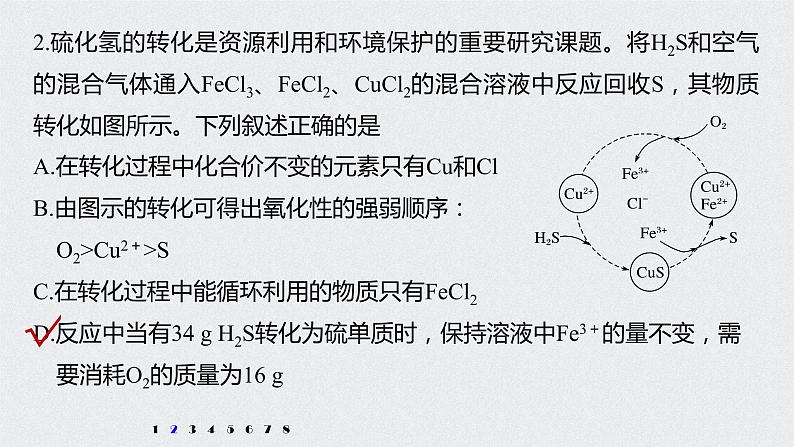
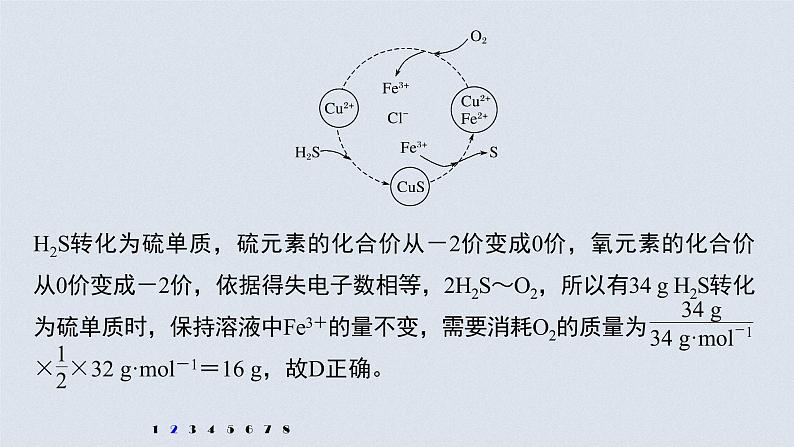
2.硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述正确的是
A.在转化过程中化合价不变的元素只有Cu和ClB.由图示的转化可得出氧化性的强弱顺序: O2>Cu2+>SC.在转化过程中能循环利用的物质只有FeCl2D.反应中当有34 g H2S转化为硫单质时,保持溶液中Fe3+的量不变,需 要消耗O2的质量为16 g
解析 根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素,故A错误;转化过程中O2把Fe2+氧化为Fe3+,Fe3+把硫离子
氧化为S,则氧化性的强弱顺序:O2>Fe3+>S,故B错误;根据图示,反应的本质是空气中的氧气氧化H2S转化为S和水,在转化过程中能循环利用的物质有FeCl2、CuCl2、FeCl3,故C错误;
3.我国科研人员发现,在钙钛矿活性层中引入稀土Eu3+/Eu2+离子对,通过循环反应可消除零价铅和零价碘缺陷,大幅提高钙钛矿电池的使用寿命,其原理如图。下列说法正确的是
A.Eu3+/Eu2+离子对在反应过程中不断损耗,需定时补充B.消除零价碘的过程中,Eu3+/Eu2+离子对发生还原反应C.消除零价铅的反应为:2Eu3++Pb0===2Eu2++Pb2+D.整个过程实质上将电子从I0转移给Pb0
解析 Eu3+/Eu2+离子对在反应过程中循环使用,不会损耗,A选项错误;消除零价碘的过程中,发生反应I0+Eu2+===Eu3++I-,反应中Eu2+失去电子发生氧化反应生成Eu3+,B选项错误;
消除零价铅的反应为:2Eu3++Pb0===2Eu2++Pb2+,C选项正确;整个过程中,Pb0失去电子,I0得到电子,即电子从Pb0转移给I0,D选项错误。
4.碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示。步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制得碱式氯化铜。下列有关说法错误的是A.a、b、c之间的关系式为a=2b+2cB.图中M、N分别为Fe3+、Fe2+C.为了除去CuCl2溶液中的杂质Fe3+,可加入过量的CuO、过滤D.若制备1 ml CuaClb(OH)c·xH2O,理论上消耗11.2a L(标准状况)O2
解析 根据化合物中正、负化合价的代数和为0,可知2a=b+c,A选项错误;Fe3+水解使溶液显酸性,CuO与H+反应产生Cu2+和水,当溶液的pH增大到一定程度,Fe3+
形成Fe(OH)3而除去,从而达到除去Fe3+的目的,C选项正确;若制备1 ml CuaClb(OH)c·xH2O,转移的电子数为2a ml,根据得失电子守恒,理论上消耗0.5a ml O2,标准状况下的体积为11.2a L,D选项正确。
5.BMO(Bi2MO6)是一种高效光催化剂,可用于光催化降解苯酚,反应原理如右图所示。下列说法错误的是
B.反应过程中BMO表现较强氧化性C.在酸性条件下,反应①的离子方程式是
D.过程①和②中被降解的苯酚的物质的量之比为3∶1
解析 根据分析可知,该过程中苯酚在光照、BMO作催化剂的条件下被氧气氧化生成CO2和H2O,反应方程式为C6H5OH+7O2 6CO2+3H2O,A选项正确;
通过分析可知,BMO在光催化降解苯酚过程中表现出了还原性,生成了BMO+,B选项错误;
7.整合流程信息书写方程式(1)二硫化钨(WS2,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如下:
①写出FeWO4在碱熔过程中发生反应的化学方程式:____________________________________________________。
②滤渣Ⅰ中主要成分的形成可用离子方程式表示为______________________________________。
①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式:________________________________________________________。
(2)软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
3MnO2+2FeS+6H2SO4 Fe2(SO4)3+3MnSO4+2S↓+6H2O
(3)含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
8.(1)高锰酸钾纯度的测定:称取1.080 0 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.200 0 ml·L-1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为________(保留小数点后两位)。
则1.080 0 g样品中含KMnO4的物质的量为:
KMnO4的质量为:m=0.006 536 ml×158 g·ml-1=1.032 688 g。
2022年高考化学二轮复习 第8章 第42讲 专项提能特训16 化工流程中的Ksp计算 (含解析)课件PPT: 这是一份2022年高考化学二轮复习 第8章 第42讲 专项提能特训16 化工流程中的Ksp计算 (含解析)课件PPT,共26页。PPT课件主要包含了Fe2++2H+,0×10-3,CaO,易生成硫酸钙微溶物,75×10-6,TiOOH+等内容,欢迎下载使用。
2022年高考化学二轮复习 第2章 第12讲 专项提能特训1 从氧化还原反应的视角分析“化工生产”中的物质变化 (含解析)课件PPT: 这是一份2022年高考化学二轮复习 第2章 第12讲 专项提能特训1 从氧化还原反应的视角分析“化工生产”中的物质变化 (含解析)课件PPT,共26页。PPT课件主要包含了FeWO4+O2+,62%,淀粉溶液等内容,欢迎下载使用。
2022高考化学一轮复习(步步高)第八章 第42讲 专项提能特训16 化工流程中的Ksp计算课件: 这是一份2022高考化学一轮复习(步步高)第八章 第42讲 专项提能特训16 化工流程中的Ksp计算课件,共26页。PPT课件主要包含了Fe2++2H+,0×10-3,CaO,易生成硫酸钙微溶物,75×10-6,TiOOH+等内容,欢迎下载使用。












