



2022高三一轮复习化学 第五章 第16讲 原子结构 化学键课件
展开考点 1 原子结构 核素 同位素
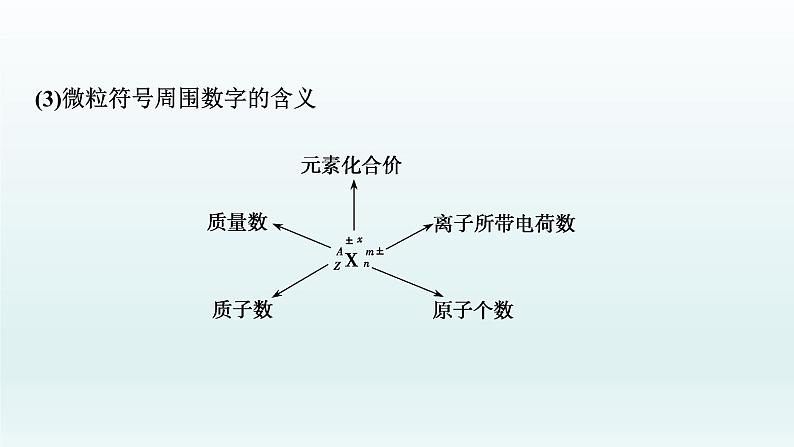
(2)微粒之间的关系①质量数(A)=________(Z)+________(N);②原子中:质子数(Z)=核电荷数=____________;③阳离子的核外电子数=质子数-____________________;④阴离子的核外电子数=质子数+____________________。
(3)微粒符号周围数字的含义
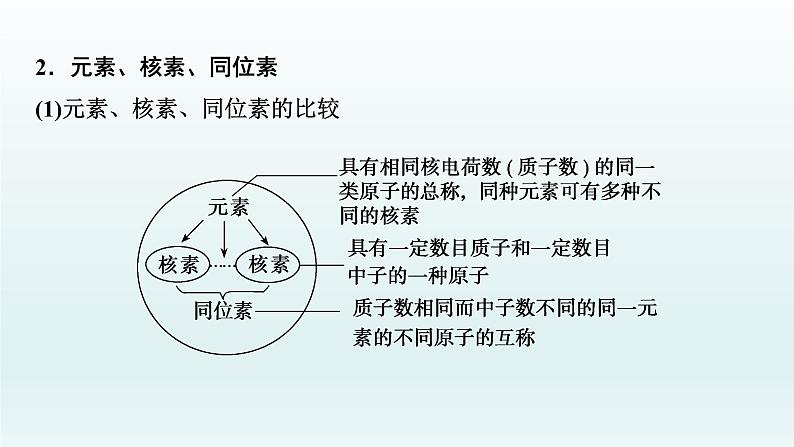
2.元素、核素、同位素(1)元素、核素、同位素的比较
(2)同位素的特征①同一元素的各种核素的________不同,________相同,化学性质______________,物理性质______;②同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
(4)几种重要的核素的用途
3.两种相对原子质量(1)原子(即核素)的相对原子质量:一个原子(即核素)的质量与12C质量的____的比值。(2)元素的相对原子质量:是按该元素各种天然同位素原子所占的原子百分比算出的平均值。如:Ar(Cl)=Ar(35Cl)×a%+Ar(37Cl)×b%。
2.由1H、2H、3H与16O、17O、18O可形成________种水分子,这些水分子的化学性质________(填“相同”或“不相同”)。答案:18 相同
题组二 各种粒子之间的关系3.等质量的H2O和D2O:物质的量之比:____________。中子数之比:____________。质子数之比:____________电子数之比:____________答案:10∶9 8∶9 10∶9 10∶9
4.“神舟六号”所用动力燃料之一为氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7。(1)等物质的量的三种物质质子数之比为_________________________。(2)等物质的量的三种物质中子数之比为_________________________。(3)等物质的量的三种物质的摩尔质量之比为_____________________。答案:(1)1∶1∶1 (2)4∶5∶6 (3)8∶9∶10
题组三 相对原子质量5.氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23%≈35.453中( )A.75.77%表示35Cl的质量分数B.24.23%表示35Cl的丰度C.35.453表示氯元素的相对原子质量D.36.966表示37Cl的质量数
解析:在计算式中,34.969、36.966分别表示35Cl和37Cl的相对原子质量,75.77%表示35Cl的丰度(即原子个数百分比或原子物质的量百分比),24.23%表示37Cl的丰度。35.453表示氯元素的相对原子质量。
考点 2 核外电子排布规律1.核外电子排布规律
3.核外电子排布与元素性质的关系(1)金属元素原子的最外层电子数一般小于4,较易_____电子,而形成阳离子,表现出_____性,在化合物中显正化合价。(2)非金属元素原子的最外层电子数一般大于或等于4,较易_______电子,活泼非金属原子易形成阴离子。在化合物中主要显负化合价。(3)稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为0价。
1.根据教材必修2 P13思考:人们得出原子核外电子排布规律的依据是什么?____________________________________________________________________________________________________________________________提示:原子光谱和理论分析(其中包括元素周期表的启示)。
2.如图为几种粒子的结构示意图,完成以下填空。
(1)属于阳离子结构的粒子是________(填序号,下同)。(2)具有稳定结构的原子是________________。(3)只能得电子的粒子是_________;只能失电子的粒子是_________;既能得电子,又能失电子的粒子是________________。(4)某元素R形成的氧化物为R2O3,则R的离子结构示意图可能是________。提示:(1)③⑤⑧ (2)② (3)③⑤ ①④⑥ ⑦⑧ (4)⑤
(1)最外层电子数为8的“粒子”一定是稀有气体元素原子。( )(2)核外电子排布相同的微粒,化学性质也相同。( )(3)除Li外的碱金属原子次外层都有8个电子。( )(4)某原子M层上电子数为L层电子数的4倍。( )(5)某元素的原子最外层只有一个电子,则它一定是金属元素。( )(6)同一元素的不同核素原子核外电子排布不同。( )
思维建模:寻找“等电子”粒子的思维方法1.寻找“10电子”粒子和“18电子”粒子的方法(1)“10电子”粒子
(2)“18电子”粒子
2.记忆其他等电子粒子“2电子”的粒子:He、H-、Li+、Be2+、H2。“9电子”的粒子:—F、—OH、—NH2、—CH3(取代基)。“14电子”的粒子:Si、N2、CO。“16电子”的粒子:S、O2、C2H4、HCHO。
解析:(1)当x-y=10时,x=10+y,说明核电荷数等于核外电子数,所以该粒子应为原子。(2)当y=8时,应为有18个电子的粒子,所以可能为氩原子、氯离子、硫离子、钾离子、钙离子等。(3)y=3时粒子为铝原子,y=7时粒子为氯原子,其最高价氧化物对应的水化物分别为氢氧化铝和高氯酸,反应的离子方程式为Al(OH)3+3H+===Al3++3H2O。答案:(1)原子(2)氩原子 氯离子 硫离子 钾离子 钙离子(答案合理即可)(3)Al(OH)3+3H+===Al3++3H2O
2.按要求填空(均为短周期元素)。(1)最外层电子数为1的元素有________(填元素符号,下同)。(2)最外层电子数为2的元素有________。(3)最外层电子数与次外层电子数相等的元素有________。(4)最外层电子数是次外层电子数2倍的元素是________。(5)最外层电子数是次外层电子数3倍的元素是________。(6)次外层电子数是最外层电子数2倍的元素有________。答案:(1)H、Li、Na (2)He、Be、Mg (3)Be、Ar (4)C (5)O(6)Li、Si
(7)内层电子总数是最外层电子数2倍的元素有________。(8)电子层数与最外层电子数相等的元素有________。(9)最外层电子数是电子层数2倍的元素有________。(10)最外层电子数是电子层数3倍的元素有________。答案:(7)Li、P (8)H、Be、Al (9)He、C、S (10)O
考点 3 化学键 分子间作用力1.化学键(1)化学键的定义及分类
(2)化学反应的本质:反应物的旧化学键________与生成物的新化学键______。
2.离子键与共价键比较
3.离子化合物与共价化合物
5.分子间作用力(1)定义:把分子聚集在一起的作用力,又称范德华力。(2)规律:一般来说,对于组成与结构相似的物质,相对分子质量______,分子间作用力越大,物质的熔、沸点也______。例如,熔、沸点:I2>Br2>Cl2>F2。
6.氢键(1)定义分子之间存在的一种比__________________的相互作用。(2)形成条件除H外,形成氢键的原子通常有__________。(3)氢键存在广泛,如蛋白质分子、醇、羧酸分子、H2O、NH3、HF等分子之间。分子间氢键会使物质的熔点和沸点______。
根据教材必修2 P23“思考与交流”,归纳判断离子化合物与共价化合物的三种方法。____________________________________________________________________________________________________________________________
(1)化学键是相邻离子或原子间的一种强作用力,既包括静电吸引力,又包括静电排斥力。( )(2)非金属元素组成的化合物中只含共价键。( )(3)非金属元素的两个原子之间一定形成共价键,但多个原子间也可能形成离子键。( )(4)由活泼金属元素与活泼非金属元素形成的化学键都是离子键。( )(5)最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键。( )
1.学科思想:化学键与物质类别关系的归纳与整合
2.思维建模:电子式的书写方法及误区提醒(1)电子式的书写方法
(2)电子式书写常见的四大误区
3.方法总结:8电子结构的判断方法(1)经验规律法①凡符合最外层电子数+|化合价|=8的皆为8电子结构。②原子序数≤5的原子不能形成8电子稳定结构。
题组一 化学键及化合物类别的判断1.有以下9种物质:①Ne ②HCl ③P4 ④H2O2 ⑤Na2S ⑥NaOH ⑦Na2O2 ⑧NH4Cl ⑨AlCl3请用上述物质的序号填空:(1)不存在化学键的是_____________________________。(2)只存在极性共价键的是____________________________。(3)只存在非极性共价键的是______________________________。答案:(1)① (2)②⑨ (3)③
(4)既存在非极性共价键又存在极性共价键的是________________。(5)只存在离子键的是________________________________。(6)既存在离子键又存在共价键的是________________________。(7)属于共价化合物的是_______________________。答案:(4)④ (5)⑤ (6)⑥⑦⑧ (7)②④⑨
4.写出下列物质的结构式:N2:________;H2O:________;CO2:________;H2O2:________。
题组三 8电子稳定结构的判断5.下列各原子都满足8电子稳定结构的化合物是________(填字母)。A.C6H6 B.HCN C.CO2 D.CS2 E.N2F.PCl3 G.PCl5 H.BCl3 I.CCl4答案:CDEFI
题组四 物质溶解或熔化过程中化学键的变化6.(2021·南宁模拟)每组物质发生状态变化时,所克服的粒子间的相互作用属于同种类型的是( )A.食盐和蔗糖熔化 B.钠和硫熔化C.碘和干冰升华D.SiO2和Na2O熔化
7.在下列物质溶于水的变化过程中:A.将SO2通入水中 B.烧碱溶于水 C.将HCl通入水中 D.硫酸氢钠溶于水 E.蔗糖溶于水 F.过氧化钠溶于水(1)只破坏共价键的是________(填字母,下同)。(2)只破坏离子键的是________。(3)既有离子键被破坏又有共价键被破坏的是________。(4)没有化学键破坏的是________。(5)属于化学过程的为________。答案:(1)AC (2)B (3)DF (4)E (5)AF
3.理解三条原子核外电子排布的规律(1)能量最低原则。(2)每层最多容纳2n2个电子。(3)最外层电子数不超过8(K层为最外层不超过2),次外层电子数不超过18,倒数第三层电子数不超过32。4.掌握原子中的两个关系(1)质子数=核电荷数=核外电子数=原子序数(2)质量数(A)=质子数(Z)+中子数(N)
5.能正确书写四类电子式(1)原子(2)离子(3)离子化合物(4)非金属单质及共价化合物6.离子化合物、共价化合物的判断方法7.分子间作用力与氢键
1.(2020·浙江7月选考)下列说法正确的是( )A.35Cl和37Cl是两种不同的元素B.单晶硅和石英互为同素异形体C.HCOOH和HOCH2CHO互为同系物D.H与Na在元素周期表中处于同一主族
3.(2017·高考海南卷)下列分子中,其中子总数为24的是( )A.18O3 B.2H217O2C.14N16O2D.14C16O2解析:A项,1 ml 18O中含有中子的物质的量为(18-8)ml=10 ml,即1 ml 18O3中含有中子的物质的量为3×10 ml=30 ml,错误;B项,1 ml 2H217O2中含有中子的物质的量为(2×1+2×9)ml=20 ml,错误;C项,1 ml 14N16O2中含有中子的物质的量为(7+2×8)ml=23 ml,错误;D项,1 ml 14C16O2中含有中子物质的量为(8+2×8)ml=24 ml,正确。
第16讲 原子结构 化学键(一)-备战2024年高考化学一轮复习精品课件(全国通用): 这是一份第16讲 原子结构 化学键(一)-备战2024年高考化学一轮复习精品课件(全国通用),共20页。PPT课件主要包含了原子构成,质子数,中子数,核外电子数,阳离子所带的电荷数,阴离子所带的电荷数,几乎完全相同,相对原子质量,元素的相对原子质量,原子的相对原子质量=等内容,欢迎下载使用。
2022年高考化学一轮复习课件 第5章 第27讲 原子结构 化学键 (含解析): 这是一份2022年高考化学一轮复习课件 第5章 第27讲 原子结构 化学键 (含解析),共60页。PPT课件主要包含了复习目标,课时精练巩固提高,真题演练明确考向,内容索引,知识梳理·夯基础,原子核,同位素,核外电子数,质子数Z,中子数N等内容,欢迎下载使用。
高考化学一轮复习课件第5章第1讲 原子结构 化学键(含解析): 这是一份高考化学一轮复习课件第5章第1讲 原子结构 化学键(含解析),共60页。PPT课件主要包含了知识点1,中子数,质子数,知识点2,知识点3,阳离子,最外层电子,共价键,离子键,范德华力等内容,欢迎下载使用。












