




2022高三一轮复习 第三章 第11讲 镁、铜及其化合物 金属冶炼课件
展开考点 1 镁及其化合物的性质及用途1.镁(1)物理性质:具有银白色金属光泽的固体。(2)化学性质(写化学方程式):①与O2反应:_____________________(发出耀眼白光);②与N2反应:_____________________;
③与CO2反应:__________________________;④与沸水反应:_______________________________。(3)用途:生产合金,冶金工业上用作还原剂和脱氧剂。
2.氧化镁(1)物理性质:白色____溶于水的固体,熔点高。(2)化学性质:MgO+2H+===Mg2++H2O。(3)用途:耐火材料。
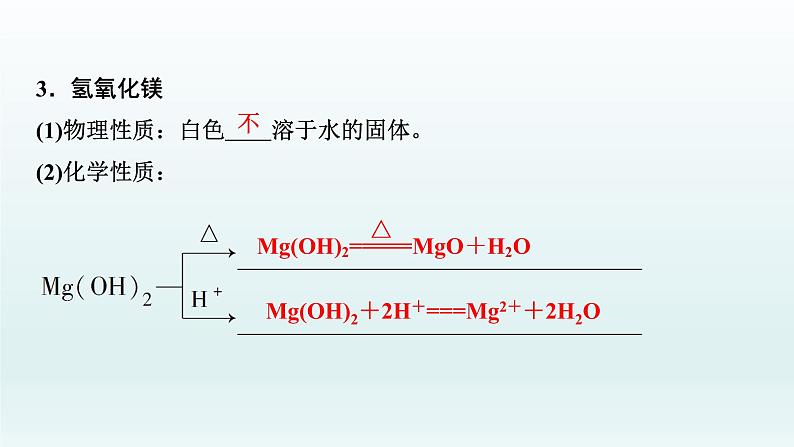
3.氢氧化镁(1)物理性质:白色 溶于水的固体。(2)化学性质:
Mg(OH)2+2H+===Mg2++2H2O
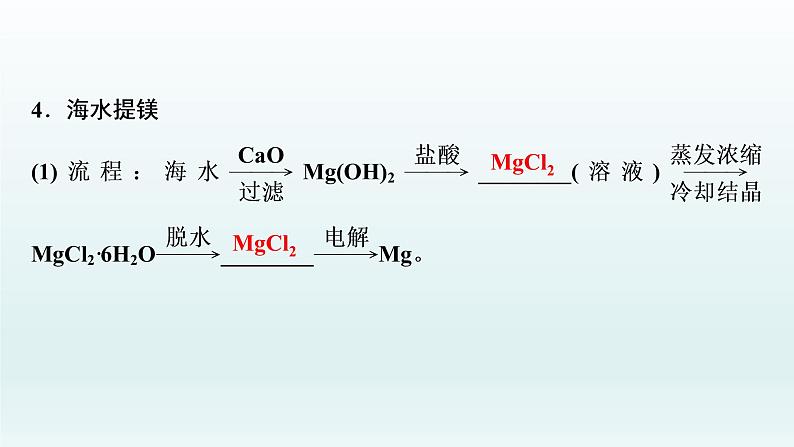
(2)涉及的部分化学反应:MgCl2→Mg(OH)2:_______________________________________;Mg(OH)2→MgCl2:_________________________________;MgCl2→Mg:____________________________。
MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl===MgCl2+2H2O
结合教材必修1 P46图3-2“镁条燃烧”,写出燃烧过程中可能发生反应的化学方程式。____________________________________________________________________________________________________________________________
(1)Mg在空气中燃烧,产物只是MgO。( )(2)镁着火不可以用CO2灭火,钠着火也不可以用CO2灭火。( )(3)镁、铝、硫酸构成原电池,镁作负极。( )(4)镁、铝、NaOH溶液构成原电池,镁作负极。( )(5)下列转化关系均可通过一步反应实现:Mg―→MgO―→Mg(OH)2―→MgCl2。( )(6)1 ml Mg与足量盐酸反应时,转移2NA个电子。( )
题组一 镁及其化合物的性质与应用1.镁粉是焰火、闪光粉、鞭炮中不可缺少的原料。工业上制造镁粉是将镁蒸气在某种气体中冷却,有下列气体:①空气、②CO2、③Ar、④H2、⑤N2,其中可作为冷却气体的是 ( )A.①和② B.②和③C.③和④ D.②和④解析:与镁蒸气不发生反应的Ar、H2均可作为冷却气体。
2.甲、乙为单质,丙、丁为氧化物,它们存在如图反应(反应条件省略)。下列各组的甲、乙一定不符合的是( )A.铝和铁 B.氟和氧C.碳和硅 D.镁和碳解析:甲为氟,乙为氧,氟气和水反应生成氢氟酸和氧气,氢氟酸不属于氧化物,B不符合。
题组二 海水提镁3.如图为利用海水制备部分物质的过程。下列有关说法正确的是( )A.制取NaHCO3的反应是利用其溶解度小于NaCl的溶解度B.用澄清石灰水可鉴别NaHCO3溶液和Na2CO3溶液C.在第③、④、⑤步骤中,溴元素均被氧化D.加热MgCl2溶液制取无水氯化镁
解析:分别向碳酸钠和碳酸氢钠溶液中加入澄清石灰水,均有白色沉淀产生,现象相同,不能鉴别,B错误;第④步中,SO2+2H2O+Br2===H2SO4+2HBr中S元素的化合价升高,则二氧化硫被氧化,溴元素被还原,C错误;需要在氯化氢气流中加热才能得到无水氯化镁,D错误。
4.海水中蕴藏着丰富的资源。除从海水中可制得食盐外,还可以制取镁、钾、溴及其化工产品。从海水中制取金属镁、溴的化工流程如图:已知:MgO的熔点为2 800 ℃,MgCl2的熔点为712 ℃。回答下列问题:(1)操作2的方法是_________,操作3具体指______________________。答案:(1)过滤 蒸发浓缩、降温结晶
(2)操作1粗盐精制主要是要除去粗盐中的Ca2+、Mg2+、SO,以下试剂顺序合理的组合是________(填字母)。①稀盐酸 ②NaOH ③Na2CO3 ④BaCl2a.②③④① b.③②④①c.④②③① d.④③①②(3)SO2水溶液可以起到富集溴的目的,该溶液吸收溴的离子反应方程式是_____________________________________________________________________________________________________________________。
(4)写出电解MgCl2制取Mg的化学方程式:________________________________________________________________________________。(5)有同学认为上述流程过于复杂,可直接加热Mg(OH)2得到MgO,再电解熔融的MgO制取金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?______(填“同意”或“不同意”),请说出你同意或不同意的理由:___________________________________________________________________________________________。
考点 2 铜及其化合物1.单质铜(1)物理性质:_____色固体,具有良好的延展性、导热性和导电性。
①写出下列化学方程式:铜在空气中加热:____________________。铜丝在硫蒸气中反应:__________________。铜丝在Cl2中反应:___________________。②常温下,铜在干燥的空气中性质稳定,但在潮湿的空气中则会被锈蚀,在其表面逐渐形成一层绿色的铜锈。有关化学方程式为_____________________________________。
2Cu+O2+CO2+H2O===Cu2(OH)2CO3
3.氢氧化铜(1)物理性质:___色不溶于水的固体。(2)化学性质及应用:
4.铜盐(1)Cu2(OH)2CO3的名称为____________,是铜绿、孔雀石的主要成分,受热分解可生成黑色的氧化铜,化学方程式:______________________________________。(2)CuSO4·5H2O为蓝色晶体,俗称____________,其受热分解的化学方程式为_______________________________,蓝色晶体受热转化为白色粉末。无水CuSO4遇水变____色(生成CuSO4·5H2O),据此可用来检验水的存在。
1.结合教材必修1 P62资料卡片,回答下列问题:(1)古人很早就掌握了冶铜技术的原因是什么?(2)铜属于重金属,为什么日常生活中可以使用铜器皿加工食物?____________________________________________________________________________________________________________________________提示:(1)铜的化学性质不活泼,铜的化合物易被还原为铜单质。(2)铜化学性质不活泼,铜不易形成含铜的化合物,故使用铜器皿比较安全。
2.Cu与稀H2SO4不反应,但在通入O2的条件下,Cu可在稀H2SO4中逐渐溶解,试写出反应的化学方程式。____________________________________________________________________________________________________________________________提示:2Cu+O2+2H2SO4===2CuSO4+2H2O
(1)CuO是黑色固体,与水反应生成Cu(OH)2。( )(2)铜锈是铜被空气中的氧气缓慢氧化生成的氧化物。( )(3)无水硫酸铜可用于检验酒精中是否含有水。( )(4)将铜片置于干燥的空气中,不易被腐蚀。( )(5)CuSO4·5H2O失去结晶水属于物理变化。( )
(6)用稀硝酸清除铜制品上的铜锈。( )(7)过量铜与浓硝酸反应,产生的气体中有NO2、NO和H2。( )(8)铜是导电性最好的金属材料。( )(9)Cu2(OH)2CO3是铜锈的主要成分。( )(10)将CuCl2溶液在蒸发皿中加热蒸干,制得无水CuCl2固体。( )
对三个方案进行评价,你认为最好的是哪个方案?答案:方案(1):产生污染性气体,且消耗硫酸较多;方案(2):消耗能量较多,且步骤复杂;方案(3):不产生污染性气体,原料利用率高,节约能源。因此方案(3)更合理
题组一 铜及其化合物的性质及应用1.我国宋代沈括在《梦溪笔谈》中记载:“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。熬胆矾铁釜,久之亦化为铜。”下列对文中词语的理解,正确的是( )A.“苦泉”中泉水属于胶体B.“熬”表示加热蒸馏C.“胆矾”化学式为CuSO4D.“化”表示置换转化
2.某研究小组通过实验探究Cu及其化合物的性质,下列操作正确且能达到实验目的的是 ( )A.将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿
解析:铜丝与浓硫酸反应后,仍有大量浓硫酸存在,不能把水加入反应器中,否则会发生危险,A项错误,Cu与Cl2在常温下不反应,需要加热才能发生反应,B项错误;CuCl2水解生成的HCl易挥发,加热蒸干能促进CuCl2的水解而得不到CuCl2固体,C项错误。
题组二 铜及其化合物的制取3.工业上由黄铜矿(主要成分为CuFeS2)冶炼铜的主要流程如图: (1)气体A中的大气污染物可选用下列试剂中的________(填字母)吸收。a.浓硫酸 b.稀硝酸c.NaOH溶液 d.氨水(2)由泡铜冶炼粗铜的化学方程式为_________________________________________________________________________________________。
(3)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________(填字母)。a.电能全部转化为化学能b.粗铜接电源正极,发生氧化反应 c.溶液中Cu2+向阳极移动d.从阳极泥中可回收Ag、Pt、Au等金属(4)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为__________________________________________________________________________________。答案:(3)bd (4)4H++O2+4e-===2H2O
粗铜中铜的含量为99.5%~99.7%,主要含有Ag、Zn、Fe、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%~99.98%的铜。电解精炼铜的原理是用粗铜作阳极,失电子变为Cu2+,用纯铜棒作阴极即可得精铜。
考点 3 金属材料与金属矿物的开发利用1.合金的概念及性能
2.常见的金属材料(1)金属材料分类:
(2)几种常见的合金:①
3.金属矿物的开发利用(1)金属在自然界中的存在:(2)金属冶炼的实质:金属的冶炼过程就是把金属从________态还原为________态的过程。即:________________(写反应通式,用M表示金属)。
Mn++ne-===M
(3)金属冶炼的方法(用化学方程式表示):
结合教材必修2 P89实验4-1,多角度认识铝热反应,并填空:
(1)金属元素的单质只有还原性,其离子只有氧化性。( )(2)金属元素的单质在常温下均为固体。( )(3)合金材料中不可能含有非金属元素。( )(4)铁是人类在生产、生活中最早使用的金属。( )(5)合金的硬度一般大于成分金属,而熔点一般低于成分金属。( )(6)金属氧化物与铝粉的混合物都是铝热剂。( )(7)人类历史上使用铝的时间比铁晚,原因是铝的冶炼成本高。( )(8)电解氯化镁溶液制取金属镁。( )
(1)用H2还原法冶炼得到的金属,纯度高,但成本也高;用CO和C还原法冶炼得到的金属,纯度低,冶炼成本也低。(2)用热还原法制得的铜须用电解精炼法进行提纯。(3)金属冶炼与金属活动性的关系:
题组一 合金的形成条件1.表中是四种金属的熔、沸点数据:
(1)根据表中数据,归纳出两种金属不能形成合金的有哪些组合?___________________________________________________________。(2)概括出能形成合金的两种金属应具备的条件。_____________________________________________________________________________________________________________________。答案:(1)NaCu,NaFe(2)要形成合金,各成分都要有共同的液态温度范围,即合金中一种金属的熔点要高于另一种金属的熔点而低于它的沸点
题组二 金属冶炼方法2.黄铜(铜、锌合金)因外观与黄金相似又俗称“药金”。回答相关问题。(1)鉴别黄金与“药金”可采用________________方法。(2)古代“药金”冶炼方法如下:将碳酸锌、赤铜(Cu2O),木炭混合加热至800 ℃,得到金光闪闪的“药金”。该冶炼方法属于________法,冶炼过程中Cu2O反应的化学方程式为___________________________。
答案:弱 Ba的沸点比Al低,高温变成Ba蒸气,促进反应向右进行
题组三 铝热反应及应用4.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:①取适量A进行铝热反应,产物中有单质B生成;②另取20 g A全部溶于0.15 L 6.0 ml·L-1盐酸中,得溶液C;③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。
请填空:(1)产物中的单质B是________。 (2)②中所发生的各反应的化学方程式是______________________________________________________________________________________。(3)③中所发生的各反应的离子方程式是______________________________________________________________________________________。(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为________,c(Fe2+)为________。
答案:(1)Fe (2)Fe2O3+6HCl===2FeCl3+3H2O,MgO+2HCl===MgCl2+H2O(3)Fe+2H+===Fe2++H2↑,Fe+2Fe3+===3Fe2+(4)0.67 ml·L-1 2.33 ml·L-1
题组四 新素材命题5.武德合金是用50%铋(Bi)、25%铅(Pb)、12.5%锡(Sn)和12.5%镉(Cd)制成的。它的熔点是70 ℃,比所有标准条件下为固态的金属熔点都低。把武德合金制成的保险丝安装在电闸盒中,如果电路中发生短路或超载,电流过大,导线便会发热,当温度升高到70 ℃时,保险丝熔断,保护电器设备,防止火灾发生。西班牙人乌罗阿和武德分别于1935年和1941年发现了铂主要以游离态和合金形式存在。因此,为了纪念武德,人们将这种特殊的合金命名为武德合金。钢中加入微量铋,可改善钢的加工性能,可锻铸铁加入微量铋,能使可锻铸铁具备类似不锈钢的性能。
结合上述材料,回答下列问题:问题1.铋的还原熔炼:原理是Bi2O3与还原剂煤粉在高温下发生反应,写出发生反应的化学方程式。(素养角度——宏观辨识与微观探析)问题2.铋的置换熔炼:原理是Bi2S3加置换剂铁屑在高温下置换,写出发生反应的化学方程式。(素养角度——证据推理与模型认知)问题3.含+4价的铅元素的化合物具有强氧化性,PbO2的氧化性比Cl2的氧化性还强,在实验室中也可用PbO2和浓盐酸反应制取Cl2,写出发生反应的化学方程式。(素养角度——变化观念与平衡思想)
1.镁的特殊反应(1)镁在空气中燃烧除生成氧化镁外,还有少量的氮化镁。(2)镁能在二氧化碳中燃烧,生成氧化镁和碳。2.特殊的颜色Cu、Cu2O—红色,CuO—黑色,Cu(OH)2—蓝色,CuSO4—白色,CuSO4·5H2O—蓝色,Cu2(OH)2CO3—绿色。
1.(2020·高考全国卷Ⅲ)宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料[主要成分为Cu(OH)2·CuCO3],青色来自蓝铜矿颜料[主要成分为Cu(OH)2·2CuCO3]。下列说法错误的是( )A.保存《千里江山图》需控制温度和湿度B.孔雀石、蓝铜矿颜料不易被空气氧化C.孔雀石、蓝铜矿颜料耐酸耐碱D.Cu(OH)2·CuCO3中铜的质量分数高于Cu(OH)2·2CuCO3解析:孔雀石、蓝铜矿的主要成分均能与酸反应,C错误。
(4)(2016·高考全国卷Ⅱ)除去Cu粉中混有的CuO的方法是加入稀硝酸溶解、过滤、洗涤、干燥。( )(5)(2015·高考全国卷Ⅰ)将铜粉加入1.0 ml·L-1 Fe2(SO4)3溶液中,现象是溶液变蓝,有黑色固体出现。( )
3.(2018·高考全国卷Ⅱ)我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1 ml·L-1]形成氢氧化物沉淀的pH范围如表所示:
回答下列问题:(1)焙烧过程中主要反应的化学方程式为______________________________________________________________________________________。(2)滤渣1的主要成分除SiO2外还有________;氧化除杂工序中ZnO的作用是________________,若不通入氧气,其后果是______________。(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为___________。(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为___________;沉积锌后的电解液可返回________工序继续使用。
2023年高考化学一轮复习镁铝铜金属材料 金属冶炼课件: 这是一份2023年高考化学一轮复习镁铝铜金属材料 金属冶炼课件,共60页。
2022年高考化学一轮复习课件 第3章 第17讲 镁、铝、铜及其化合物 金属冶炼 (含解析): 这是一份2022年高考化学一轮复习课件 第3章 第17讲 镁、铝、铜及其化合物 金属冶炼 (含解析),共60页。PPT课件主要包含了复习目标,真题演练明确考向,课时精练巩固提高,考点二铜及其化合物,内容索引,知识梳理·夯基础,化合态,Al+3Cl2,Mg+N2,Mg+2H2O等内容,欢迎下载使用。
人教版高考化学一轮复习限时集训9金属的冶炼铝铜及其化合物课件: 这是一份人教版高考化学一轮复习限时集训9金属的冶炼铝铜及其化合物课件,共60页。PPT课件主要包含了A组基础达标练,B组能力提升练等内容,欢迎下载使用。












