




2022高三一轮复习 第三章 第9讲 铝及其化合物课件
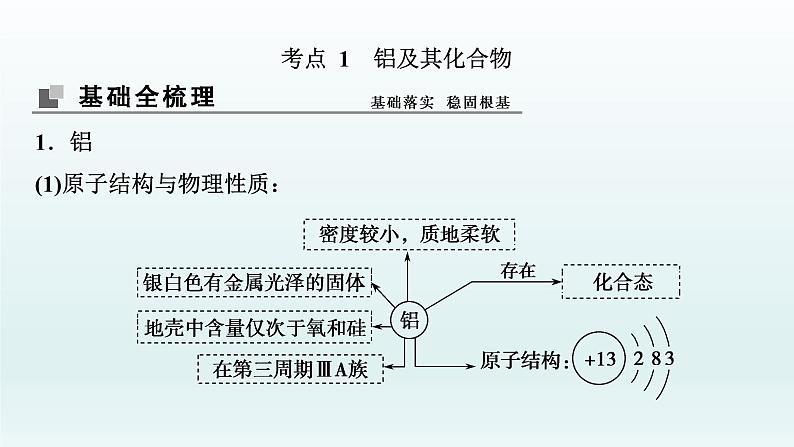
展开考点 1 铝及其化合物1.铝(1)原子结构与物理性质:
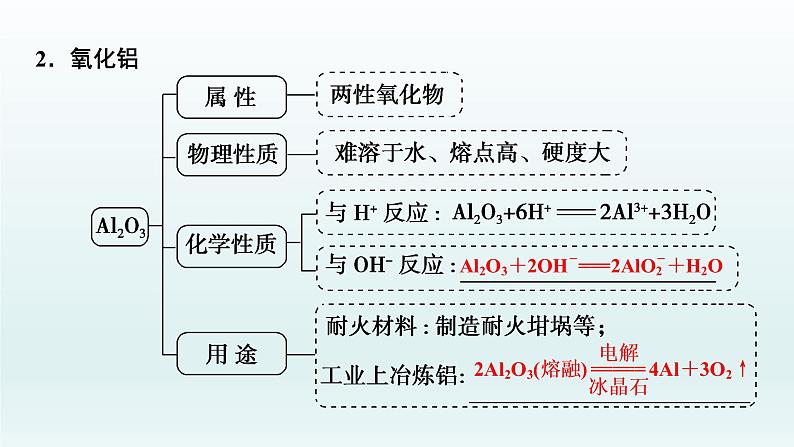
2Al+6HCl===2AlCl3+3H2↑
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
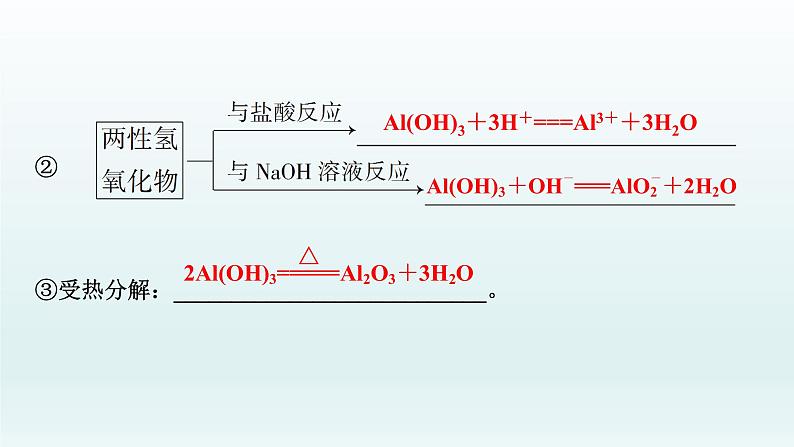
3.氢氧化铝(1)物理性质:白色胶状不溶于水的固体。(2)化学性质:①Al(OH)3的电离:
②③受热分解:___________________________。
Al(OH)3+3H+===Al3++3H2O
(3)制备:①向铝盐中加入氨水,离子方程式为_________________________________________;②NaAlO2溶液中通入足量CO2,离子方程式为_______________________________________;③NaAlO2溶液与AlCl3溶液混合:_____________________________________。
Al3++3NH3·H2O===
4.常见的铝盐——明矾明矾的化学式为__________________,它是无色晶体,可溶于水,水溶液pH___7。明矾可以净水,其净水的原理是___________________________________,Al(OH)3胶体颗粒吸附杂质形成沉淀而净水。
KAl(SO4)2·12H2O
1.根据教材必修1 P48科学探究1和2,归纳在空气中加热铝箔至熔化观察到的现象,并分析产生该现象的原因。____________________________________________________________________________________________________________________________2.中学化学学习阶段接触到许多既能与酸反应又能与碱反应的物质,除了Al及其重要化合物外,你还知道哪些?____________________________________________________________________________________________________________________________
提示:1.铝箔熔化,失去光泽,但铝不滴落;熔化的铝滴表面形成氧化铝保护膜,熔化的液态铝不会滴落。2.①弱酸的铵盐,如:NH4HCO3、CH3COONH4、(NH4)2S等;②弱酸的酸式盐,如:NaHCO3、KHS、NaHSO3等;③氨基酸。
(1)铝是地壳中含量最多的金属元素。( )(2)铝的导电性良好,所以可以利用铝作导线。( )(3)铝与NaOH溶液的反应中,NaOH是氧化剂。( )(4)氧化铝只能与酸反应不能与碱反应。( )(5)将AlCl3溶液蒸干灼烧,最终得到的固体是氧化铝。( )(6)明矾可以用于饮用水的杀菌消毒。( )(7)工业上用电解熔融AlCl3的方法来冶炼铝。( )
2.思维建模:制取Al(OH)3的“3”种途径归纳与整合。
3.模板构建:铝土矿冶炼铝的解题模板。
题组一 铝的性质1.(2021·广东惠州联考)足量下列物质与相同质量的铝反应,放出氢气体积相同且消耗溶质物质的量最少的是( )A.氢氧化钠溶液 B.稀硫酸C.盐酸D.稀硝酸
解析:Al与稀硝酸反应生成NO气体,D项不符合题意;由2Al+2NaOH+2H2O===2NaAlO2+3H2↑,2Al+3H2SO4===Al2(SO4)3+3H2↑,2Al+6HCl===2AlCl3+3H2↑可知,消耗溶质物质的量最少的是NaOH溶液,A项符合题意。
2.依据下列图示,写出图中有关反应的化学方程式或离子方程式。
①__________________________________________________________。②__________________________________________________________。③__________________________________________________________。④__________________________________________________________。
题组二 铝的重要化合物的性质及应用3.氧化还原反应在生产、生活中具有广泛的用途。下列做法涉及铝元素的还原性的是( )A.明矾净化水B.用氢氧化铝治疗胃酸过多C.用铝制容器存放浓硫酸D.电解熔融氧化铝制单质铝
4.设计实验除去下列物质中的杂质(括号内为杂质):(1)Mg(OH)2[Al(OH)3]____________________________________________________________________________________________________;(2)Al(OH)3[Mg(OH)2]_____________________________________________________________________________________________________;答案:(1)向混合物中加入过量NaOH溶液,过滤(其他答案合理也可)(2)向混合物中加入过量NH4Cl溶液,过滤(其他答案合理也可)
(3)MgSO4溶液[Al2(SO4)3]__________________________________________________________________________________________________;(4)Al2(SO4)3溶液(MgSO4)___________________________________________________________________________________________________。答案:(3)向溶液中加入过量MgO,过滤(向溶液中加入过量NaOH溶液后过滤,向所得沉淀中加入稀硫酸溶解即可)(4)向溶液中加入过量NaOH溶液,过滤,向滤液中通入过量CO2,过滤,再向过滤所得沉淀中加入稀硫酸溶解即可
试回答:(1)从充分利用原料、降低成本和提高产率等因素分析,实验方案最合理的是________。(2)三种方案制得的Al(OH)3质量W1、W2、W3由大到小的顺序是________。(3)制得Al(OH)3的最大质量是________。答案:(1)丙 (2)W3>W1>W2 (3)104 g
题组四 新素材命题6.随着医学的发展,人们逐渐认识到铝的危害性,铝元素不仅非人体所需,而且对人体的危害十分可怕。世界卫生组织于1989年正式将铝确定为食品污染物。人体中铝元素含量太高时,会影响肠道对磷、锶、铁、钙等元素的吸收。体内过多的铝对中枢神经系统、消化系统、脑、肝、骨、肾、细胞、造血系统、免疫功能等均有不良影响;铝在大脑和皮肤中沉积,还会加快人体的整体衰老过程,特别明显地使皮肤弹性降低、皱纹增多。近年来又发现老年痴呆症的出现也与平时过多摄入铝元素有关。
根据上述材料,回答下列问题:问题1.人们生活中铝摄取的主要途径有哪些?(素养角度——宏观辨识与微观探析)答案:问题1 提示:(1)食品。油条中的明矾和苏打,油饼中的铝盐,含铝的食品添加剂的发酵粉和膨松剂常用于蒸馒头、花卷、糕点,膨化小食品。(2)铝制品。铝锅、铝壶、铝盆等铝或铝合金制品,尤其是在炒菜时加上点醋调味,就更增加了铝的溶解。易拉罐装的饮料中铝的含量也相当高。(3)药品和饮用水等。食用明矾或其他铝盐做的净水剂,药物。
问题2.如何防止摄入和吸收过多的铝?(素养角度——证据推理与模型认知)答案:问题2 提示:(1)减少食用含铝高的发酵剂制作的食物。(2)减少自来水中的含铝量,在用铝壶烧开水时,水沸腾即可,不要烧开后煮的时间过长,以免铝的含量增加。(3)减少从药物中摄入铝,少用或不用含铝的抑酸剂。(4)减少和避免铝污染源,不要用铝制的水管,以避免铝污染。
考点 2 铝土矿冶炼金属铝的方法及步骤铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质。
1.碱溶法讨论回答下列问题:(1)写出①、③两步骤中可能发生反应的离子方程式。
______________________________________________________________________________________________________________________________________________________________________________________。
(2)步骤③中不用盐酸(或H2SO4)酸化的理由是_________________________________________________________________________________。(3)步骤④中得到较纯的Al2O3,可能含有________杂质,在电解时它不会影响铝的纯度的原因:___________________________________________________________________________________________________。
2.酸溶法讨论回答下列问题:(1)写出①、②中可能发生反应的离子方程式:_____________________________________________________________________________________________________________________________________________。
(2)步骤②中不用氨水沉淀Fe3+的原因:___________________________________________________________________________________________________________________________________________________。答案:(2)Al(OH)3只能溶于强碱,不能溶于氨水,用氨水不能将Fe(OH)3和Al(OH)3分离
1.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如图所示:
下列叙述正确的是( )A.试剂X可以是NaOH溶液,也可以是盐酸B.反应①过滤后所得沉淀为Fe(OH)3C.图中所有转化反应都不是氧化还原反应D.反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3解析:A项,试剂X不可以是盐酸;B项,反应①过滤后所得沉淀为Fe2O3;C项,电解Al2O3生成Al是氧化还原反应。
2.无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如图:已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华。(1)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为____________________________________________________。
解析:(1)由流程图可知在氯化炉中Al2O3、Cl2和焦炭在高温下发生反应生成AlCl3、CO。
(2)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围________(填字母)。a.低于183 ℃b.介于183 ℃和315 ℃之间c.高于315 ℃解析:(2)AlCl3、FeCl3分别在183 ℃、315 ℃时升华,为实现FeCl3和AlCl3的分离,应使温度介于183 ℃和 315 ℃之间。答案:(2)b
有关Al(OH)3的图像分析与计算1.可溶性铝盐溶液与NaOH溶液反应的图像
2.偏铝酸盐溶液与盐酸反应的图像
解析:AlCl3溶液与NaOH溶液混合有两种方式:向AlCl3溶液中缓慢滴加NaOH溶液,开始有沉淀生成,后沉淀溶解,且生成沉淀与沉淀溶解消耗的NaOH的物质的量之比为3∶1,显然符合题意,则x表示NaOH的物质的量,B项错误;另一种方式是向NaOH溶液中缓慢滴加AlCl3溶液,开始没有沉淀,后有沉淀生成,与本题图示情况不符。
2.向HCl、MgCl2、AlCl3、NH4Cl溶液中(假设各1 ml),逐滴加入NaOH溶液,沉淀的物质的量随NaOH溶液体积变化的图像如图。(假设Mg2+、Al3+结合OH-能力相同)
(2)依次写出各阶段的离子方程式:①OA:_____________________________________________________。②AB:_____________________________________________________。③BC:_____________________________________________________。④CD:_____________________________________________________。
(2)可溶性偏铝酸盐与强酸(如HCl)溶液反应,铝元素的存在形式。
1.(2020·高考江苏卷)下列有关物质的性质与用途具有对应关系的是 ( )A.铝的金属活泼性强,可用于制作铝金属制品B.氧化铝熔点高,可用作电解冶炼铝的原料C.氢氧化铝受热分解,可用于中和过多的胃酸D.明矾溶于水并水解形成胶体,可用于净水
解析:铝的金属活泼性强与可用于制作铝金属制品无对应关系,A项错误。氧化铝熔点高,可用作耐高温材料;铝是活泼金属,用电解法冶炼,选择氧化铝作原料,是因为氧化铝是离子化合物,B项错误。氢氧化铝具有弱碱性,可以中和过多的胃酸,C项错误。明矾的化学式为KAl(SO4)2·12H2O,Al3+发生水解生成Al(OH)3胶体,可以吸附水中悬浮的颗粒物,从而起到净水的作用,D项正确。
3.(2018·高考全国卷Ⅰ)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如图:下列叙述错误的是( )A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片”中可回收的金属元素有Al、Fe、LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠
2022高考化学一轮复习第3章金属及其化合物第2讲铝及其重要化合物课件: 这是一份2022高考化学一轮复习第3章金属及其化合物第2讲铝及其重要化合物课件,共40页。PPT课件主要包含了知识点1,知识点2等内容,欢迎下载使用。
高考化学一轮复习第3章金属及其化合物第2讲铝及其重要化合物课件: 这是一份高考化学一轮复习第3章金属及其化合物第2讲铝及其重要化合物课件,共40页。PPT课件主要包含了知识点1,知识点2等内容,欢迎下载使用。
2022高中化学一轮专题复习电子稿课件 专题2 第9讲 镁、铝及其化合物: 这是一份2022高中化学一轮专题复习电子稿课件 专题2 第9讲 镁、铝及其化合物,共60页。PPT课件主要包含了考点透视,栏目导航,课堂评价,考前8min,一样多,石灰乳原料,丰富成本低,得到的HCl气体不带,有水蒸气,烧杯玻璃棒等内容,欢迎下载使用。












