





2022高三一轮复习 第二章 第7讲 氧化还原反应方程式的配平及计算课件
展开考点 1 氧化还原反应方程式的配平1.氧化还原反应方程式配平的基本原则
2.氧化还原反应方程式配平的一般步骤
第三步:求总数,从而确定氧化剂(或还原产物)和还原剂(或氧化产物)的化学计量数。 故H2S的化学计量数为3,NO的化学计量数为2。
第四步:配系数,先配平变价元素,再利用原子守恒配平其他元素。3H2S+2HNO3===3S↓+2NO↑+4H2O。第五步:查守恒,其他原子在配平时相等,最后利用O原子守恒来进行验证。
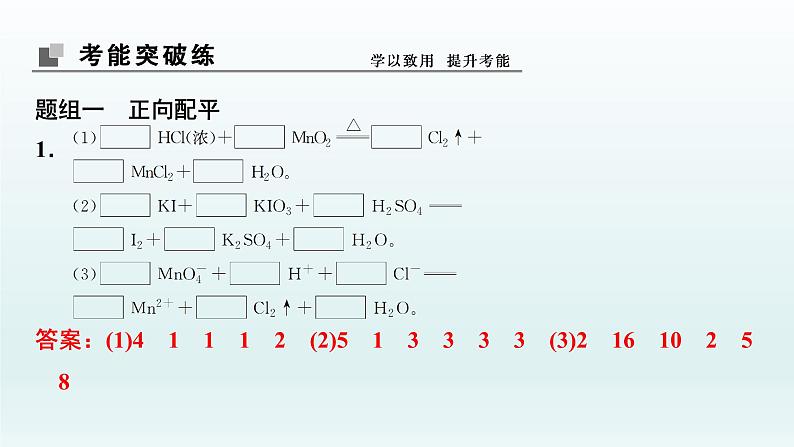
题组一 正向配平1.答案:(1)4 1 1 1 2 (2)5 1 3 3 3 3 (3)2 16 10 2 5 8
题组二 逆向配平2.答案:(1)3 6 2 1 3 (2)2 9 3 3 5
解析:(2)根据氮元素、碳元素的化合价变化,N2是氧化剂,C是还原剂,AlN为还原产物,CO为氧化产物。答案:(1)2 5 6H+ 2 5 8 (2)Al2O3 3C N2 2 3CO
四步模型法书写信息型氧化还原反应方程式“四步法”突破新情景下氧化还原反应方程式的书写
[典例1] 写出MnO2在酸性条件下与NaHSO3溶液反应的离子方程式。
[典例2] 高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3和KClO在强碱性条件下反应可以制取K2FeO4,写出其反应的离子方程式。
(2)用NaClO NaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2。写出该反应的离子方程式:___________________________________________________________________________________________________。(3)KMnO4氧化废水中Mn2+生成MnO2的离子方程式为____________。
2.SCR(选择性催化还原)工作原理如图: (1)尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式为_________________________________________________________________________________________________________________________。(2)反应器中NH3还原NO2的化学方程式为_____________________________________________________________________________________。
3.(1)利用钴渣[含C(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如图: C(OH)3溶解还原反应的离子方程式为_______________________________________________________________________________________。
(2)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。氯化钠电解法是一种可靠的工业生产ClO2方法。如图为该法工艺原理示意图。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。发生器中生成ClO2的化学方程式为___________________。
答案:(2)2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O
(3)地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式:________________________________________________________________________________________。
4.工业制备PH3的流程如图所示。(1)黄磷和烧碱溶液反应的化学方程式为__________________________________________________________,次磷酸属于________(填“一”“二”或“三”)元酸。(2)若起始时有1 ml P4参加反应,则整个工业流程中共生成________ml PH3(不考虑产物的损失)。答案:(1)P4+3NaOH+3H2O===PH3↑+3NaH2PO2 一 (2)2.5
考点 2 氧化还原反应的计算方法——电子守恒法1.氧化还原反应计算的基本方法:电子守恒法。
2.守恒法解题思维流程
题组一 两元素之间得失电子守恒问题1.24 mL浓度为0.05 ml·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 ml·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )A.+2 B.+3 C.+4 D.+5
解析:题目中指出被还原的元素是Cr,则得电子的物质必是K2Cr2O7,失电子的物质一定是Na2SO3,其中S元素的化合价从+4→+6;而Cr元素的化合价将从+6→+n(设+n为生成物中Cr元素的化合价),根据得失电子数目相等,有0.024 L×0.05 ml·L-1×(6-4)=0.02 L×0.02 ml·L-1×2×(6-n),解得n=3。
题组二 多元素之间得失电子守恒问题2.在P+CuSO4+H2O―→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 ml CuSO4可氧化P的物质的量为________ ml。生成1 ml Cu3P时,参加反应的P的物质的量为________ml。
解析:设7.5 ml CuSO4氧化P的物质的量为x,生成1 ml Cu3P 时,被氧化的P的物质的量为y。根据得失电子守恒得:7.5 ml×(2-1)=x×(5-0),解得x=1.5 ml。1 ml×3×(2-1)+1 ml×[0-(-3)]=y×(5-0),解得y=1.2 ml。所以参加反应的P的物质的量为1.2 ml+1 ml=2.2 ml。答案:1.5 2.2
题组三 多步反应得失电子守恒问题始态物质得(失)电子总数=终态物质失(得)电子总数,如a ml铜与足量的浓HNO3反应,将产生的NO2气体与b ml O2混合作用于水,气体完全被吸收。
3.14 g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12 L(标准状况下)氧气混合,通入水中恰好全部被吸收。则合金中铜的质量为( )A.9.6 g B.6.4 g C.3.2 g D.1.6 g
4.U常见化合价有+4价和+6价,硝酸铀酰[UO2(NO3)2]加热可发生分解:UO2(NO3)2―→UxOy+NO2↑+O2↑(未配平),将气体产物收集到试管中并倒扣在盛水的水槽中,气体全部被吸收,水充满试管。则生成的铀的氧化物化学式是( )A.UO2B.2UO2·UO3C.UO3D.UO2·2UO3
解析:气体被吸收,说明二氧化氮、氧气和水发生的反应为4NO2+O2+2H2O===4HNO3,所以二氧化氮和氧气的计量数之比是4∶1,根据氧化还原反应中得失电子总数相等知,U元素的化合价不变,所以生成物是UO3,故选C。
题组四 新素材命题5.亚铁氰化钾别名黄血盐,化学式:K4Fe(CN)6·3H2O。为浅黄色单斜体结晶或粉末,无臭,略有咸味,常温下稳定。具有抗结性能,可用于防止细粉、结晶性食品板结。例如,食盐长久堆放易发生板结,加入亚铁氰化钾后食盐的正六面体结晶转变为星状结晶,从而不易发生结块。亚铁氰化钾K4[Fe(CN)6]在爆炸中可分解成一种剧毒盐KCN。
阅读上述材料,回答下列问题:问题1:已知爆竹爆炸后,K4[Fe(CN)6]会发生分解,除生成剧毒盐KCN外,还生成三种稳定的单质。试写出反应的化学方程式。(素养角度——变化观念与平衡思想)
问题2:含CN-的污水危害很大,处理污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-。CNO-在酸性条件下继续被NaClO氧化生成N2和CO2。试写出上述两步反应的离子方程式。(素养角度——科学态度与社会责任)
1.方程式配平步骤:标变价、列变化、求总数、配系数、查守恒。2.方程式的计算:根本原则就是利用电子守恒建立物质之间的比例关系,写出守恒式:n(氧化剂)×变价原子个数×化合价变化值(高价-低价)=n(还原剂)×变价原子个数×化合价变化值(高价-低价)。
1.(2020·高考全国卷Ⅱ节选)(1)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为_________________________________________________________________________。解析:(1)由新制的HgO和Cl2反应制备Cl2O,由于该反应为歧化反应,所以只有氯元素的化合价发生变化,由0价变为+1价和-1价,所以反应的化学方程式为2Cl2+HgO===HgCl2+Cl2O。答案:(1)2Cl2+HgO===HgCl2+Cl2O
(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 ml ClO2消耗NaClO2的量为________ml;产生“气泡”的化学方程式为_____________________。
答案:(2)1.25 NaHCO3+NaHSO4===CO2↑+Na2SO4+H2O
(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是_________(用离子方程式表示)。工业上是将氯气通入30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1 000 kg该溶液需消耗氯气的质量为________kg(保留整数)。
答案:(3)ClO-+Cl-+2H+===Cl2↑+H2O 203
2.(2020·高考全国卷Ⅲ节选)某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:(1)“碱浸”中NaOH的两个作用分别是________。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式_______。
(2)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式_____________________。解析:(2)根据信息书写反应方程式,反应物为Ni2+、ClO-、OH-,产物为NiOOH、Cl-和H2O,利用得失电子守恒和电荷守恒书写反应的离子方程式:2Ni2++ClO-+4OH-===2NiOOH↓+Cl-+H2O。答案:(2)2Ni2++ClO-+4OH-===2NiOOH↓+Cl-+H2O
3.(2019·高考全国卷Ⅱ)以重晶石(BaSO4)为原料,可按如图工艺生产立德粉: 在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为_____________________________________________________。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______________。
4.(2019·高考全国卷Ⅲ)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
(1)“滤渣1”含有S和________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式:_________________________________________________________________________________________________________________________。(2)“氧化”中添加适量的MnO2的作用是________________________。
一轮复习:《第9讲 氧化还原反应的方程式的配平及有关计算》-2023届高考化学课件PPT: 这是一份一轮复习:《第9讲 氧化还原反应的方程式的配平及有关计算》-2023届高考化学课件PPT,共60页。PPT课件主要包含了题组一正向配平类,题组二逆向配平类,题组三缺项配平类,Al2O3,x+1,x-2,x-1,+3H2O,H2O,NH3·H2O等内容,欢迎下载使用。
2024年高考化学一轮总复习 第1单元 第4讲 氧化还原反应方程式的配平与有关计算 课件: 这是一份2024年高考化学一轮总复习 第1单元 第4讲 氧化还原反应方程式的配平与有关计算 课件,共60页。PPT课件主要包含了得失电子总数,原子的种类和个数,配平原则,H2O,Al2O3,O2↑,KOH,高考真题演练,AgNO3,FeCl3等内容,欢迎下载使用。
新高考化学一轮复习课件 第1章 第5讲 氧化还原反应的计算与方程式的配平: 这是一份新高考化学一轮复习课件 第1章 第5讲 氧化还原反应的计算与方程式的配平,共55页。PPT课件主要包含了高考化学一轮复习策略,电子守恒法计算,归纳整合,专项突破,真题演练明确考向,课时精练等内容,欢迎下载使用。












