

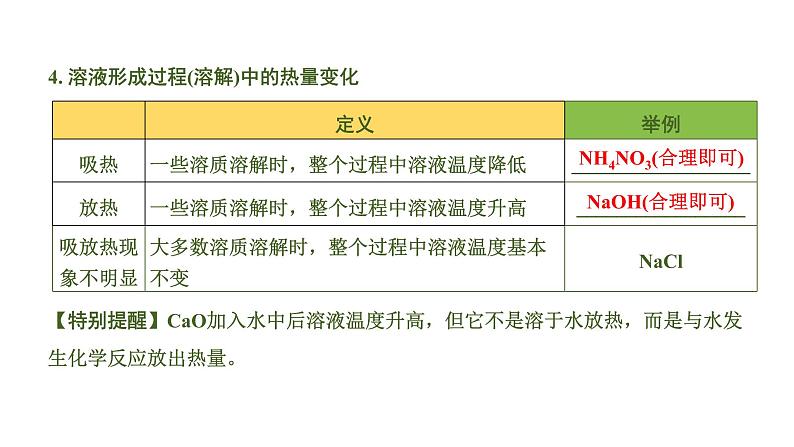



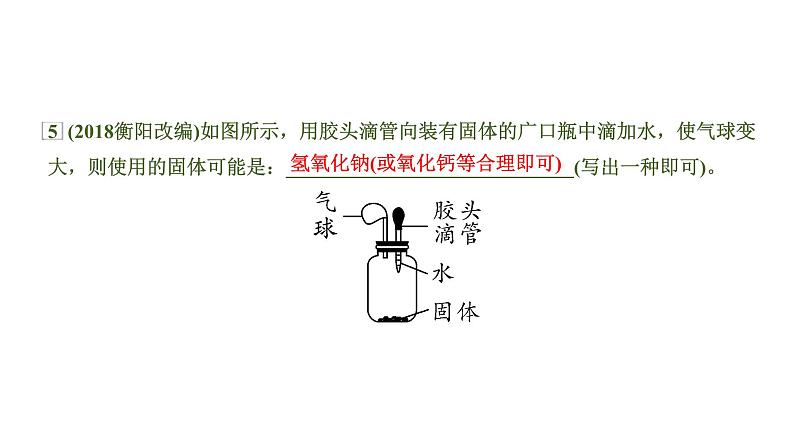


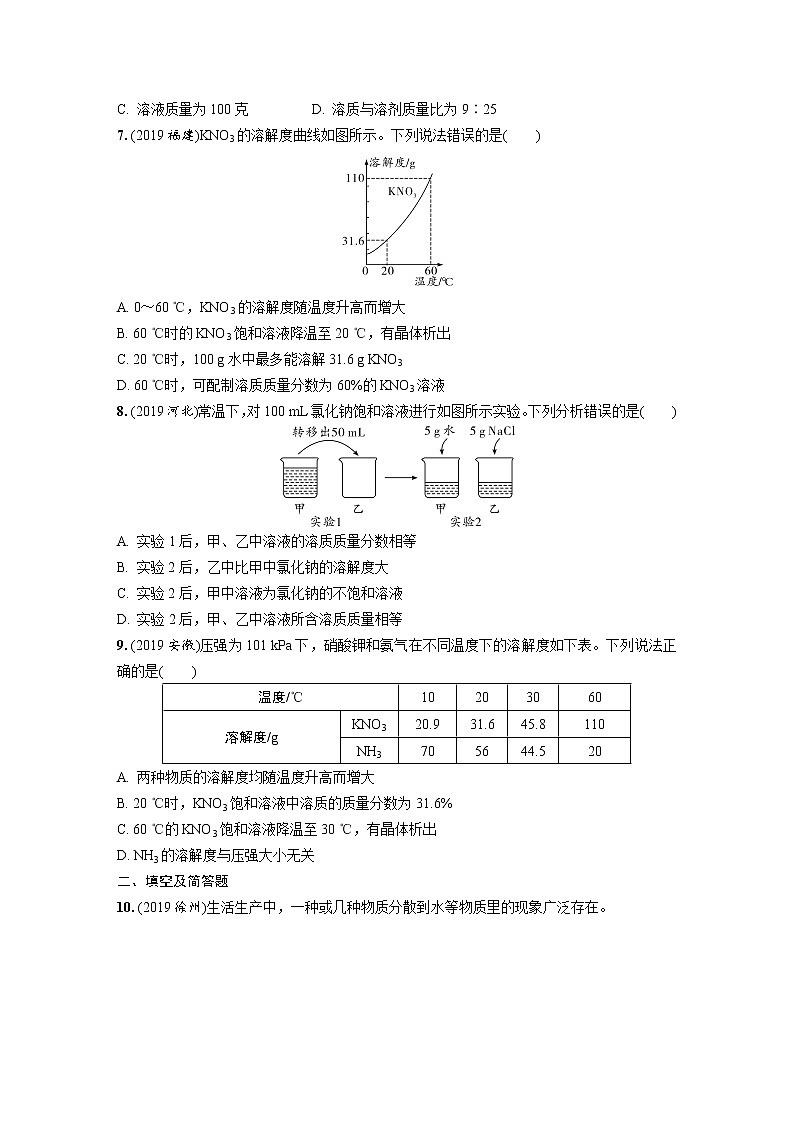
中考化学一轮复习基础考点一遍过(课件+新题练)主题4 溶 液
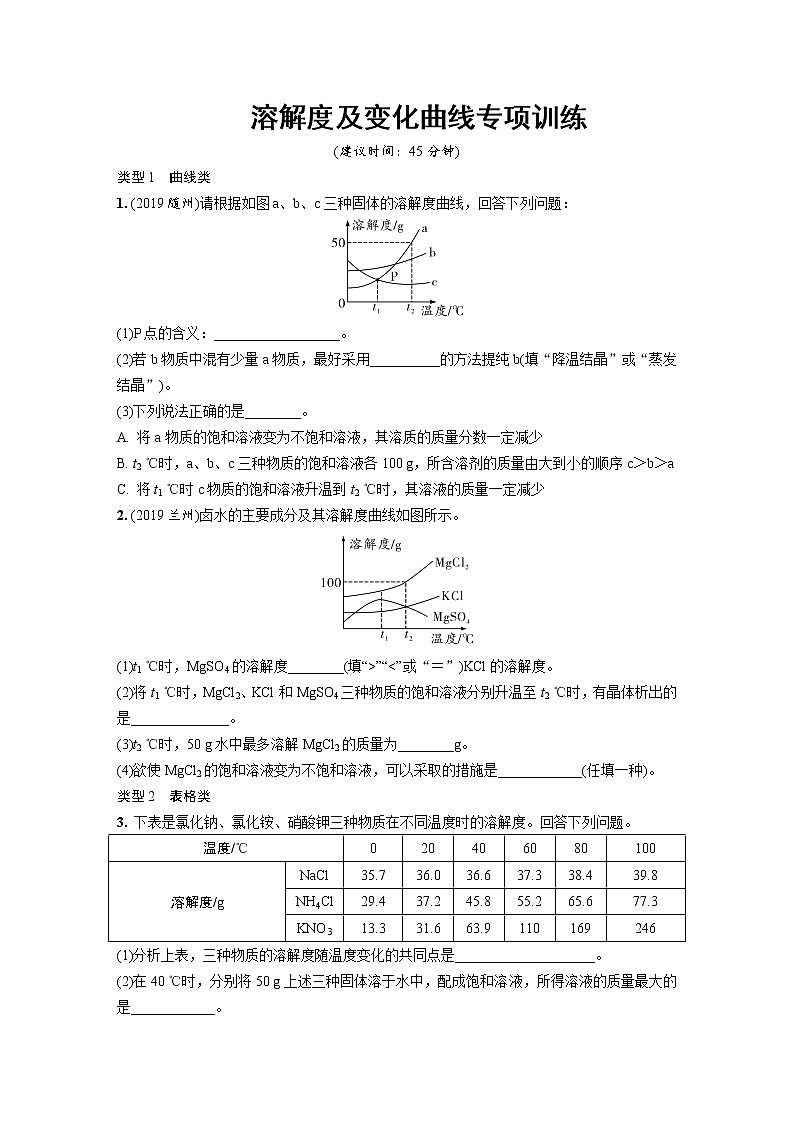
展开溶解度及变化曲线专项训练
(建议时间:45分钟)
类型1 曲线类
1. (2019随州)请根据如图a、b、c三种固体的溶解度曲线,回答下列问题:
(1)P点的含义:__________________。
(2)若b物质中混有少量a物质,最好采用__________的方法提纯b(填“降温结晶”或“蒸发结晶”)。
(3)下列说法正确的是________。
A. 将a物质的饱和溶液变为不饱和溶液,其溶质的质量分数一定减少
B. t2 ℃时,a、b、c三种物质的饱和溶液各100 g,所含溶剂的质量由大到小的顺序c>b>a
C. 将t1 ℃时c物质的饱和溶液升温到t2 ℃时,其溶液的质量一定减少
2. (2019兰州)卤水的主要成分及其溶解度曲线如图所示。
(1)t1 ℃时,MgSO4的溶解度________(填“>”“<”或“=”)KCl的溶解度。
(2)将t1 ℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液分别升温至t2 ℃时,有晶体析出的是______________。
(3)t2 ℃时,50 g水中最多溶解MgCl2的质量为________g。
(4)欲使MgCl2的饱和溶液变为不饱和溶液,可以采取的措施是____________(任填一种)。
类型2 表格类
3. 下表是氯化钠、氯化铵、硝酸钾三种物质在不同温度时的溶解度。回答下列问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(1)分析上表,三种物质的溶解度随温度变化的共同点是____________________。
(2)在40 ℃时,分别将50 g上述三种固体溶于水中,配成饱和溶液,所得溶液的质量最大的是____________。
(3)40 ℃时,在一杯100 g的水中加入36 g X(X为上述三种物质中的一种),固体全部溶解。降温至20 ℃,烧杯中有晶体析出,则X是____________。
4. (2019重庆B卷改编)我国制碱工业的先驱——侯德榜成功地摸索和改进了西方的制碱方法。下表为侯氏制碱法中部分物质的溶解度。
温度/℃ | 10 | 20 | 30 | 40 | |
溶解度/g | Na2CO3 | 12.2 | 21.8 | 39.7 | 48.8 |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | |
NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | |
(1)由上表可知,在10 ℃~40 ℃之间溶解度随温度变化最小的物质是____________(填名称)。
(2)40 ℃时,将等质量的三种表中物质的饱和溶液降温至 20 ℃,所得溶液中溶质的质量分数由大到小的顺序是________________(用化学式表示)。
(3)侯氏制碱法制得的碱为纯碱,纯碱的化学式为____________。
(4)制碱原理为向饱和的NaCl溶液中通入足量NH3和CO2生成NaHCO3晶体和NH4Cl,NaHCO3加热分解即制得纯碱。
结合上表分析,析出NaHCO3晶体的原因可能有________(填序号)。
A. 溶剂质量减少
B. 同温下NaHCO3溶解度小于NaCl
C. 生成的NaHCO3质量大于消耗的NaCl质量
类型3 实验示意图类
5. (2019高新一中二模)某物质R在20 ℃时的溶解度是34 g,50 ℃时R的溶解度是52 g。现有20 ℃时盛有150 g水的烧杯,通过如图所示的操作,分别得到相应的溶液A~E。已知:C溶液为饱和溶液。请回答下列问题:
(1)烧杯A中的溶液属于__________(填“饱和”或“不饱和”)溶液。
(2)烧杯B中的溶质和溶剂的质量比为________(写出最简整数比)。
(3)若使烧杯C溶液恰好饱和,步骤③中m的值为______。
(4)上述溶液中,溶质质量分数一定相等的是__________(填字母代号)。
6. (2019爱知中学三模)在一定温度下,向100 g水中依次加入一定质量的X固体,充分溶解,又加入一定质量的Y固体,加入固体质量与得到相应溶液质量的关系如图所示:
(1)该温度下X的溶解度是________g。
(2)上述过程中属于不饱和溶液的是______(填字母),烧杯内有固体不溶物的是______(填字母)。
(3)上述五种溶液中X质量分数最大的是______(填字母)。
(4)通过上图,能否判断X的溶解度随温度的变化________(选填“能”或“不能”)。
7. (2019陕西逆袭卷)如图是对20 ℃时一定质量的甲物质的溶液进行一系列操作的实验过程,请回答问题。
(1)烧杯①中溶液为____________(填“饱和”或“不饱和”)溶液。
(2)20 ℃时,甲物质的溶解度为________。
(3)若烧杯⑤中溶液恰好为饱和溶液,则溶液的溶质质量分数为________(结果精确到0.1%),n的值为________。
类型4 图表综合类
8. (2019本溪)水是生命之源,我们应该了解水及溶液的相关知识。
(1)生活中可用____________区分硬水和软水。
(2)净水时,利用活性炭的________性除去水中的色素和异味。
(3)下表是氯化钠和硝酸钾在不同温度的溶解度。请回答。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
①根据上表数据分析NaCl与KNO3的溶解度相等的温度在________(填字母)之间。
A. 10 ℃~20 ℃ B. 20 ℃~30 ℃ C. 30 ℃~40 ℃
②若NaCl中混有少量的KNO3,提纯NaCl的方法是____________。
③某同学取NaCl、KNO3中的一种物质,按如图所示进行实验。
该同学所取的固体物质为______,W的值为____g。
9. (2019聊城)根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题:
温度 | 0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ |
氯化钠溶解度/g | 35 | 35.5 | 36 | 36.5 | 37 |
碳酸钠溶解度/g | 6 | 10 | 18 | 36.5 | 50 |
(1)t1 ℃时,NaCl的溶解度是________g。
(2)t2 ℃时,将40 g Na2CO3固体加入50 g水中,充分溶解后所得Na2CO3溶液中溶质与溶剂的质量比为________。
(3)若Na2CO3中混有少量的NaCl,提纯Na2CO3应采取的方法是____________(填“降温结晶”或“蒸发结晶”)。
1. (1)t1 ℃时,a、c两种物质的溶解度相等 (2)蒸发结晶
(3)BC
2. (1)> (2)MgSO4(或硫酸镁) (3)50 (4)升温(或加溶剂)
3. (1)都随温度升高而增大 (2)氯化钠(或NaCl)
(3)硝酸钾(或KNO3)
4. (1)氯化钠 (2)NaCl、Na2CO3、NaHCO3
(3)Na2CO3 (4)AB
5. (1)不饱和 (2)1∶3 (3)28 (4)CD
6. (1)50 (2)BC DE (3)D (4)不能
7. (1)不饱和 (2)50 g (3)33.3% 16
8. (1)肥皂水 (2)吸附 (3)①B ②蒸发结晶
③KNO3 50
9. (1)36.5 (2)2∶5 (3)降温结晶
中考化学一轮复习基础考点一遍过(课件+新题练)主题16 常见气体的制取与收集: 这是一份中考化学一轮复习基础考点一遍过(课件+新题练)主题16 常见气体的制取与收集,文件包含16主题16常见气体的制取与收集pptx、主题16常见气体的制取与收集doc等2份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
中考化学一轮复习基础考点一遍过(课件+新题练)主题15 常见仪器及基本实验操作: 这是一份中考化学一轮复习基础考点一遍过(课件+新题练)主题15 常见仪器及基本实验操作,文件包含15主题15常见仪器及基本实验操作pptx、主题15常见仪器及基本实验操作doc等2份课件配套教学资源,其中PPT共36页, 欢迎下载使用。
中考化学一轮复习基础考点一遍过(课件+新题练)主题13 化学与能源和资源的利用: 这是一份中考化学一轮复习基础考点一遍过(课件+新题练)主题13 化学与能源和资源的利用,文件包含13主题13化学与能源和资源的利用pptx、主题13化学与能源和资源的利用doc等2份课件配套教学资源,其中PPT共20页, 欢迎下载使用。












