



化学反应的快慢和限度PPT课件免费下载2023
展开一、【课程的主要内容】
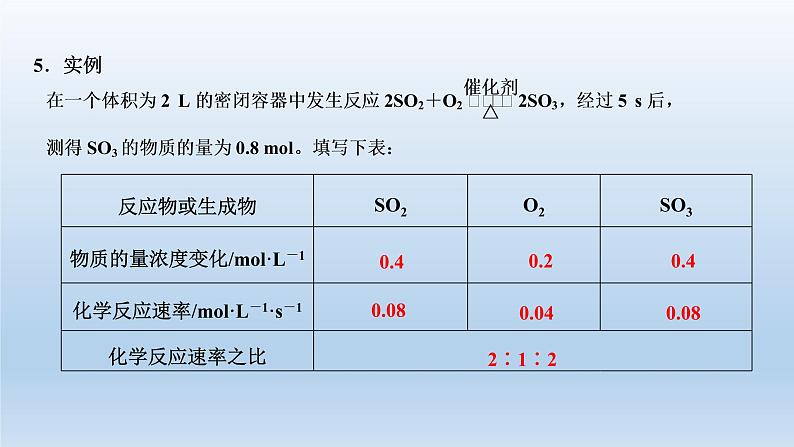
知识点一 化学反应速率
通过上图我们可以发现化学反应有快有慢,怎样表示化学反应的快慢呢?请完成下列知识点:
化学反应速率是用来描述化学反应________的物理量。
通常用单位时间某____________的减少量(绝对值)或某____________的增加量来表示。
化学反应速率的常用单位为____________、________________或ml·L-1·h-1。
ml·L-1·min-1
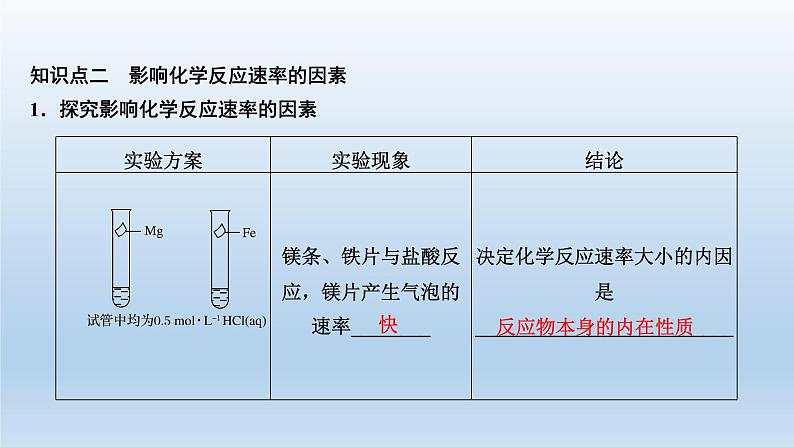
知识点二 影响化学反应速率的因素1.探究影响化学反应速率的因素
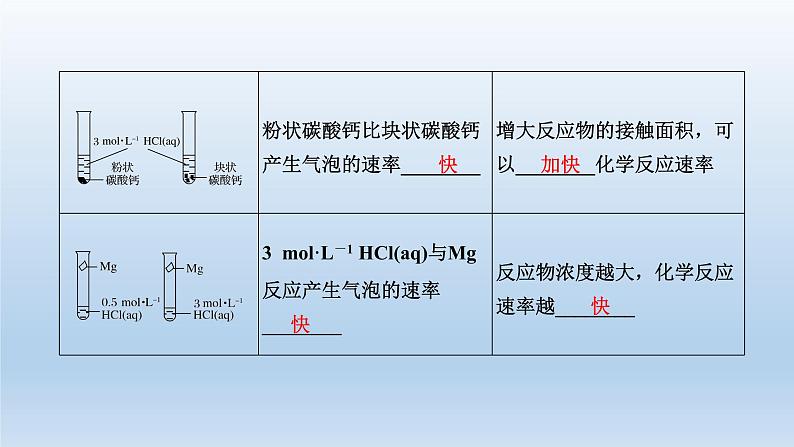
2.影响化学反应速率的因素
(1)内因不同的化学反应,具有不同的反应速率,这说明化学反应速率的大小主要取决于______________________。(2)外因
(6)一定量的锌与过量的稀硫酸反应制取氢气,为减慢反应速率而又不影响生成H2的量,可向其中加入KNO3溶液( )(7)碳酸钙与盐酸反应的过程中,再增加CaCO3固体,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率( )
微训练1.下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率B.100 mL 2 ml·L-1的盐酸与锌片反应,加入适量的氯化钠溶液,反应速率不变C.SO2的催化氧化反应是一个放热反应,所以升高温度,反应速率减小D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强时反应速率减小
解析 铁在浓硫酸中会发生钝化,A项错误;加入氯化钠溶液,盐酸的浓度减小,反应速率减小,B项错误;升高温度,反应速率增大,C项错误。
2.在某一化学反应中,反应物A的浓度在10 s内从0.8 ml·L-1变为0.2 ml·L-1,则在这10 s内A的化学反应速率为( )
A.0.02 ml·L-1B.0.02 ml·L-1·s-1C.0.06 ml·L-1·s-1D.0.06 ml·L-1·min-1
解析 10 s内A的化学反应速率为(0.8 ml·L-1-0.2 ml·L-1)÷10 s=0.06 ml·L-1·s-1。
3.在下列事实中,什么因素影响了化学反应的速率?
(1)集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸:__________________________________________________________。(2)黄铁矿煅烧时需粉碎成细小的矿粒:___________________________________。(3)KI晶体和HgCl2晶体混合后无明显现象,若一起投入水中,很快生成红色HgI2:________________________________________________________________。(4)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:_______________________________________________________________。
(5)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢:________________________________________________________________。(6)同样大小的石灰石分别在0.1 ml·L-1的盐酸和1 ml·L-1的盐酸中反应速率不同:____________________________________________________________________________________________________________________________。(7)夏天的食品易变霉,冬天就不易发生该现象:____________________。(8)葡萄糖在空气中燃烧时需要较高的温度,可是在人体内,在正常体温(37 ℃)时,就可以被氧化,这是因为:________________________________________。
解析 影响化学反应速率的因素除了浓度、温度、压强、催化剂以外,光、电磁波、超声波、反应物颗粒的大小、溶剂的性质等,也会对化学反应速率产生影响。
答案 (1)光 (2)反应物的接触面积 (3)在溶液中,水作溶剂,增大了接触面积 (4)催化剂 (5)反应物本身的性质 (6)反应物的浓度(7)反应温度 (8)人体里的生物酶起催化作用,可以降低葡萄糖氧化反应所需要的能量,所以在人体温度的范围内就可以发生反应
微思考1.请从化学反应快慢的角度解释人们为什么使用电冰箱保存食物?
提示 食物腐败是因为发生了化学反应,在其他条件相同时,温度越低,化学反应越慢,人们用电冰箱把食物放置在低温下保存,以减缓食物的腐败。
2.工业生产硫酸时,要先将黄铁矿矿石(主要成分为FeS2)粉碎后,再投入沸腾炉,为什么?
提示 将铁矿石粉碎,是为了增大与空气的接触面积,加快反应速率。
3.铁粉与一定浓度的稀盐酸反应时,增加铁粉的用量能否加快化学反应速率?
提示 不能。对于固态或纯液态物质,浓度可视为常数,改变其用量,浓度不发生改变,不影响化学反应速率。
二、【拓展学习】
学习任务1 化学反应速率的正确理解及计算方法
资料:资料一:化学反应速率就是化学反应进行的快慢程度(平均反应速率),用单位时间内反应物或生成物的物质的量浓度变化量来表示。在容积不变的反应容器中,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。如时间用s,则化学反应速率的单位是ml·L-1·s-1。
资料二:测量一个化学反应的速率,需要测定某一时间段内某物质浓度的改变量。但是,一般来说在测量时化学反应仍在进行,应用一般化学分析方法测定反应速率存在困难。一个近似的办法是使反应立即停止(如果可以),如通过稀释、降温、加入阻化剂或除去催化剂等方法可以使反应进行得非常慢,便于进行化学分析。但这样既费时费力,又不准确,可以研究的反应也有限。现在广泛使用的方法是测量物质的性质,如压力、电导率、吸光度等,通过它们与物质浓度的关系实现连续测定。
请结合上述资料完成下列讨论:1.一个化学反应的速率可以用任何一种反应物或生成物来表示吗?
提示 由于Δc表示的是物质的物质的量浓度的变化,而固态物质和纯液态物质的浓度在一定温度下是常量,所以这种表示化学反应速率的方法不适合固态物质和纯液态物质。
2.探究在同一化学反应中,用不同物质表示该反应的速率时,各数据之间有什么关系?
提示 同一化学反应,用不同物质表示的化学反应速率之比等于化学方程式中相应物质的化学计量数之比,这是有关化学反应速率的计算或换算的依据。
提示 化学反应速率实际上指的是某一段时间内化学反应的平均速率,而不是某一时刻的瞬时速率。
提示 用不同物质比较化学反应速率快慢时,要转化为同种物质表示的反应速率,然后再进行比较。根据化学反应速率之比等于化学方程式中的化学计量数之比,将②、③中的反应速率都用A表示为:②v(A)=0.15 ml/(L·s),③v(A)=0.225 ml/(L·s),故三者速率大小为③>①>②。
1.化学反应速率的正确理解
2.化学反应速率的计算方法
3.反应速率大小比较的两种方法
解析 根据化学反应速率之比等于对应物质的化学计量数之比,可得v(B)=0.5v(A)=0.5×0.12 ml·L-1·s-1=0.06 ml·L-1·s-1,则Δc(B)=0.06 ml·L-1·s-1×10 s=0.6 ml·L-1,Δn(B)=0.6 ml·L-1×2 L=1.2 ml,故10 s时容器中B的物质的量为4 ml-1.2 ml=2.8 ml。
A.1.6 mlB.2.8 mlC.2.4 mlD.1.2 ml
①v(A)=0.6 ml·L-1·min-1②v(B)=0.45 ml·L-1·min-1③v(C)=0.015 ml·L-1·min-1④v(D)=0.45 ml·L-1·min-1则此反应在不同条件下进行最快的是( )A.②③B.①③ C.②④D.②
学习任务2 (核心素养)影响化学反应速率的因素
化学反应速率影响因素的注意点1.主要因素(内因)
不同的化学反应,具有不同的反应速率,因此,参加反应的物质的性质是决定化学反应速率的主要因素。
(1)温度:当其他条件不变时,升高温度,可以增大化学反应速率;降低温度,可以减小化学反应速率。(2)催化剂:当其他条件不变时,使用适当的催化剂通常能极大地加快化学反应速率。(3)浓度:当其他条件不变时,增大反应物的浓度,可以增大化学反应速率;减小反应物的浓度,可以减小化学反应速率。(4)压强:对于有气体参加的反应,当其他条件不变时,增大气体的压强,可以增大化学反应速率;减小气体的压强,可以减小化学反应速率。
(5)固体表面积:固体颗粒越小,其单位质量的表面积越大,与其他反应物的接触面积越大,化学反应速率越大。(6)反应物状态:一般来说,配成溶液或反应物是气体,都能增大反应物之间的接触面积,有利于增大反应速率。(7)形成原电池,可以增大氧化还原反应的反应速率。
【素养解题】[典例示范] 下列各组反应(表中金属粉末均为0.1 ml),在反应刚开始时,放出H2的速率最大的是( )
三、【课堂练习】
1.下列关于影响化学反应速率的条件的说法正确的是( )
A.增大压强一定能加快化学反应速率B.使用催化剂,使反应的活化能降低,反应速率加快,但不改变反应的历程C.反应物浓度是决定化学反应速率的主要因素D.升高温度,一般能加快化学反应速率
解析 A项,压强对反应速率的影响只适用于有气体参与的反应,即改变压强,反应速率不一定改变,A项不正确。B项,催化剂能改变反应的历程,B项不正确。C项,参加反应的物质的性质是决定化学反应速率的主要因素,C项不正确。D项,升高温度,一般能加快化学反应速率,D项正确。
A.v(NH3)=0.1 ml·L-1·min-1B.v(N2)=0.02 ml·L-1·min-1C.v(H2)=0.015 ml·L-1·min-1D.v(NH3)=0.17 ml·L-1·min-1
3.把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的是( )
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度A.①④B.③④C.①③D.②③
解析 镁与盐酸反应的离子方程式为Mg+2H+===Mg2++H2↑,与H+有关,与Cl-无关。在镁与盐酸的反应中,刚开始时H+的浓度最大,反应速率应最大,但由于此反应为放热反应,温度升高,化学反应速率还会增大,随着化学反应的进行,H+浓度逐渐减小,化学反应速率又逐渐减慢。
4.某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生化学反应时,物质的量随时间变化的关系曲线如图所示:
(1)由图中的数据分析,该反应的化学方程式为____________________________________________________________________________________________。
原电池PPT课件免费下载2023: 人教版 (2019)高中化学选择性必修1课文《原电池》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。
氮的固定PPT课件免费下载2023: 苏教版 (2019)高中化学必修 第二册课文《氮的固定》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。
电离平衡PPT课件免费下载2023: 人教版 (2019)高中化学选择性必修1课文《电离平衡》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。













