





高考化学(人教)大一轮学考复习考点突破课件:第十二章 物质结构与性质(选考) 第39讲
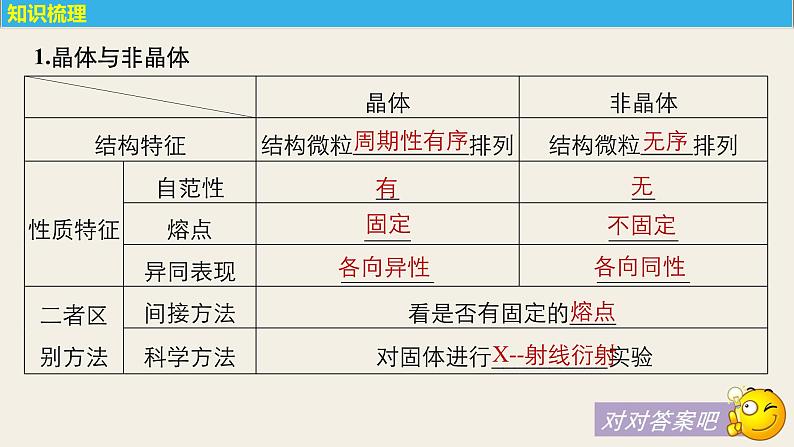
展开考纲要求1.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。2.了解晶体的类型,了解不同类型晶体中结构微粒、微粒间作用力的区别。3.了解晶格能的概念,了解晶格能对离子晶体性质的影响。4.了解分子晶体结构与性质的关系。5.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与 性质的关系。6.理解金属键的含义,能用金属键理论解释金属的一些物理性质, 了解金属晶体常见的堆积方式。7.了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。
考点一 晶体常识
考点三 突破五类晶体模型
考点二 晶体的组成和性质
考能提升 探究高考 明确考向
2.得到晶体的途径(1) 物质凝固。(2) 物质冷却不经液态直接凝固(凝华)。(3)溶质从溶液中 。3.晶胞(1)概念描述晶体结构的 。(2)晶体中晶胞的排列——无隙并置①无隙:相邻晶胞之间没有 。②并置:所有晶胞 排列、 相同。
1.正误判断,正确的打“√”,错误的打“×”(1)冰和碘晶体中相互作用力相同( )(2)晶体内部的微粒按一定规律周期性的排列( )(3)凡有规则外形的固体一定是晶体( )(4)固体SiO2一定是晶体( )(5)缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体块( )(6)晶胞是晶体中最小的“平行六面体”( )(7)区分晶体和非晶体最可靠的方法是对固体进行X-射线衍射实验( )
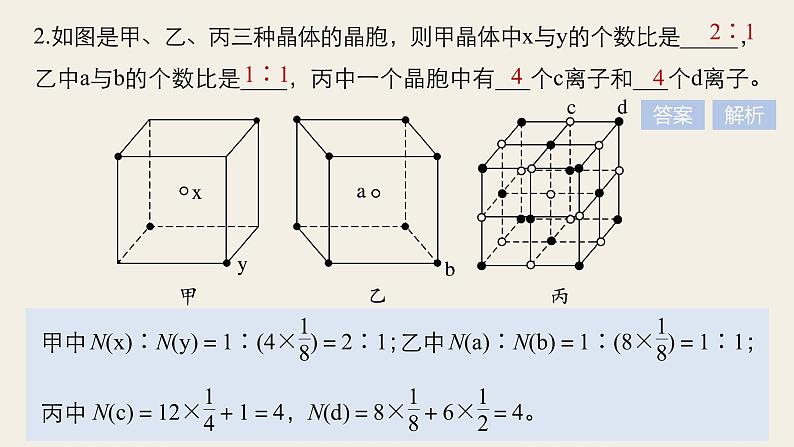
2.如图是甲、乙、丙三种晶体的晶胞,则甲晶体中x与y的个数比是_____,乙中a与b的个数比是____,丙中一个晶胞中有___个c离子和___个d离子。
3.下图为离子晶体空间构型示意图:(●阳离子,○阴离子)以M代表阳离子,以N表示阴离子,写出各离子晶体的组成表达式:
A________、B________、C________。
题组一 认识各类晶胞1.下图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价,则Q的化合价为______。
2.某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是A.3∶9∶4 B.1∶4∶2C.2∶9∶4 D.3∶8∶4
3.已知镧镍合金LaNin的晶胞结构如下图,则LaNin中n=____。
4.Cu元素与H元素可形成一种红色化合物,其晶体结构单元如下图所示。则该化合物的化学式为_____。
5.(1)硼化镁晶体在39 K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,下图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为______。
每个Mg周围有6个B,而每个B周围有3个Mg,所以其化学式为MgB2。
(2)在硼酸盐中,阴离子有链状、环状等多种结构形式。下图是一种链状结构的多硼酸根,则多硼酸根离子符号为______。
6.已知下图所示晶体的硬度很可能比金刚石大,且原子间以单键结合,试根据下图确定该晶体的化学式为_____。
题组二 晶胞的密度及微粒间距离的计算7.Cu与F形成的化合物的晶胞结构如下图所示,若晶体密度为a g·cm-3,则Cu与F最近距离为_________________pm。(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;图中○为Cu, 为F)
设晶胞的棱长为x cm,F:4,其化学式为CuF。a·x3·NA=4M(CuF),
最短距离为小立方体体对角线的一半,
8.如图为Na2S的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是ρ g·cm-3,试计算Na+与S2-的最短距离为___________ cm(阿伏加德罗常数用NA表示 ,只写出计算式)。
其个数之比为1∶2,所以●代表S2-,○代表Na+。
设晶胞边长为a cm,则a3·ρ·NA=4×78
晶胞计算的思维方法(1)晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。晶体结构的计算常常涉及如下数据:晶体密度、NA、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解决这类题,一是要掌握晶体“均摊法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
特别提醒 ①在使用均摊法计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞所共有。②在计算晶胞中粒子个数的过程中,不是任何晶胞都可用均摊法。(3)晶体微粒与M、ρ之间的关系若1个晶胞中含有x个微粒,则1 ml晶胞中含有x ml 微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3 g(a3为晶胞的体积,ρ为晶胞的密度),则1 ml晶胞的质量为ρa3NA g,因此有xM=ρa3NA。
2.离子晶体的晶格能(1)定义气态离子形成1 ml离子晶体释放的能量,通常取正值,单位: 。(2)影响因素①离子所带电荷数:离子所带电荷数越多,晶格能越 。②离子的半径:离子的半径越 ,晶格能越大。(3)与离子晶体性质的关系 晶格能越大,形成的离子晶体越 ,且熔点越高,硬度越 。
1.正误判断,正确的打“√”,错误的打“×”(1)在晶体中只要有阴离子就一定有阳离子( )(2)在晶体中只要有阳离子就一定有阴离子( )(3)原子晶体的熔点一定比金属晶体的高( )(4)分子晶体的熔点一定比金属晶体的低( )(5)离子晶体一定都含有金属元素( )(6)金属元素和非金属元素组成的晶体不一定是离子晶体( )(7)原子晶体的熔点一定比离子晶体的高( )(8)金属晶体的熔点不一定比分子晶体的高( )
2.在下列物质中:NaCl、NaOH、Na2S、H2O2、Na2S2、(NH4)2S、CO2、CCl4、C2H2、SiO2、SiC、晶体硅、金刚石,晶体氩。(1)其中只含有离子键的离子晶体是___________。(2)其中既含有离子键又含有极性共价键的离子晶体是______________。(3)其中既含有离子键又含有极性共价键和配位键的离子晶体是________。(4)其中既含有离子键又含有非极性共价键的离子晶体是______。(5)其中含有极性共价键的非极性分子是________________。(6)其中含有极性共价键和非极性共价键的非极性分子是_____。(7)其中含有极性共价键和非极性共价键的极性分子是_____。
NaOH、(NH4)2S
CO2、CCl4、C2H2
(8)其中含有极性共价键的原子晶体是__________。(9)不含共价键的分子晶体是_______,只含非极性键的原子晶体是______________。
1.分析下列物质的物理性质,判断其晶体类型。(1)碳化铝,黄色晶体,熔点2 200 ℃,熔融态不导电:________。(2)溴化铝,无色晶体,熔点98 ℃,熔融态不导电:_________。(3)五氟化矾,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮等:_______。(4)溴化钾,无色晶体,熔融时或溶于水中都能导电:________。(5)SiI4:熔点120.5 ℃,沸点287.4 ℃,易水解:________。(6)硼:熔点2 300 ℃,沸点2 550 ℃,硬度大:________。(7)硒:熔点217 ℃,沸点685 ℃,溶于氯仿:________。(8)锑:熔点630.74 ℃,沸点1 750 ℃,导电:________。
题组一 晶体类型的判断
晶体的熔点高低、熔融态能否导电及溶解性等性质相结合是判断晶体类型的重要依据。原子晶体和离子晶体的熔点都很高或较高,两者最大的差异是熔融态的导电性不同。原子晶体熔融态不导电,离子晶体熔融时或其水溶液都能导电。原子晶体和分子晶体的区别则主要在于熔、沸点有很大差异。一般原子晶体和分子晶体熔融态时都不能导电。另外易溶于一些有机溶剂往往也是分子晶体的特征之一。金属晶体能导电。
2.现有几组物质的熔点(℃)数据:
据此回答下列问题:(1)A组属于_____晶体,其熔化时克服的微粒间的作用力是_______。
A组熔点很高,为原子晶体,是由原子通过共价键形成的。
(2)B组晶体共同的物理性质是_________(填序号)。①有金属光泽 ②导电性 ③导热性 ④延展性
B组为金属晶体,具有①②③④四条共性。
(3)C组中HF熔点反常是由于_______________________________________________________________________________。
HF中含有分子间氢键,故其熔点反常。
HF分子间能形成氢键,其熔化时需要消耗的能量更多(只要答出HF分子间能形成氢键即可)
(4)D组晶体可能具有的性质是_____(填序号)。①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
D组属于离子晶体,具有②④两条性质。
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为__________________________________________________________________________________________________________________。
D组属于离子晶体,其熔点与晶格能有关。
D组晶体都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高
晶体类型的5种判断方法(1)依据构成晶体的微粒和微粒间的作用判断①离子晶体的构成微粒是阴、阳离子,微粒间的作用是离子键。②原子晶体的构成微粒是原子,微粒间的作用是共价键。③分子晶体的构成微粒是分子,微粒间的作用为分子间作用力。④金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用是金属键。
(2)依据物质的分类判断①金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。②大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。③常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合类原子晶体有碳化硅、二氧化硅等。④金属单质是金属晶体。
(3)依据晶体的熔点判断①离子晶体的熔点较高。②原子晶体的熔点很高。③分子晶体的熔点低。④金属晶体多数熔点高,但也有少数熔点相当低。
(4)依据导电性判断①离子晶体溶于水及熔融状态时能导电。②原子晶体一般为非导体。③分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。④金属晶体是电的良导体。
(5)依据硬度和机械性能判断①离子晶体硬度较大、硬而脆。②原子晶体硬度大。③分子晶体硬度小且较脆。④金属晶体多数硬度大,但也有较低的,且具有延展性。
注意 (1)常温下为气态或液态的物质,其晶体应属于分子晶体(Hg除外)。(2)石墨属于混合型晶体,但因层内原子之间碳碳共价键的键长为1.42×10-10 m,比金刚石中碳碳共价键的键长(键长为1.54×10-10 m)短,所以熔、沸点高于金刚石。(3)AlCl3晶体中虽含有金属元素,但属于分子晶体,熔、沸点低(熔点190 ℃)。(4)合金的硬度比其成分金属大,熔、沸点比其成分金属低。
题组二 晶体熔、沸点的比较3.下列分子晶体中,关于熔、沸点高低的叙述中,正确的是A.Cl2>I2B.SiCl4<CCl4C.NH3>PH3D.C(CH3)4>CH3CH2CH2CH2CH3
A、B项属于无氢键存在的分子结构相似的情况,相对分子质量大的熔、沸点高;C项属于分子结构相似的情况,但存在氢键的熔、沸点高;D项属于相对分子质量相同,但分子结构不同的情况,支链少的熔、沸点高。
4.离子晶体熔点的高低取决于晶体中晶格能的大小。判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是A.KCl>NaCl>BaO>CaOB.NaCl>KCl>CaO>BaOC.CaO>BaO>NaCl>KClD.CaO>BaO>KCl>NaCl
离子晶体中,晶格能越大,晶体熔、沸点越高;离子所带电荷总数越多,半径越小,晶格能越大。
5.下列各组物质中,按熔点由低到高的顺序排列正确的是①O2、I2、Hg ②CO、KCl、SiO2 ③Na、K、Rb④Na、Mg、AlA.①③ B.①④C.②③ D.②④
①中Hg在常温下为液态,而I2为固态,故①错;②中SiO2为原子晶体,其熔点最高,CO是分子晶体,其熔点最低,故②正确;③中Na、K、Rb价电子数相同,其原子半径依次增大,金属键依次减弱,熔点逐渐降低,故③错;④中Na、Mg、Al价电子数依次增多,原子半径逐渐减小,金属键依次增强,熔点逐渐升高,故④正确。
分类比较晶体的熔、沸点(1)不同类型晶体的熔、沸点高低的一般规律原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,如汞、镓、铯等熔、沸点很低,金属晶体一般不参与比较。(2)原子晶体由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。如熔点:金刚石>石英>碳化硅>硅。
(3)离子晶体一般地说,阴、阳离子所带电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔、沸点就越高,如熔点:MgO>MgCl2>NaCl>CsCl。(4)分子晶体①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体,熔、沸点反常的高。如H2O>H2Te>H2Se>H2S。②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4,F2<Cl2<Br2<I2。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2,CH3OH>CH3CH3。④同分异构体,支链越多,熔、沸点越低。如:CH3—CH2—CH2—CH2—CH3> 。
1.原子晶体(金刚石和二氧化硅)
(1)金刚石晶体中,每个C与另外 个C形成共价键,C—C 键之间的夹角是109°28′,最小的环是 元环。含有1 ml C的金刚石中,形成的共价键有 ml。(2)SiO2晶体中,每个Si原子与 个O成键,每个O原子与 个硅原子成键,最小的环是 元环,在“硅氧”四面体中,处于中心的是 原子,1 ml SiO2中含有 ml Si—O键。
2.分子晶体(1)干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有 个。
(2)冰的结构模型中,每个水分子与相邻的 个水分子以氢键相连接,含1 ml H2O的冰中,最多可形成 ml“氢键”。
(1)NaCl型:在晶体中,每个Na+同时吸引 个Cl-,每个Cl-同时吸引 个Na+,配位数为 。每个晶胞含 个Na+和 个Cl-。(2)CsCl型:在晶体中,每个Cl-吸引 个Cs+,每个Cs+吸引 个Cl-,配位数为 。
石墨层状晶体中,层与层之间的作用是 ,平均每个正六边形拥有的碳原子个数是 ,C原子采取的杂化方式是 。
5.常见金属晶体的原子堆积模型
特别提醒 (1)判断某种微粒周围等距且紧邻的微粒数目时,要注意运用三维想象法。如NaCl晶体中,Na+周围的Na+数目(Na+用“○”表示):
每个面上有4个,共计12个。(2)常考的几种晶体主要有干冰、冰、金刚石、SiO2、石墨、CsCl、NaCl、K、Cu等,要熟悉以上代表物的空间结构。当题中信息给出与某种晶体空间结构相同时,可以直接套用某种结构。
1.正误判断,正确的打“√”,错误的打“×”(1)在金属钠形成的晶体中,每个钠原子周围与其距离最近的钠原子有8个( )(2)在NaCl晶体中,每个Na+周围与其距离最近的Na+有12个( )(3)在CsCl晶体中,每个Cs+周围与其距离最近的Cl-有8个( )(4)金属镁形成的晶体中,每个镁原子周围与其最近的镁原子有6个( )
2.在晶体模型中,金刚石中的“棍”和干冰中的“棍”表示的意义一样吗?分子晶体中有化学键吗?
不一样,金刚石中表示的是C—C共价键,而干冰中的“棍”表示分子间作用力;分子晶体中多数含有化学键(如CO2中的C==O键),少数则无(如稀有气体形成的晶体)。
3.下列排列方式中:A.ABCABCABC D.ABCCBAABCCBA,属于镁型堆积方式的是____;属于铜型堆积方式的是____。
题组一 强化记忆晶体结构1.判断下列物质的晶胞结构,将对应序号填在线上。
(1)干冰晶体 ;(2)氯化钠晶体 ;(3)金刚石 ;(4)碘晶体 ;(5)氟化钙 ;(6)钠 ;(7)冰晶体 ;(8)水合铜离子 ;(9)H3BO3晶体 ;(10)铜晶体 。
2.碳的第三种同素异形体——金刚石,其晶胞如图丁所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图________(从A~D图中选填)。
题组二 晶胞中原子半径及空间利用率的计算3.用晶体的X-射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如下图),已知该晶体的密度为9.00 g·cm-3,晶胞中该原子的配位数为___;Cu的原子半径为__________________________________cm(阿伏加德罗常数为NA,要求列式计算)。
设晶胞的边长为a cm,则a3·ρ·NA=4×64
4.[2016·全国卷Ⅲ,37(5)]GaAs的熔点为1 238 ℃,密度为ρ g·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以_____键键合。Ga和As的摩尔质量分别为MGa g·ml-1和MAs g·ml-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________________。
GaAs的熔点很高,则其晶体类型为原子晶体,Ga和As以共价键键合。由晶胞结构可知一个晶胞中含有As、Ga原子的个数均为4个,则晶胞的体积为 ×4÷ρ,又知二者的原子半径分别为rGa pm和rAs pm,
则GaAs晶胞中原子的体积占晶胞体积的百分率为
晶体结构的相关计算(1)晶胞质量=晶胞占有的微粒的质量=晶胞占有的微粒数× 。
(3)金属晶体中体心立方堆积、面心立方堆积中的几组公式(设棱长为a,原子半径为r)①面对角线长= a。②体对角线长= a。③体心立方堆积4r= a④面心立方堆积4r= a。
1.[2016·全国卷Ⅰ,37(6)]晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0, );C为( , ,0)。则D原子的坐标参数为_________。
由Ge单晶晶胞结构示意图,可知D原子与A原子及位于3个相邻面面心的3个原子构成了正四面体结构,D原子位于正四面体的中心,再根据A、B、C三个原子的坐标参数可知D原子的坐标参数为 。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为__________________g·cm-3(列出计算式即可)。
由锗单晶的晶胞结构示意图,可知该晶胞中位于顶点的有8个原子,位于面心的有6个原子,位于内部的有4个原子,则一个晶胞中所含有的锗原子个数为8× +6× +4=8,再由晶胞参数可知该晶胞的边长为565.76 pm的正方体,则其密度为 g·cm-3。
2.[2016·全国卷Ⅱ,37(4)]某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为d g·cm-3,晶胞参数a=___________nm。
根据上述分析,该晶胞的组成为Cu3Ni,若合金的密度为d g·cm-3,根据ρ= ,则晶胞参数a= ×107 nm。
3.[2016·全国卷Ⅲ,37(4)]GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是________________________________。
GaF3为离子晶体,GaCl3为分子晶体
4.(2016·四川理综,8)M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:(1)R基态原子的电子排布式是____________________,X和Y中电负性较大的是___(填元素符号)。
1s22s22p63s1(或[Ne]3s1)
M基态原子的核外电子排布式为1s22s22p4,为氧元素,R为钠元素,X的原子序数大于R,为硫元素,则Y为氯元素,Z基态原子的核外电子排布式为[Ar]3d54s1,为24号元素铬。11号元素钠的基态原子的电子排布式为1s22s22p63s1。同一周期元素,随原子序数递增,电负性增大,Cl的电负性强于S。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是_______________________________________。
H2S分子间不存在氢键,H2O分子间存在氢键,所以H2O的沸点高于H2S。
H2S分子间不存在氢键,H2O分子间存在氢键
(3)X与M形成的XM3分子的空间构型是__________。
SO3的价层电子对数为3,无孤电子对,为平面三角形。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是____(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是_________________________________________________________。
+6价铬中K2Cr2O7 呈橙色,将H2O2氧化为O2,自身被还原为Cr2(SO4)3,注意溶液呈酸性,配平。
3H2O2+K2Cr2O7+4H2SO4 ==3O2↑+K2SO4+Cr2(SO4)3+7H2O
5.(2016·海南,19-Ⅱ)M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:(1)单质M的晶体类型为________,晶体中原子间通过______作用形成面心立方密堆积,其中M原子的配位数为___。
(2)元素Y基态原子的核外电子排布式为_____________,其同周期元素中,第一电离能最大的是___(写元素符号)。元素Y的含氧酸中,酸性最强的是______(写化学式),该酸根离子的立体构型为________。
1s22s22p63s23p5
(3)M与Y形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为_____,已知晶胞参数a=0.542 nm,此晶体的密度为______________________________g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)②该化合物难溶于水但易溶于氨水,其原因是____________________________________________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为___________。
[Cu(NH3)4]2+
Cu+可与氨形成易溶于水
的配位化合物(或配离子)
6.[2015·全国卷Ⅰ,37(4)(5)]碳及其化合物广泛存在于自然界中,回答下列问题:(4)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为376 K,其固体属于_____晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接__个六元环,每个六元环占有___个C原子。②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接___个六元环,六元环中最多有___个C原子在同一平面。
7.[2015·海南,19—Ⅱ(2)(3)(4)](2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为___、__。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__对,分子的立体构型为____;SO3气态为单分子,该分子中S原子的杂化轨道类型为_______;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为_______;该结构中S—O键长有两类,一类键长约140 pm,另一类键长约160 pm,较短的键为__(填图2中字母),该分子中含有___个σ键。
SO2分子中S原子价电子排布式为3s23p4,价层电子对数是3对,分子的立体构型为V形;SO3气态为单分子,该分子中S原子的杂化轨道类型为sp2杂化;根据题中SO3的三聚体环状结构图,可知该结构中S原子形成了四个共价键,则杂化轨道类型为sp3杂化;该结构中S—O键长有两类,一类键长约140 pm,另一类键长约160 pm,a键除了σ键外还有π键的成分,b键为σ键,故较短的键为a,由图可知该分子中含有12个σ键。
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为__________;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______。
8.[2014·新课标全国卷Ⅰ,37(3)(4)节选](3)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___个铜原子。(4)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为___。列式表示Al单质的密度_______________________g·cm-3(不必计算出结果)。
9.[2014·新课标全国卷Ⅱ,37(4)(5)]周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的 3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为____。
e为Cu,c为O,由图1可知,晶胞中含Cu原子数为4个,含O原子为8×+1=2个,故化学式为Cu2O,O为-2价,则Cu为+1价。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。 该化合物中,阴离子为_____,阳离子中存在的化学键类型有______________;该化合物加热时首先失去的组分是_____,判断理由是__________________________________。
H2O与Cu2+的配位键比NH3与Cu2+的弱
含有H、N、O、S、Cu 5种元素的化合物,结合课本选修3配合物有关知识和题目所给信息,观察中心为1个Cu2+,周围为4个NH3分子和2个H2O分子,得到该化合物化学式为[Cu(NH3)4]SO4·2H2O,加热时,由于H2O和Cu2+作用力较弱会先失去。
10.[2013·新课标全国卷Ⅰ,37(3)(6)](3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以_______相结合,其晶胞中共有8个原子,其中在面心位置贡献__个原子。
金刚石晶胞的面心上各有一个原子,面上的原子对晶胞的贡献是 。
(6)在硅酸盐中, 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根:其中Si原子的杂化形式为________,Si与O的原子数之比为_____,化学式为________________。
在多硅酸根中每个硅原子都与4个O形成4个Si—O单键,因而Si原子都是sp3杂化;观察图(b)可知,每个四面体通过两个氧原子与其他四面体连接形成链状结构,因而每个四面体中硅原子数是1,氧原子数=2+2× =3,即Si与O的原子个数比为1∶3,化学式为 。
11.(2015·全国卷Ⅱ,37)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型,C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:(1)四种元素中电负性最大的是___(填元素符号),其中C原子的核外电子排布式为__________________________。
1s22s22p63s23p3(或[Ne] 3s23p3)
由C元素原子核外电子总数是最外层电子数的3倍可知,C是磷元素;由A2-和B+具有相同的电子构型,且A、B原子序数小于15可知,A是氧元素,B是钠元素;A、B、C、D四种元素的原子序数依次增大,C、D为同周期元素,且D元素最外层有一个未成对电子,因此D是氯元素。元素的非金属性O>Cl>P,则电负性O>Cl>P,Na是金属元素,其电负性最小;P的电子数是15,根据构造原理可写出其核外电子排布式。
(2)单质A有两种同素异形体,其中沸点高的是____(填分子式),原因是_________________________________;A和B的氢化物所属的晶体类型分别为________和_________。
O3相对分子质量较大,范德华力较大
氧元素有O2和O3两种同素异形体,相对分子质量O3>O2,范德华力O3>O2,则沸点O3>O2。A和B的氢化物分别是H2O和NaH,所属晶体类型分别为分子晶体和离子晶体。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为_________,中心原子的杂化轨道类型为_______。
PCl3分子中P含有一对孤电子对,其价层电子对数为4,因此其立体构型为三角锥形,中心原子P的杂化轨道类型为sp3杂化。
(4)化合物D2A的立体构型为____,中心原子的价层电子对数为__,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_______________________________________________________________________________。
Cl2O分子的中心原子O原子含有2对孤电子对,其价层电子对数为4,因此其立体构型为V形;根据电子守恒和质量守恒可写出Cl2与湿润的Na2CO3反应的化学方程式。
2Cl2+2Na2CO3+ H2O ==Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3===Cl2O+CO2+2NaCl)
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为_____;晶胞中A原子的配位数为__;列式计算晶体F的密度(g·cm-3 )_____________________________________________。
根据化合物F的晶胞结构,利用均摊法可计算出氧原子个数:N(O)=8× +6× =4,钠原子全部在晶胞内,N(Na)=8,因此F的化学式为Na2O;以顶角氧原子为中心,与氧原子距离最近且等距离的钠原子有8个,即晶胞中A 原子的配位数为8;晶胞参数即晶胞的棱长a=0.566 nm,晶体F的密度ρ = = ≈2.27 g·cm-3。
1.(2016·太原模拟)分子晶体中如果只有范德华力,它的晶体一般采取密堆积结构,原因是分子晶体中A.范德华力无方向性和饱和性B.占据晶格结点的粒子是原子C.化学键是共价键D.三者都是
由于范德华力没有方向性和饱和性,所以分子在堆积成晶体时如果只有范德华力将采取分子密堆积,因此A选项正确;分子晶体的晶格结点是分子而非原子,所以B选项不对;分子晶体的堆积受分子间作用力的影响,与分子内的共价键无关,因此C选项是错误的。
2.下列物质的熔、沸点高低顺序中,正确的是A.金刚石>晶体硅>二氧化硅>碳化硅>H2O>O2>Br2D.金刚石>生铁>纯铁>钠
A项,同属于原子晶体,熔、沸点高低主要看共价键的强弱,显然对键能而言,晶体硅<碳化硅<二氧化硅,错误;B项,形成分子间氢键的物质的熔、沸点要大于形成分子内氢键的物质的熔、沸点,正确;C选项,对于不同类型晶体,其熔、沸点高低一般为原子晶体>离子晶体>分子晶体,MgO>H2O>Br2>O2,错误;D项,生铁为铁合金,熔点要低于纯铁,错误。
3.下图为碘晶体晶胞结构。有关说法中正确的是A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交 替配位形成层结构B.用均摊法可知平均每个晶胞中有4个碘原子C.碘晶体为无限延伸的空间结构,是原子晶体D.碘晶体中的碘原子间存在非极性键和范德华力
在立方体的顶面上,有5个I2,4个方向相同,结合其他面考虑可知A选项正确;每个晶胞中有4个碘分子,B选项错误;C项,此晶体是分子晶体,错误;D项,碘原子间只存在非极性共价键,范德华力存在于分子与分子之间,错误。
4.下列晶体分类中正确的一组是
A项中固态Ar为分子晶体;B项中H2SO4为分子晶体、石墨是混合型晶体;D项中玻璃是非晶体。
5.下列数据是对应物质的熔点(℃):
据此做出的下列判断中错误的是A.铝的化合物的晶体中有的是离子晶体B.表中只有BCl3和干冰是分子晶体C.同族元素的氧化物可形成不同类型的晶体D.不同族元素的氧化物可形成相同类型的晶体
A项,氧化铝的熔点高,属于离子晶体,则铝的化合物的晶体中有的是离子晶体,正确;B项,表中只有BCl3、AlCl3和干冰是分子晶体,错误;C项,同族元素的氧化物可形成不同类型的晶体,例如CO2是分子晶体,二氧化硅是原子晶体,正确。
6.北京大学和中国科学院的化学工作者成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构的分析中正确的是A.K3C60晶体中既有离子键又有极性键B.K3C60晶体的熔点比C60晶体的熔点低C.该晶体熔化时能导电D.C60分子中碳原子是采用sp3杂化的
该晶体为离子晶体,故熔化时能导电,C项正确;C60内部为非极性键,A项错误;离子晶体K3C60比分子晶体C60的熔点高,B项错误;C60中每个碳形成四条键,其中有一个为双键,故应为sp2杂化,D项错误。
7.下列说法不正确的是A.离子晶体的晶格能越大,离子键越强B.阳离子的半径越大则可同时吸引的阴离子越多C.通常阴、阳离子的半径越小、电荷越多,该阴阳离子组成的离子化合 物的晶格能越大D.拆开1 ml离子键所需的能量叫该离子晶体的晶格能
A项,在离子晶体中,离子之间的离子键越强,断裂消耗的能量就越高,离子的晶格能就越大,正确;B项,在离子晶体中,阳离子的半径越大则周围的空间就越大,所以就可同时吸引更多的阴离子,正确;C项,通常情况下,阴、阳离子的半径越小、电荷越多,则离子之间的作用力就越强,该阴、阳离子组成的离子化合物的晶格能越大,正确;D项,气态离子形成1 ml的离子晶体时所释放的能量叫该离子晶体的晶格能,错误。
8.下列关于晶体的说法正确的组合是①分子晶体中都存在共价键②在晶体中只要有阳离子就一定有阴离子③金刚石、SiC、、H2O、H2S晶体的熔点依次降低④离子化合物中只有离子键没有共价键,分子晶体中肯定没有离子键⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合⑦晶体中分子间作用力越大,分子越稳定⑧氯化钠溶于水时离子键被破坏A.①②③⑥ B.①②④C.③⑤⑦ D.③⑤⑧
9.有一种蓝色晶体[可表示为MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示。下列说法不正确的是A.该晶体的化学式为MFe2(CN)6B.该晶体属于离子晶体,M呈+1价C.该晶体属于离子晶体,M呈+2价D.晶体中与每个Fe3+距离最近且等距离的CN- 为6个
由图可推出晶体中阴离子的最小结构单元中含Fe2+个数: ,同样可推出含Fe3+个数也为 ,CN-为12× =3,因此阴离子为[Fe2(CN)6]-,则该晶体的化学式只能为MFe2(CN)6,由阴、阳离子形成的晶体为离子晶体,M的化合价为+1价,故A、B两项正确。由图可看出与每个Fe3+距离最近且等距离的CN-为6个。
10.晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如下图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m g NaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为V mL。回答下列问题:
(1)步骤①中A仪器最好用_______(填仪器名称)。(2)能否用胶头滴管代替步骤②中的滴定管___,其原因是____________________。(3)能否用水代替苯___,其原因是______________。(4)经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为a cm,则利用上述方法测得的阿伏加德罗常数的表达式为NA=____________。
11.Ⅰ.(1)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为_____;该晶体中原子之间的作用力是______。
(2)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(见下图)的结构相似,该晶体储氢后的化学式应为________。
根据CaF2结构图可以知道,氢原子在晶胞内(白球),数目是8个,储氢后的化学式为H8AuCu3。
Ⅱ.(1)立方BP(磷化硼)的晶胞结构如图1所示,晶胞中含B原子数目为___。
(2)科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示。该化合物中的K原子和C60分子的个数比为_____。
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为___,δ、α两种晶胞中铁原子的配位数之比为_____。
利用均摊法计算得γ晶体晶胞中所含有的铁原子数为8× +6× =4;根据晶胞的结构可知,δ晶胞中以顶点铁原子为例,与之距离最近的铁原子是体心上的铁原子,这样的原子有8个,所以铁原子的配位数为8,α晶胞中以顶点铁原子为例,与之距离最近的铁原子是与之相连的顶点上的铁原子,这样的原子有6个,所以铁原子的配位数为6,所以δ、α两种晶胞中铁原子的配位数之比为4∶3。
12.(1)钠、钾、铬、钼、钨等金属晶体的晶胞属于体心立方,则该晶胞中属于1个体心立方晶胞的金属原子数目是__。氯化铯晶体的晶胞如图1,则Cs+位于该晶胞的____,而Cl-位于该晶胞的____,Cs+的配位数是__。
(2)铜的氢化物的晶体结构如图2所示,写出此氢化物在氯气中燃烧的化学方程式:______________________________。
(3)图3为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“○”表示的离子是___(填离子符号)。
由晶胞结构可知,黑球有1个,灰球有1个,白球有3个,由电荷守恒可知n(Mg2+)∶n(K+)∶n(F-)=1∶1∶3,故白球为F-。
(4)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图4所示),已知3种离子晶体的晶格能数据如下表:
则这4种离子晶体(不包括NaCl)熔点从高到低的顺序是___________________。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有___个。
TiN>MgO>CaO>KCl
从3种离子晶体的晶格能数据知道,离子所带电荷越大、离子半径越小,离子晶体的晶格能越大,离子所带电荷数:Ti3+>Mg2+,离子半径:Mg2+<Ca2+,所以熔点:TiN>MgO>CaO>KCl;MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个。
13.下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为___,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为___。
CaF2晶体中Ca2+的配位数为8,F-的配位数为4,Ca2+和F-个数比为1∶2,铜晶体中未标号的铜原子周围最紧邻的铜原子为上层1、2、3,同层的4、5、6、7、8、9,下层的10、11、12,共12个。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是___,H3BO3晶体中B原子个数与极性键个数比为_____。
H3BO3中B原子,最外层共6个电子,H是2电子结构,只有氧原子形成二个键达到8电子稳定结构。H3BO3晶体是分子晶体,相互之间通过氢键相连,每个B原子形成3个B—O极性键,每个O原子形成3个O—H共价键,共6个键。
(3)三种晶体中熔点最低的是______,其晶体受热熔化时,克服的微粒之间的相互作用为___________________。
H3BO3晶体是分子晶体,熔点最低,熔化时克服了分子间作用力和氢键。
高考化学(人教)大一轮学考复习考点突破课件:第十一章 有机化学基础(选考) 第36讲: 这是一份高考化学(人教)大一轮学考复习考点突破课件:第十一章 有机化学基础(选考) 第36讲,共60页。PPT课件主要包含了课时作业,糖类1分类,互为同分异构体,不是同分异构体,n值不同,3蛋白质的性质,能水解的有机物小结,+n-1H2O,聚合度,+2n-1H2O等内容,欢迎下载使用。
高考化学(人教)大一轮学考复习考点突破课件:第十一章 有机化学基础(选考) 第35讲: 这是一份高考化学(人教)大一轮学考复习考点突破课件:第十一章 有机化学基础(选考) 第35讲,共60页。PPT课件主要包含了羧酸酯,课时作业,苯环侧链,3醇的分类,CH3CH2OH,粉红色,现有以下物质,烃基或氢原子,刺激性气味,易溶于水等内容,欢迎下载使用。
高考化学(人教)大一轮学考复习考点突破课件:第十一章 有机化学基础(选考) 第33讲: 这是一份高考化学(人教)大一轮学考复习考点突破课件:第十一章 有机化学基础(选考) 第33讲,PPT课件主要包含了课时作业,有机化合物,链状化合物,环状化合物,脂环化合物,芳香化合物,链状烃脂肪烃,芳香烃,稠环芳香烃,苯的同系物等内容,欢迎下载使用。












