




高考化学专题复习 氮及其化合物专题训练课件
展开高频考点一 氮及其氧化物的性质与应用1.判断正误(正确的打“√”,错误的打“×”)。(1)标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA(×) (2)工业上利用合成氨实现人工固氮涉及氧化还原反应(√)
2.溴蒸气和NO2都为红棕色气体,如何区分?用湿润的淀粉KI试纸或NaOH溶液可以吗?
【答案】 ①用AgNO3溶液,Br2可与AgNO3溶液反应生成浅黄色沉淀AgBr;②用水,溶于水后有颜色的是Br2,无颜色的是NO2。不能用湿润的淀粉KI试纸或NaOH溶液区分,因为这两种气体都有氧化性,都可以把KI中的I-氧化成I2,使试纸变蓝色。NaOH溶液可以吸收Br2蒸气和NO2而形成无色溶液。
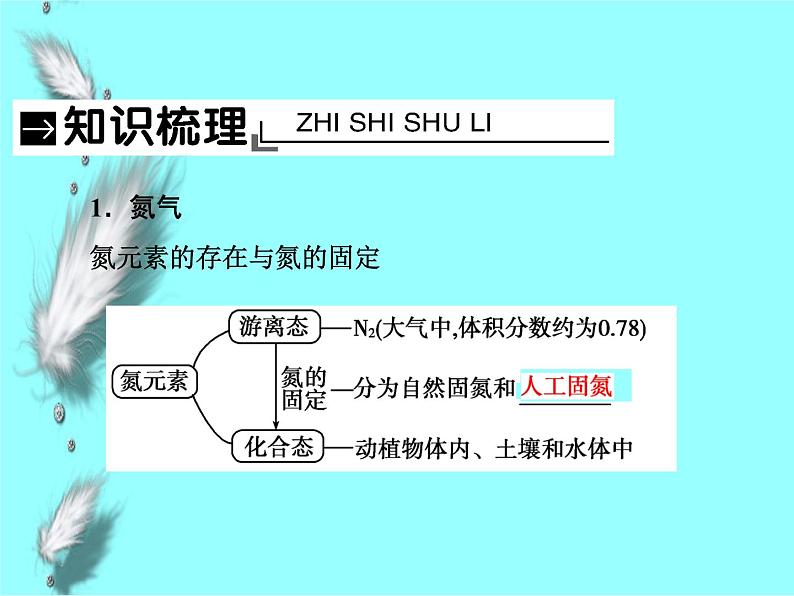
1.氮气氮元素的存在与氮的固定
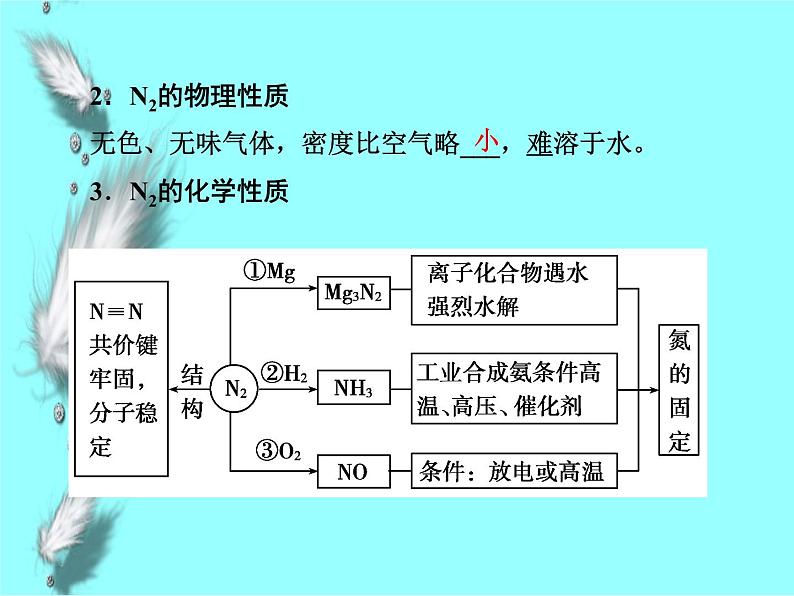
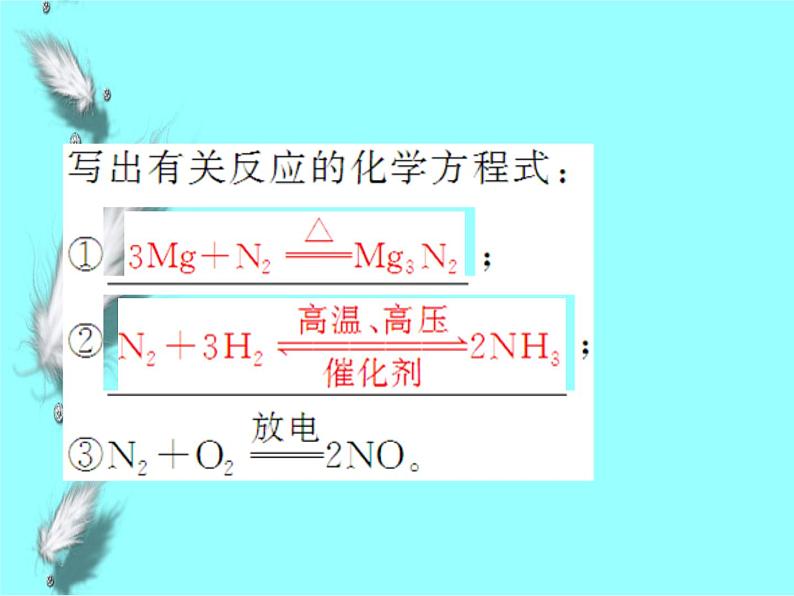
2.N2的物理性质无色、无味气体,密度比空气略___,难溶于水。3.N2的化学性质
4.氮的氧化物氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等。完成下表中NO和NO2的比较:
5.氮氧化物对环境的污染(1)光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。(2)酸雨:NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面。(3)破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。(4)NO与血红蛋白结合使人中毒。
考点1 氮及其氧化物的性质与应用1.判断正误(正确的打“√”,错误的打“×”)。(1)(2016·全国乙卷)用向上排空气法收集铜粉与稀硝酸反应产生的NO(×)(2)(2015·全国卷Ⅰ)密闭容器中2 ml NO与1 ml O2充分反应,产物的分子数为2NA(×)(3)(2015·浙江高考)燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 (√)
(4)(2014·天津高考)制取NO2时,用水或NaOH溶液吸收尾气(×)(5)(2012·新课标全国卷)常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA(√)
2.(2018·北京顺义区统练)氮元素在海洋中的循环是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可如图表示。下列关于海洋氮循环的说法正确的是( )
3.(2018·山东青岛期末)某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。将此无色混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是( )A.肯定有SO2和NO或NO2中的至少一种B.肯定只有NOC.可能有Cl2和O2D.肯定没有Cl2、O2和NO2
【解析】 因为混合气体为无色,所以不含Cl2和NO2气体,A、C错误;能使品红褪色的气体为SO2,B项错误;把剩余气体排入空气中,很快变为红棕色,说明有NO,则原混合气体中无氧气,D项正确。【答案】 D
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶B.在蔗糖中加入少量浓硫酸并不断搅拌C.将少量浓硫酸滴入胆矾晶体中D.加入少量硫酸使乙酸乙酯水解
【解析】 NO2参与硫酸型酸雨的形成时,发生了化学反应,反应后又重新生成,在反应中起催化作用。在乙酸乙酯的水解反应中,硫酸也起催化作用。 【答案】 D
5.NOx是汽车尾气中的主要污染物之一。(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_______________________________________________。(2)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放,当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:___________。
考点3 氮的氧化物溶于水的简单计算6.(2017·沈阳模拟)在一定条件下,将NO2和O2的混合气体12 mL通入足量水中,充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的体积为( )①1.2 mL ②2.4 mL ③3 mL ④4 mLA.①② B.②③C.③④ D.①④
7.(2018·江西第三次联考,12)把一个充满NO2气体的试管,倒置于水槽中,向其中缓慢通入O2直至试管全部充满水。假设整个过程中溶质不会扩散入水槽,则硝酸的物质的量浓度c(HNO3)与通入O2的体积V(O2)关系正确的是( )
高频考点二 硝酸的性质及应用
(4)常温下,将Al片放入浓硝酸中无明显现象,原因是Al与浓硝酸不反应(×)(5)浓硝酸、浓硫酸的浓度大,书写离子方程式时写分子式,不拆写为离子形式(×)(6)浓、稀硝酸都能使蓝色石蕊试纸最终变为红色(×)(7)用浓硝酸与Cu反应制取NO(×)
(2)久置的浓硝酸呈黄色,如何除去?怎样保存浓硝酸?【答案】 浓硝酸显黄色是由于浓硝酸见光或受热发生分解,生成的NO2溶于浓硝酸所致,所以消除的方法是通入O2(或空气),使其发生反应4NO2+O2+2H2O4HNO3。保存时应保存在棕色试剂瓶中,并置于阴凉处。
1.硝酸的物理性质硝酸是无色易挥发的液体,有刺激性气味。2.硝酸的化学性质
【注意】 (1)硝酸浓度越大,其还原产物的价态越高。还原产物一般为HNO3(浓)→NO2,HNO3(稀)→NO。(2)浓硝酸能使紫色石蕊溶液先变红,后褪色,该反应过程中浓硝酸表现出强酸性和强氧化性。(3)常温下,铁、铝遇浓硝酸能发生“钝化”,并非不反应,故浓硝酸可以用铁桶盛放。
(5)(2015·重庆高考)SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4(×)(6)(2014·安徽高考)实验室里用锌粒与稀硝酸反应制取H2(×)(7)(2015·海南高考)稀硝酸可除去试管内壁的银镜(√)
2.(2015·北京高考)在通风橱中进行下列实验:
【方法规律】 硝酸与金属反应的规律 (1)与金属反应时,盐酸或稀硫酸中起氧化作用的是H+,所以能放出H2,而硝酸中+5价氮氧化性远大于H+,所以硝酸与金属反应不放出H2。(2)金属与硝酸反应,金属一般被氧化为高价金属硝酸盐。若金属过量且有变价时,将生成低价金属硝酸盐。如:
(2)若向所得硝酸铜溶液中加入5 ml·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是________。
高频考点三 氨和铵盐1.判断正误(正确的打“√”,错误的打“×”)。(1)液氨汽化时要吸收大量的热,可用作制冷剂(√)(2)向AgNO3溶液中滴加过量氨水,溶液澄清,Ag+与NH3·H2O能大量共存(×)(3)浓氨水可检验氯气管道漏气(√)
(4)分别充满HCl、NH3的烧瓶倒置于水中后液面迅速上升,说明二者均易溶于水(√)(5)实验室用NH4Cl和Ca(OH)2制备NH3并不涉及氧化还原反应(√)(6)氨水能使酚酞变红,氨气是碱(×)(7)氨与酸反应生成铵盐,与挥发性酸相遇时能形成白烟(√)(8)能用加热法除去NaCl中的NH4Cl的原因是NH4Cl为强酸弱碱盐(×)
2.(1)现有1 ml·L-1的氨水,则该溶液中NH3·H2O浓度是1 ml·L-1吗?为什么?(2)为什么蘸有浓氨水和浓盐酸的两支玻璃棒靠近时会产生白烟?蘸有浓氨水和浓硫酸的两支玻璃棒靠近时是否也产生白烟?
3.固态NH4Cl受热变成气体,气体遇冷又变为固态NH4Cl;固态碘受热变成蒸气,蒸气遇冷又变成固态碘,这两种现象的本质是否相同?请说明判断的理由。
【答案】 不相同。NH4Cl固体受热分解生成NH3和HCl,发生了化学变化;固态碘受热升华成为碘蒸气,是物理变化。
1.氨气的物理性质无色有刺激性气味的气体,密度比空气小,易液化。极易溶于水(1∶700),可由喷泉实验证明。2.氨气的化学性质
【注意】 (1)NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,可在推断题中作为解题突破口。(2)氨水呈碱性,属于一元弱碱,计算氨水的浓度时,溶质按NH3进行计算。
(8)(2014·全国卷Ⅰ)施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效(√)(9)(2014·北京高考)加热NH4Cl和Ca(OH)2混合物,并将产生的气体通入酚酞溶液中,酚酞溶液变成红色(√)
(2)硝酸铵加热分解可得到N2O和H2O。250 ℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为____________________________________,平衡常数表达式为__________________;若有1 ml硝酸铵完全分解,转移的电子为________ml。(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 ml N2,其ΔH=________kJ·ml-1。
考点2 喷泉实验3.(2017·聊城模拟)如图装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是( )
A.CO2(NaHCO3溶液)/无色喷泉B.NH3(H2O中含酚酞)/红色喷泉C.H2S(CuSO4溶液)/黑色喷泉D.HCl(AgNO3溶液)/白色喷泉
【解析】 CO2在NaHCO3溶液中的溶解度很小,因此不能形成喷泉;NH3极易溶于水生成NH3·H2O,NH3·H2O发生电离生成OH-,遇酚酞使之显红色;H2S和CuSO4溶液反应生成CuS黑色沉淀;HCl极易溶于水,且和AgNO3发生反应生成白色沉淀;因此A不正确。【答案】 A
4.(2018·安阳模拟)某同学仿照喷泉实验原理在实验室里做了一个“喷烟实验”。如图所示,在甲、乙两个烧瓶中分别装入X、Y两种无色气体,胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶中,然后打开弹簧夹,便可看到甲烧瓶中的导管喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅最后褪为无色。则X、Y分别为( )
A.NH3和HCl B.HCl和NH3C.SO2和HCl D.NO和HCl
【解析】 要想产生“喷烟”现象,应具备两个条件:一是形成压强差,二是两种气体反应会生成白烟,排除C、D项。甲中溶液颜色发生变化,结合题给条件“胶头滴管中盛有含酚酞的NaOH溶液”可知,甲中气体显碱性,即X为NH3,故Y为HCl,选A。【答案】 A
【知识归纳】 喷泉实验的原理及类型(1)喷泉实验的原理: 由于容器内外产生压强差而形成喷泉。气体迅速溶于水或某种溶液中,容器内压强小于容器外压强,从而产生喷泉,依据这一原理,只要能够造成容器内气体大量溶于液体,就可以形成喷泉。(2)形成喷泉的类型:①只要气体易溶于吸收剂,均可做喷泉实验,吸收剂可以是水,也可以是酸液、碱液等。
下面是几种常见的能形成喷泉的气体和液体。
②容器内的液体由于受热挥发(如浓盐酸、浓氨水、酒精等)或由于发生化学反应产生气体,容器内产生大量气体,压强迅速增大,促使容器内液体迅速向外流动,也能形成喷泉。如喷雾器、人造喷泉、火山喷发等均是利用此原理。(3)喷泉实验的几种常见装置:
装置②中最好采用顶部有孔的烧瓶。装置③引发喷泉的方法是打开止水夹,用热毛巾或双手焐热烧瓶,松开后片刻即形成喷泉现象。
考点3 氨气的实验室制法及性质探究5.(2017·聊城模拟)下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
A.①② B.②③C.③④ D.①③
6.(2016·全国乙卷)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:(1)氨气的制备
①氨气的发生装置可以选择上图中的________,反应的化学方程式为________________________________________。②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→________(按气流方向,用小写字母表示)。(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
难点专攻(十三) 氮及其化合物间的转化关系与应用
用化学式填写下列空格:(1)A是________。(2)当X是强酸时,A、B、C、D、E、F均含同一种元素,F是________。(3)当X是强碱时,A、B、C、D、E、F均含同一种元素,F是________。(4)B跟Cl2反应的化学方程式是_____________________。
【特别提醒】 (1)H2S(或S)不能一步转化为SO3。(2)N2(或NH3)不能一步转化为NO2。(3)SiO2不能与水反应生成H2SiO3。(4)Fe2O3、Al2O3、CuO等不溶性金属氧化物都不能一步生成相应的氢氧化物。
【解析】 (1)淡黄色的单质是硫,C为SO2,D为SO3,SO2的作用有漂白、杀菌、消毒、制硫酸等。(2)A、B、C、D分别为N2、NH3、NO、NO2,B与C在一定条件下生成A的反应是归中反应。(3)中学阶段学习的两性物质有铝及铝的氧化物和氢氧化物,故铝元素的位置为第三周期第ⅢA族,要注意族的写法。(4)A为硅晶体,B、C、D分别为SiO2、Na2SiO3、Na2CO3。(5)A为金属铁,C为FeCl3,D为FeCl2。
【解析】 B为红棕色气体,可知B为NO2,NO2与水反应生成E(不为气体),则E为HNO3,可知C为NO,A和O2在闪电作用下得到NO,A为N2,则D为NH3。
【解析】 (1)氯气常用于自来水消毒,则A为Cl2;铁是使用最广泛的金属单质,D是铁,则B为FeCl3,C是FeCl2。(2)碱性气体为NH3,汽车尾气中遇空气会变色的气体是NO。(3)常见的两性物质是Al2O3和Al(OH)3,D、C分别为NaOH和NaAlO2,故B为Al(OH)3。(4)导致酸雨的主要气体是SO2,A与SO2均含有硫元素,且二者反应生成硫单质,故A为H2S。酸雨的主要成分是H2SO3,在放置过程中被氧化为H2SO4,酸性增强。
1.(2018·连云港模拟)NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列有关表述正确的是( )
A.NH4Cl和NaHCO3都是常用的化肥B.NH4Cl、HNO3和Na2CO3受热时都易分解C.NH3和NO2在一定条件下可发生氧化还原反应D.图中所涉及的盐类物质均可以水解【解析】 NaHCO3不能用作肥料,A项错误;Na2CO3很稳定,受热时不易分解,B项错误;C项叙述正确;图中的NaCl是强酸强碱盐,不水解,D项错误。 【答案】 C
2.(2017·吕梁模拟)下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
A.①④ B.①②③C.①③④ D.②④【解析】 ②中N2不能一步生成NO2气体,③中NaOH不能一步生成Na2O。【答案】 A
2024版高考化学一轮复习专题基础练专题四非金属及其化合物考点11氮及其化合物作业课件: 这是一份2024版高考化学一轮复习专题基础练专题四非金属及其化合物考点11氮及其化合物作业课件,共18页。PPT课件主要包含了经典3+2,创新1+1等内容,欢迎下载使用。
高考化学总复习18氮及其化合物课件PPT: 这是一份高考化学总复习18氮及其化合物课件PPT,共51页。PPT课件主要包含了考点三氨铵盐,知识梳理,红棕色,氨的化学性质,NH3↑+H2O,有白烟生成,浓硝酸,氨气的实验室制法,助你进步等内容,欢迎下载使用。
新高考版高中化学 二轮复习 专题十 氮及其化合物 课件: 这是一份新高考版高中化学 二轮复习 专题十 氮及其化合物 课件,共60页。PPT课件主要包含了考情解读,2氮气的性质,2NO与NO2,2NH4+的检验,考点3硝酸,流程梳理等内容,欢迎下载使用。












