






还剩52页未读,
继续阅读
高考化学(人教)大一轮学考复习考点突破课件:第八章 水溶液中的离子平衡 第27讲
展开
这是一份高考化学(人教)大一轮学考复习考点突破课件:第八章 水溶液中的离子平衡 第27讲,共60页。PPT课件主要包含了考点一水的电离,课时作业,×10-14,电解质,10∶1,a+b=14,无法确定,-lgcH+,玻璃片,表面皿等内容,欢迎下载使用。
考纲要求1.了解水的电离、离子积常数。2.了解溶液pH的含义及其测定方法,能进行pH的简单计算。
考点三 酸、碱中和滴定
考点二 溶液的酸碱性和pH
微专题27 关系式法在氧化还原滴定法中的应用
考能提升 探究高考 明确考向
1.水的电离水是极弱的电解质,水的电离方程式为 或 。2.水的离子积常数Kw=c(H+)·c(OH-)。(1)室温下:Kw= 。(2)影响因素:只与 有关,升高温度,Kw 。(3)适用范围:Kw不仅适用于纯水,也适用于稀的 水溶液。(4)Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw不变。
H2O+H2OH3O++OH-
H2OH++OH-
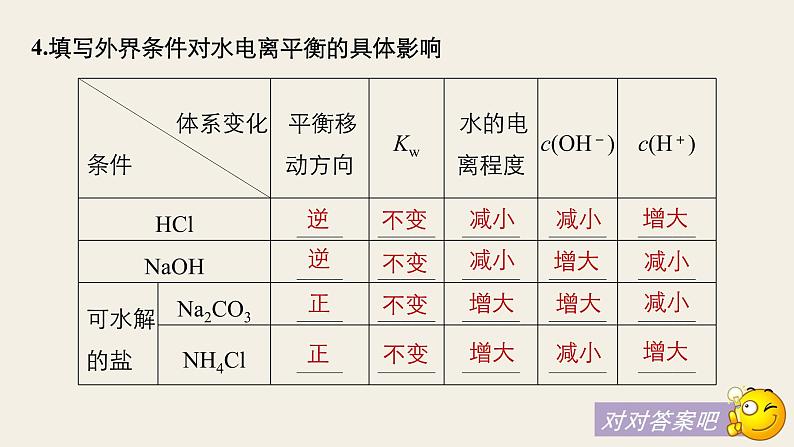
3.影响水电离平衡的因素(1)升高温度,水的电离程度 ,Kw 。(2)加入酸或碱,水的电离程度 ,Kw 。(3)加入可水解的盐(如FeCl3、Na2CO3),水的电离程度 ,Kw 。
4.填写外界条件对水电离平衡的具体影响
1.正误判断,正确的打“√”,错误的打“×”(1)在pH=2的盐酸溶液中由水电离出c(H+)和c(OH-)总是相等的( )(2)在蒸馏水中滴加浓H2SO4,Kw不变( )(3)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( )(4)室温下,0.1 ml·L-1的HCl溶液与0.1 ml·L-1的NaOH溶液中水的电离程度相同( )
(5)25 ℃和60 ℃的水的pH,前者大于后者,但都显中性( )(6)室温下,pH值相同的NaOH溶液与CH3COONa溶液,水的电离程度后者大( )(7)常温下,pH=5的NH4Cl溶液与pH=9的CH3COONa 溶液中,水的电离程度相同( )
2.甲同学认为,在水中加入H2SO4,水的电离平衡向左移动,解释是加入H2SO4后c(H+)增大,平衡左移。乙同学认为,加入H2SO4后,水的电离平衡向右移动,解释为加入H2SO4后,c(H+)浓度增大,H+与OH-中和,平衡右移。你认为哪种说法正确?并说明原因。水的电离平衡移动后,溶液中c(H+)·c(OH-)是增大还是减小?
甲正确,温度不变,Kw是常数,加入H2SO4,c(H+)增大,c(H+)·c(OH-)>Kw,平衡左移。c(H+)·c(OH-)不变,因为Kw仅与温度有关,温度不变,则Kw不变,与外加酸、碱、盐无关。
1.水的离子积常数Kw=c(H+)·c(OH-),其实质是水溶液中的H+和OH-浓度的乘积,不一定是水电离出的H+和OH-浓度的乘积,所以与其说Kw是水的离子积常数,不如说是水溶液中的H+和OH-的离子积常数。即Kw不仅适用于水,还适用于酸性或碱性的稀溶液。不管哪种溶液均有 。2.水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。
题组一 影响水电离平衡的因素及结果判断1.一定温度下,水存在H2OH++OH- ΔH>0的平衡,下列叙述一定正确的是A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小B.将水加热,Kw增大,pH减小C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低D.向水中加入少量固体硫酸钠,c(H+)=10-7 ml·L-1,Kw不变
A项,Kw应不变;C项,平衡应正向移动;D项,由于没有指明温度,c(H+)不一定等于10-7 ml·L-1。
2.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是A.升高温度,可能引起由c向b的变化B.该温度下,水的离子积常数为1.0×10-13C.该温度下,加入FeCl3可能引起由b向a的变化D.该温度下,稀释溶液可能引起由c向d的变化
A项,升高温度,促进水的电离平衡,则c(H+)和c(OH-)都同等程度地增大,若由c向b变化,则c(H+)增大,c(OH-)将变小,错误;B项,根据b点对应的c(H+)和c(OH-)都为1.0×10-7 ml·L-1,所以该温度下,水的离子积常数Kw=1.0×10-7×1.0×10-7=1.0×10-14,错误;C项,加入FeCl3发生水解反应:Fe3++3H2OFe(OH)3+3H+,破坏水的电离平衡,c(H+)增大、Kw不变,c(OH-)变小,则可能引起由b向a变化,正确;D项,c点对应的溶液呈碱性,稀释溶液,c(OH-)变小,Kw不变,c(H+)增大,故可引起由c向b的变化,而不是向d变化,错误。
3.已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。(1)25 ℃时水的电离平衡曲线应为____(填“A”或“B”),请说明理由___________________________________,25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
水电离需要吸热,温度越高Kw越大
25 ℃时,pH=9的NaOH溶液中c(OH-)=1×10-5 ml·L-1,pH=4的硫酸中c(H+)=1×10-4 ml·L-1,当二者恰好反应完时有1×10-5V(碱)=1×10-4V(酸),V(碱)∶V(酸)=10∶1。
(2)95 ℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是_________。
95 ℃时,Kw=1×10-12,pH=a的强酸溶液中,c(H+)=1×10-a ml·L-1,pH=b的强碱溶液中,c(OH-)=10b-12 ml·L-1 ,100×10-a=1×10b-12 ,2-a=b-12,a+b=14。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH___________7,判断的理由是_______________________________________________。
若BOH是弱碱,无法确定酸碱的物质的量的相对多少
由于盐酸中c(H+)>BOH溶液中c(OH-),结合水的电离方程式知二者对水电离程度的抑制能力前者较强,故α1小于α2。若BOH是强碱,等体积混合时酸过量,此时pH<7,若BOH是弱碱,则无法确定碱与酸的物质的量的相对多少,故无法确定反应后溶液的pH。
(4)在曲线B所对应的温度下,将0.02 ml·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=____。
等体积混合时,溶液中Ba2+反应完毕,但此时OH-消耗掉一半,故混合溶液中c(OH-)=0.01 ml·L-1,c(H+)=1×10-10 ml·L-1,故pH=10。
题组二 水电离出的c(H+)或c(OH-)的定量计算4.求算下列常温下溶液中由H2O电离的c(H+)和c(OH-)。(1)pH=2的H2SO4溶液c(H+)=_____________,c(OH-)=____________。
10-12 ml·L-1
10-12 ml·L-1
pH=2的H2SO4溶液中,H+来源有两个:H2SO4的电离和H2O的电离,而OH-只来源于水。应先求算c(OH-),即为水电离的c(H+)或c(OH-)。
(2)pH=10的NaOH溶液c(H+)=_____________,c(OH-)=______________。
10-10 ml·L-1
pH=10的NaOH溶液中,OH-有两个来源:H2O的电离和NaOH的电离,H+只来源于水。应先求出c(H+),即为水电离的c(OH-)或c(H+),c(OH-)=10-4 ml·L-1,c(H+)=10-10 ml·L-1,则水电离的c(H+)=c(OH-)=10-10 ml·L-1。
(3)pH=2的NH4Cl溶液c(H+)=____________。
10-2 ml·L-1
(4)pH=10的Na2CO3溶液c(OH-)=____________。
10-4 ml·L-1
水解的盐溶液中的H+或OH-均由水电离产生,水解显酸性的盐应计算其c(H+),水解显碱性的盐应计算其c(OH-)。pH=2的NH4Cl溶液中由水电离产生的c(H+)=10-2 ml·L-1;pH=10的Na2CO3溶液中由水电离产生的c(OH-)=10-4 ml·L-1。
5.下列四种溶液中,室温下由水电离生成的H+浓度之比(①∶②∶③∶④)是①pH=0的盐酸 ②0.1 ml·L-1的盐酸③0.01 ml·L-1的NaOH溶液 ④pH=11的NaOH溶液A.1∶10∶100∶1 000 B.0∶1∶12∶11C.14∶13∶12∶11 D.14∶13∶2∶3
①中c(H+)=1 ml·L-1,由水电离出的c(H+)与溶液中c(OH-)相等,等于1.0×10-14 ml·L-1;②中c(H+)=0.1 ml·L-1,由水电离出的c(H+)=1.0×10-13 ml·L-1;③中c(OH-)=1.0×10-2 ml·L-1,由水电离出的c(H+)与溶液中c(H+)相等,等于1.0×10-12 ml·L-1;④中c(OH-)=1.0×10-3 ml·L-1,同③所述由水电离出的c(H+)=1.0×10-11 ml·L-1。即(1.0×10-14)∶(1.0×10-13)∶(1.0×10-12)∶(1.0×10-11)=1∶10∶100∶1 000。
理清溶液中H+或OH-的来源(1)常温下,中性溶液c(OH-)=c(H+)=10-7 ml·L-1(2)溶质为酸的溶液①来源OH-全部来自水的电离,水电离产生的c(H+)=c(OH-)。②实例如计算pH=2的盐酸溶液中由水电离出的c(H+),方法是先求出溶液中的c(OH-)=(Kw/10-2) ml·L-1=10-12 ml·L-1,即由水电离出的c(H+)=c(OH-)=10-12 ml·L-1。
(3)溶质为碱的溶液①来源H+全部来自水的电离,水电离产生的c(OH-)=c(H+)。②实例如计算pH=12的NaOH溶液中由水电离出的c(OH-),方法是知道溶液中的c(H+)=10-12 ml·L-1,即由水电离出的c(OH-)=c(H+)=10-12 ml·L-1。(4)水解呈酸性或碱性的盐溶液①pH=5的NH4Cl溶液中H+全部来自水的电离,由水电离的c(H+)=10-5 ml·L-1,因为部分OH-与部分 结合,溶液中c(OH-)=10-9 ml·L-1。②pH=12的Na2CO3溶液中OH-全部来自水的电离,由水电离出的c(OH-)=10-2 ml·L-1。
1.溶液的酸碱性溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。(1)酸性溶液:c(H+) c(OH-),常温下,pH 7。(2)中性溶液:c(H+) c(OH-),常温下,pH 7。(3)碱性溶液:c(H+) c(OH-),常温下,pH 7。2.pH及其测量(1)计算公式:pH= 。
(2)测量方法①pH试纸法:用镊子夹取一小块试纸放在洁净的 或 上,用玻璃棒蘸取待测液点在试纸的中央,变色后与标准比色卡对照,即可确定溶液的pH。②pH计测量法。(3)溶液的酸碱性与pH的关系常温下:
3.溶液pH的计算(1)单一溶液的pH计算强酸溶液:如HnA,设浓度为c ml·L-1,c(H+)=nc ml·L-1,pH=-lgc(H+)=-lg (nc)。强碱溶液(25 ℃):如B(OH)n,设浓度为c ml·L-1,c(H+)= ml·L-1,pH=-lgc(H+)=14+lg(nc)。(2)混合溶液pH的计算类型①两种强酸混合:直接求出c(H+)混,再据此求pH。c(H+)混= 。
②两种强碱混合:先求出c(OH-)混,再据Kw求出c(H+)混,最后求pH。c(OH-)混= 。③强酸、强碱混合:先判断哪种物质过量,再由下式求出溶液中H+或OH-的浓度,最后求pH。c(H+)混或c(OH-)混= 。
1.判断下列溶液在常温下的酸、碱性(在括号中填“酸性”、“碱性”或“中性”)。(1)相同浓度的HCl和NaOH溶液等体积混合( )(2)相同浓度的CH3COOH和NaOH溶液等体积混合( )(3)相同浓度的NH3·H2O和HCl溶液等体积混合( )(4)pH=2的HCl和pH=12的NaOH溶液等体积混合( )(5)pH=3的HCl和pH=10的NaOH溶液等体积混合( )
(6)pH=3的HCl和pH=12的NaOH溶液等体积混合( )(7)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合( )(8)pH=2的HCl和pH=12的NH3·H2O等体积混合( )
2.用pH试纸测溶液的pH时应注意什么问题?记录数据时又要注意什么?是否可用pH试纸测定氯水的pH?
pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能产生误差;用pH试纸读出的pH值只能是整数;不能用pH试纸测定氯水的pH,因为氯水呈酸性的同时呈现强氧化性(漂白性)。
特别提醒(1)溶液呈现酸、碱性的实质是c(H+)与c(OH-)的相对大小,不能只看pH,一定温度下pH=6的溶液也可能显中性,也可能显酸性,应注意温度。(2)使用pH试纸测溶液pH时不能用蒸馏水润湿。(3)25 ℃时,pH=12的溶液不一定为碱溶液,pH=2的溶液也不一定为酸溶液,也可能为能水解的盐溶液。
2.pH=5的H2SO4溶液,加水稀释到500倍,则稀释后c( )与c(H+)的比值为______。
题组一 走出溶液稀释时pH值的判断误区1.1 mL pH=9的NaOH溶液,加水稀释到10 mL,pH=____;加水稀释到100 mL,pH________7。
3.(1)体积相同,浓度均为0.2 ml·L-1的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为______。(2)体积相同,浓度均为0.2 ml·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为______。(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为_______。(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为______。
酸、碱稀释时两个误区(1)不能正确理解酸、碱的无限稀释规律常温下任何酸或碱溶液无限稀释时,溶液的pH都不可能大于7或小于7,只能接近7。
(2)不能正确理解弱酸、弱碱的稀释规律
注:表中a+n<7,b-n>7。
题组二 溶液pH的计算4.按要求计算:常温时下列溶液的pH或浓度(忽略溶液混合时体积的变化):(1)0.1 ml·L-1的CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×10-5)
CH3COOH CH3COO- + H+c(初始) 0.1 0 0c(电离) c(H+) c(H+) c(H+)c(平衡) 0.1-c(H+) c(H+) c(H+)
解得c(H+)=1.3×10-3 ml·L-1,所以pH=-lg c(H+)=-lg(1.3×10-3)=2.9。
NH3·H2O OH- + c(初始) 0.1 ml·L-1 0 0 0.1×1% 0.1×1% 0.1×1% ml·L-1 ml·L-1 ml·L-1则c(OH-)=0.1×1% ml·L-1=10-3ml·L-1c(H+)=10-11 ml·L-1,所以pH=11。
(3)pH=2的盐酸与等体积的水混合
(4)pH=2的盐酸加水稀释到1 000倍
(5)常温下,将0.1 ml·L-1氢氧化钠溶液与0.06 ml·L-1硫酸溶液等体积混合。
(6)取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,求原溶液的浓度。
0.05 ml·L-1
题组三 强酸、强碱混合呈中性pH与体积关系5.在某温度时,测得0.01 ml·L-1的NaOH溶液的pH=11。(1)该温度下水的离子积常数Kw=______。
由题意知,溶液中c(H+)=10-11 ml·L-1,c(OH-)=0.01 ml·L-1,故Kw=c(H+)·c(OH-)=10-13。
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。①若所得混合液为中性,且a=12,b=2,则Va∶Vb=_______。
根据中和反应:H++OH-===H2O。c(H+)·Vb=c(OH-)·Va10-2·Vb=10-13/10-12·Va
根据中和反应H++OH-===H2Oc(H+)·Vb=c(OH-)·Va10-b·Vb=10-13/10-a·Va
②若所得混合液为中性,且a+b=12,则Va∶Vb=________。
有关pH计算的一般思维模型
1.实验原理利用酸碱中和反应,用已知浓度酸(或碱)来测定未知浓度的碱(或酸)的实验方法。以标准盐酸溶液滴定待测的NaOH溶液,待测的NaOH溶液的物质的量浓度为c(NaOH)=。酸碱中和滴定的关键:(1)准确测定 ;(2)准确判断。
2.实验用品(1)仪器图(A)是 ,图B是 、滴定管夹、铁架台、 。
(2)试剂:标准液、待测液、指示剂、蒸馏水。(3)滴定管的使用①酸性、氧化性的试剂一般用酸式滴定管,因为酸性和氧化性物质易 。②碱性的试剂一般用 滴定管,因为碱性物质易 ,致使 无法打开。
3.实验操作实验操作以标准盐酸滴定待测NaOH溶液为例(1)滴定前的准备①滴定管:查漏→洗涤→润洗→装液→调液面→记录。②锥形瓶:注碱液→记体积→加指示剂。(2)滴定
控制滴定管的活塞
锥形瓶内溶液的颜色变化
摇动锥形瓶
(3)终点判断等到滴入最后一滴标准液,指示剂变色,且在半分钟内 原来的颜色,视为滴定终点并记录标准液的体积。(4)数据处理按上述操作重复 次,求出用去标准盐酸体积的平均值,根据c(NaOH)= 计算。
4.常用酸碱指示剂及变色范围
5.指示剂选择的基本原则变色要灵敏,变色范围要小,使变色范围尽量与滴定终点溶液的酸碱性一致。(1)不能用石蕊作指示剂。(2)滴定终点为碱性时,用酚酞作指示剂,例如用NaOH溶液滴定醋酸。(3)滴定终点为酸性时,用甲基橙作指示剂,例如用盐酸滴定氨水。(4)强酸滴定强碱一般用甲基橙,但用酚酞也可以。(5)并不是所有的滴定都必须使用指示剂,如用标准的Na2SO3溶液滴定KMnO4溶液时,KMnO4颜色褪去时即为滴定终点。
1.正误判断,正确的打“√”,错误的打“×”(1)中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2~3 mL( )(2)中和滴定实验时,滴定管、锥形瓶均用待测液润洗( )(3)滴定终点就是酸碱恰好中和的点( )(4)滴定管盛标准溶液时,调液面一定要调到“0”刻度( )(5)滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁( )(2016·海南,8C)
2.KMnO4(H+)溶液、溴水、Na2CO3溶液、稀盐酸应分别盛放在哪种滴定管中?
强氧化性溶液、酸性溶液应盛放在酸式滴定管中,碱性溶液应盛放在碱式滴定管中。即酸性KMnO4溶液、溴水、稀盐酸应盛放在酸式滴定管中,Na2CO3溶液应盛放在碱式滴定管中。
3.酸式滴定管怎样查漏?
将旋塞关闭,滴定管里注入一定量的水,把它固定在滴定管夹上,放置10分钟,观察滴定管口及旋塞两端是否有水渗出,旋塞不渗水才可使用。
题组一 误差分析的全面突破1.用标准盐酸溶液滴定未知浓度的NaOH溶液(酚酞作指示剂),用“偏高”、“偏低”或“无影响”填空。(1)酸式滴定管未用标准溶液润洗( )(2)锥形瓶用待测溶液润洗( )(3)锥形瓶洗净后还留有蒸馏水( )(4)放出碱液的滴定管开始有气泡,放出液体后气泡消失( )(5)酸式滴定管滴定前有气泡,滴定终点时气泡消失( )
(6)部分酸液滴出锥形瓶外( )(7)酸式滴定管滴定前读数正确,滴定后俯视读数(或前仰后俯)( )(8)酸式滴定管滴定前读数正确,滴定后仰视读数(或前俯后仰)( )
题组二 指示剂、仪器的准确选择2.实验室现有3种酸碱指示剂,其pH变色范围如下:甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0用0.100 0 ml·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是A.溶液呈中性,可选用甲基橙或酚酞作指示剂B.溶液呈中性,只能选用石蕊作指示剂C.溶液呈碱性,可选用甲基橙或酚酞作指示剂D.溶液呈碱性,只能选用酚酞作指示剂
NaOH溶液和CH3COOH溶液恰好完全反应时生成CH3COONa,由于CH3COO-水解显碱性,而酚酞的变色范围为8.2~10.0,比较接近。因此答案为D。
3.用已知浓度的NaOH溶液滴定某H2SO4溶液的浓度(如图所示),下表中正确的选项是
题组三 滴定终点的规范描述及数据处理4.(1)用a ml·L-1的HCl滴定未知浓度的NaOH溶液,用酚酞作指示剂,达到滴定终点的现象是______________________________________________________________;若用甲基橙作指示剂,滴定终点现象是_________________________________________________________________。(2)用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,应选用_________作指示剂,达到滴定终点的现象是____________________________________________________________。
当滴入最后一滴标准液,溶液由黄色变为橙色,且半分钟内不恢复黄色
滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不恢复红色
当滴入最后一滴标准液,溶液由无色变为蓝色,且半分钟内不褪色
(3)用标准酸性KMnO4溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,是否需要选用指示剂_____(填“是”或“否”),达到滴定终点的现象是________________________________________________________________________。(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再用KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+,滴定Ti3+时发生反应的离子方程式为_________________________,达到滴定终点时的现象是______________________________________________________。
当滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,且半分钟内不褪色
Ti3++Fe3+===Ti4++Fe2+
当滴入最后一滴标准液,溶液变成红色,且半分钟内不褪色
5.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____________________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并_________________为止。
在求c(NaOH)和进行误差分析时应依据公式:c(NaOH)= 。欲求c(NaOH),须先求V[(HCl)aq]再代入公式;进行误差分析时,要考虑实际操作对每一个量即V[(HCl)aq]和V[(NaOH)aq]的影响,进而影响c(NaOH)。考查酸碱中和滴定实验的规范操作。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填字母)。A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥C.酸式滴定管在滴定前有气泡,滴定后气泡消失D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
考查由于不正确操作引起的误差分析。滴定管未用标准盐酸润洗,内壁附着一层水,可将加入的盐酸稀释,中和相同量的碱,所需盐酸的体积偏大,结果偏高;用碱式滴定管取出的待测NaOH溶液的物质的量一旦确定,倒入锥形瓶后,水的加入不影响OH-的物质的量,也就不影响结果;若排出气泡,液面会下降,故读取V酸偏大,结果偏高;正确读数(虚线部分)和错误读数(实线部分)如图所示:
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为______mL,终点读数为_____mL,所用盐酸溶液的体积为______mL。
读数时,以凹液面的最低点为基准。
(4)某学生根据3次实验分别记录有关数据如下表:
依据上表数据列式计算该NaOH溶液的物质的量浓度。
滴定终点的判断答题模板当滴入最后一滴×××标准溶液后,溶液变成×××色,且半分钟内不恢复原来的颜色。解答此类题目注意三个关键点:(1)最后一滴:必须说明是滴入“最后一滴”溶液。(2)颜色变化:必须说明滴入“最后一滴”溶液后溶液“颜色的变化”。(3)半分钟:必须说明溶液颜色变化后“半分钟内不再恢复原来的颜色”。
题组四 滴定曲线的图像分析6.酸碱中和滴定曲线是以酸碱滴定过程中滴加碱(或酸)的量或中和百分数为横坐标,以溶液pH为纵坐标,绘出溶液pH随碱(或酸)的滴加量而变化的曲线。它描述了滴定过程中溶液pH的变化情况,特别是滴定终点附近溶液pH的突变情况。右图为某浓度的NaOH溶液滴定10.00 mL一定浓度的盐酸的示意图。根据图像分析:(1)HCl溶液的浓度是______________,NaOH溶液的浓度是________________;(2)x=______。
0.050 00 ml·L-1
0.100 0 ml·L-1
由图可知,未滴定时,pH=1,说明盐酸中H+浓度为0.100 0 ml·L-1,即盐酸浓度为0.100 0 ml·L-1,而加入20.00 mL NaOH溶液可以中和10.00 mL 0.100 0 ml·L-1盐酸,说明NaOH溶液浓度为0.050 0 ml·L-1,n(NaOH)=0.050 00 ml·L-1×0.02 L=0.001 ml。
7.已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下,向20 mL 0.01 ml·L-1 CH3COOH溶液中逐滴加入0.01 ml·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:(已知lg4=0.6)(1)a点溶液中c(H+)为_______________,pH约为___。
4×10-4 ml·L-1
(2)a、b、c、d四点中水的电离程度最大的是___点,滴定过程中宜选用______作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
a点是醋酸溶液,b点是醋酸和少量CH3COOK的混合溶液,c点是CH3COOK和少量醋酸的混合溶液,d点是CH3COOK和KOH的混合溶液,酸、碱均能抑制水的电离,CH3COOK水解促进水的电离,所以c点溶液中水的电离程度最大。由于酸碱恰好完全反应时溶液显碱性,故应该选择在碱性范围内变色的指示剂酚酞。滴定终点应在c点以上。
(3)若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。
由于稀氨水显碱性,首先排除选项A和C;两者恰好反应时溶液显酸性,排除选项D。
氧化还原滴定法滴定操作不仅适用于酸碱中和反应,也可迁移应用于氧化还原反应进行物质含量的测定,计算方法主要用“关系式”法。(1)原理以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质。(2)实例 ①酸性KMnO4溶液滴定H2C2O4溶液原理:2 +6H++5H2C2O4===10CO2↑+2Mn2++8H2O。指示剂:酸性KMnO4溶液本身呈紫色,不用另外选择指示剂,当滴入最后一滴酸性KMnO4溶液后,溶液由无色变浅红色,且半分钟内不褪色,说明到达滴定终点。
②Na2S2O3溶液滴定碘液原理:2Na2S2O3+I2===Na2S4O6+2NaI。指示剂:用淀粉作指示剂,当滴入一滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色,说明到达滴定终点。
1.(2016·天津理综,9)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。Ⅰ.测定原理:碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH-===2MnO(OH)2↓
酸性条件下,MnO(OH)2将I-氧化为I2:②MnO(OH)2+I-+H+―→Mn2++I2+H2O(未配平)用Na2S2O3标准溶液滴定生成的I2:③。Ⅱ.测定步骤:a.安装装置,检验气密性,充N2排尽空气后,停止充N2。b.向烧瓶中加入200 mL水样。c.向烧瓶中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧 溶液(过量),开启搅拌器,至反应①完全。d.搅拌并向烧瓶中加入2 mL H2SO4无氧溶液,至反应②完全,溶液为中 性或弱酸性。
e.从烧瓶中取出40.00 mL溶液,以淀粉作指示剂,用0.010 00 ml·L-1 Na2S2O3溶液进行滴定,记录数据。f.……g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。回答下列问题:(1)配制以上无氧溶液时,除去所用溶剂水中氧的简单操作为________。
气体在水中的溶解度随着温度升高而减小,将溶剂水煮沸可以除去所用溶剂水中氧气。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为____。①滴定管 ②注射器 ③量筒
搅拌可以使溶液混合均匀,加快反应速率。
(3)搅拌的作用是______________________________。
在橡胶塞处加入水样及有关试剂,应选择注射器。
使溶液混合均匀,快速完成反应
(4)配平反应②的方程式,其化学计量数依次为_________。
1,2,4,1,1,3
Mn元素的化合价由+4价降低到+2价,碘元素的化合价由-1价升高到0价,根据化合价升降总数相等,反应②配平后化学方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O,故其化学计量数依次为1,2,4,1,1,3。
(5)步骤f为_______________________。
(6)步骤e中达到滴定终点的标志为________________________________。若某次滴定消耗Na2S2O3溶液4.50 mL,水样的DO=_____mg·L-1(保留一位小数)。作为饮用水源,此次测得DO是否达标:____(填“是”或“否”)。
重复步骤e的操作2~3次
溶液蓝色褪去且半分钟内不恢复原色
为了减小实验的误差,滴定操作一般需要重复操作2~3次,因此步骤f为重复步骤e的操作2~3次。
I-被氧化为I2后,再用Na2S2O3溶液滴定,将I2还原为I-,因此滴定结束时,溶液的蓝色消失且半分钟不恢复原色;n(Na2S2O3)=0.010 00 ml·L-1×0.004 5 L=4.5×10-5 ml,根据反应①②③有O2~2MnO(OH)2~ 2I2~4 ,n(O2)= n(Na2S2O3)=1.125×10-5 ml,该河水的DO= mg·L-1=9.0 mg·L-1>5 mg·L-1,此次测得的DO达标。
(7)步骤d中加入H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)___________________________________________________________________________________________________________。
Na2S2O3在酸性条件下发生歧化反应,生成的SO2也能够被生成的I2氧化,同时空气中的O2也能够将I-氧化,反应的离子方程式有2H++ ===S↓+SO2↑+H2O,SO2+I2+2H2O===4H++ +2I-,4H++4I-+O2===2I2+ 2H2O。
2.为测定某石灰石中CaCO3的质量分数,称取W g石灰石样品,加入过量的浓度为6 ml·L-1的盐酸,使它完全溶解,加热煮沸,除去溶解的CO2,再加入足量的草酸铵[(NH4)2C2O4]溶液后,慢慢加入氨水可降低溶液的酸度,则析出草酸钙沉淀:C2O +Ca2+===CaC2O4↓,过滤出CaC2O4后,用稀硫酸溶解:CaC2O4+H2SO4===H2C2O4+CaSO4,再用蒸馏水稀释至V0 mL,取出V1 mL,用a ml·L-1的酸性KMnO4溶液滴定,此时发生反应2MnO +5H2C2O4+6H+===2Mn++10CO2↑+8H2O,若达到滴定终点时消耗a ml·L-1的KMnO4溶液V2 mL,计算样品中CaCO3的质量分数:___________。
本题涉及的化学方程式或离子方程式为CaCO3+2HCl===CaCl2+H2O+CO2↑, +Ca2+===CaC2O4↓,CaC2O4+H2SO4===H2C2O4+CaSO4, +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,由此得出相应的关系式:5CaCO3~5H2C2O4~5 ml 2 mln(CaCO3) a ml·L-1×V2×10-3 L解得:n(CaCO3)=2.5aV2×10-3 ml则原溶液中w(CaCO3) =×100%= %。
3.某实验小组称取重铬酸钾试样2.40 g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,然后加入适量水和数滴淀粉指示剂,用0.24 ml·L-1Na2S2O3标准溶液滴定至终点(发生反应:I2+2 ===2I-+ ,杂质不参与反应),共用去Na2S2O3标准溶液20.00 mL。求所得产品中重铬酸钾的质量分数(写出计算过程)。
称取重铬酸钾试样2.40 g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6 min左右,反应为 +6I-+14H+===2Cr3++3I2+7H2O,然后加入适量水和数滴淀粉指示剂,用0.24 ml·L-1Na2S2O3标准溶液滴定至终点,发生反应:I2+2 ===2I-+ ,共用Na2S2O3标准溶液20.00 mL,依据反应的定量关系为 ~ 3I2 ~ 6Na2S2O3 1 6 0.24 ml·L-1×0.020 0 L n
4.(2016·辽宁高三一模)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:a.软锰矿与过量KOH、KClO3固体熔融生成K2MnO4;b.溶解、过滤后将滤液酸化,使K2MnO4完全转化为MnO2和KMnO4;c.滤去MnO2,将滤液浓缩、结晶得到深紫色的KMnO4产品。(1)溶液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是_________________________________________;
由滤液酸化后,K2MnO4转变为MnO2和KMnO4,则反应为3MnO +4H+===MnO2↓+2MnO +2H2O。
(2)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。①配制250 mL 0.100 ml·L-1标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量为______g;
n=cV=0.100 ml·L-1×0.250 L=0.025 ml,m=nM=0.025 0 ml×158 g·ml-11=3.950 g;
②取上述制得的KMnO4产品0.600 0 g,酸化后用0.100 ml·L-1标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液20.00 mL。计算该KMnO4产品的纯度(写出计算过程)。(有关离子方程式为未配平)
由化学方程式: ,设样品中KMnO4物质的量为n ml,可知8KMnO4~5n 0.100 ml·L-1×20.00 mL×10-3L所以n(KMnO4)= ×0.100 ml·L-1×20.00 mL×10-3 L=3.2×10-3 ml所以m(KMnO4)=nM=3.2×10-3ml×158 g·ml-1=0.505 6 g,KMnO4产品的纯度为 ×100%≈84.27%。
1.(2015·广东理综,12)准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 ml·L-1NaOH溶液滴定。下列说法正确的是A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
A项,滴定管用水洗涤后,还要用待装溶液润洗,否则将引起误差,错误;B项,在用NaOH溶液滴定盐酸的过程中,锥形瓶内溶液由酸性逐渐变为中性,溶液的pH由小变大,正确;C项,用酚酞作指示剂,锥形瓶中溶液应由无色变为粉红色,且半分钟内不恢复原色时才能停止滴定,错误;D项,滴定达终点时,发现滴定管尖嘴部分有悬滴,则碱液的体积偏大,测定结果偏大,错误。
2.(2015·山东理综,13)室温下向10 mL 0.1 ml·L-1NaOH溶液中加入0.1 ml·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)B.a、b两点所示溶液中水的电离程度相同C.pH=7时,c(Na+)=c(A-)+c(HA)D.b点所示溶液中c(A-)>c(HA)
A项,a点NaOH与HA恰好完全反应,溶液的pH为8.7,呈碱性,说明HA为弱酸,NaA发生了水解反应,则溶液中:c(Na+)>c(A-)>c(OH-)>c(HA) >c(H+),错误;B项,a点NaA发生了水解反应,促进了水的电离,b点主要由于HA的电离而使溶液呈酸性,抑制了水的电离,所以a点水的电离程度大于b点水的电离程度,错误;C项,根据电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),pH=7,则c(H+)=c(OH-),可得c(Na+)=c(A-),错误;D项,b点溶液中溶质为等物质的量NaA和HA,溶液呈酸性,说明HA的电离程度大于NaA的水解程度,所以c(A-)>c(HA),正确。
3.(2013·新课标全国卷Ⅱ,13)室温时,M(OH)2(s)M2+(aq)+2OH-(aq) Ksp=a,c(M2+)=b ml·L-1时,溶液的pH等于
由Ksp=c(M2+)·c2(OH-)得c(OH-)= ml·L-1,Kw=c(H+)·c(OH-)得c(H+)= ml·L-1,pH=-lg =14+ 。
4.(2012·新课标全国卷,11)已知温度T ℃时水的离子积常数为Kw,该温度下,将浓度为a ml·L-1的一元酸HA与b ml·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是A.a=bB.混合溶液的pH=7C.混合溶液中,c(H+)= ml·L-1D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
判断溶液呈中性的依据是c(H+)=c(OH-)。A项,a=b,酸碱恰好完全反应生成正盐和水,由于酸碱强弱未知,不能确定溶液的酸碱性;B项,未说明温度为25 ℃,故混合溶液的pH=7时不一定呈中性;C项,混合溶液中,c(H+)·c(OH-)=Kw,因为c(H+)= ml·L-1,则c(OH-)= ml·L-1,c(H+)=c(OH-),故溶液呈中性;D项,c(H+)+c(B+)=c(OH-)+c(A-),只能说明溶液中电荷守恒,无法判断溶液的酸碱性。
5.[2015·山东理综,31(3)]利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b ml·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b ml·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的_____ (填“上方”或“下方”)。BaCl2溶液的浓度为___________ml·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将______(填“偏大”或“偏小”)。
“0”刻度位于滴定管的上方。由题意可得关系式BaCl2~ ~H+,则有c(BaCl2)×y×10-3L=b ml·L-1×(V0-V1)×10-3 L,解得c(BaCl2)= ml·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则V1变小,Ba2+浓度测量值将偏大。
1.(2016·绵阳诊断)25 ℃时,水的电离达到平衡:H2OH++OH-。下列叙述错误的是A.向水中通入氨气,平衡逆向移动,c(OH-)增大B.向水中加入少量稀硫酸,c(H+)增大,Kw不变C.将水加热平衡正向移动,Kw变大D.升高温度,平衡正向移动,c(H+)增大,pH不变
向水中通入NH3,c(OH-)增大,平衡左移,A正确;向水中加入少量稀H2SO4,c(H+)增大,但温度不变,Kw不变,B正确;将水加热,水的电离平衡正向移动,Kw变大,C正确;升高温度,能促进水的电离,c(H+)增大,pH减小,D错误。
2.水的电离常数如下图两条曲线所示,曲线中的点都符合c(H+)·c(OH-)=常数,下列说法错误的是 A.图中温度T1 >T2B.图中五点Kw间的关系:B>C>A=D=EC.曲线a、b均代表纯水的电离情况D.若处在B点时,将pH=2的硫酸溶液与pH= 12的KOH溶液等体积混合后,溶液显碱性
D项,B点Kw=10-12,H2SO4中c(H+)=10-2 ml·L-1,KOH中c(OH-)= ml·L-1=1 ml·L-1,等体积混合后,KOH过量,溶液呈碱性,正确。
3.(2017·岳阳检测)某温度下,水的离子积常数Kw=1×10-12。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为A.1∶10 B.9∶1C.1∶9 D.99∶21
设稀硫酸的体积为a,NaOH溶液的体积为b,则10-3b-10-4a=10-5(a+b),a∶b=9∶1。
4.在25 ℃时,向V mL pH=m的HNO3中滴加pH=n的KOH溶液10V mL时,溶液中 的物质的量恰好等于加入的K+的物质的量,则m+n的值为A.13 B.14 C.15 D.不能确定
溶液中 的物质的量恰好等于加入K+的物质的量,说明反应HNO3+KOH===KNO3+H2O恰好完全进行,溶液呈中性,故n(HNO3)=n(KOH),即V×10-3×10-m=10V×10-3×10n-14,解得:m+n=13。
5.25 ℃时,Kw=1.0×10-14;100 ℃时,Kw=1×10-12,下列说法正确的是A.100 ℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的 pH=7B.25 ℃时,0.2 ml·L-1 Ba(OH)2溶液和0.2 ml·L-1 HCl等体积混合,所得 溶液的pH=7C.25 ℃时,0.2 ml·L-1 NaOH溶液与0.2 ml·L-1 CH3COOH恰好中和,所 得溶液的pH=7D.25 ℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的 pH>7
100 ℃时,NaOH和H2SO4恰好中和时,pH=6,A错误;25 ℃时,c(OH-)=0.4 ml·L-1,c(H+)=0.2 ml·L-1,等体积混合后pH大于7,B错误;C项,由于CH3COO-的水解pH大于7;D项,氨水过量pH>7,正确。
6.将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;则下列叙述正确的是A.若V1>V2,则说明HA的酸性比HB的酸性强B.若V1>V2,则说明HA的酸性比HB的酸性弱C.因为两种酸溶液的pH相等,故V1一定等于V2D.HA、HB分别和NaOH中和后,所得的溶液都一定呈中性
中和等量的氢氧化钠需要等量的一元酸,若V1>V2,说明HA的浓度小,比HB的电离程度大,HA的酸性强,A正确、B错误;C项,因为酸的电离程度不一定相同,所以需要的体积不一定相同,错误;D项,因为不能确定酸的强弱,不能确定盐溶液的酸碱性,错误。
7.(2016·郑州模拟)常温下,0.1 ml·L-1某一元酸(HA)溶液中 =1×10-8,下列叙述正确的是A.该一元酸溶液的pH=1B.该溶液中由水电离出的c(H+)=1×10-11ml·L-1C.该溶液中水的离子积常数为1×10-22D.用pH=11的NaOH溶液V1 L和V2 L 0.1·ml·L-1该一元酸(HA)溶液混合, 若混合溶液的pH=7,则V1<V2
将c(OH-)= 代入原题关系式中可得 =1×10-8,解得c(H+)=1×10-3 ml·L-1,所以该溶液的pH=3,A项错;酸溶液中水的电离看氢氧根离子,c(OH-)= ml·L-1=1×10-11 ml·L-1,所以由水电离子出的c(H+)=1×10-11ml·L-1,B项正确;温度一定,水的离子积是一个常数,C项错误;由于HA是弱酸,二者等体积混合呈酸性,当pH=7时应有V1>V2,D项错。
8.(2016·昆明四校联考)用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中会引起实验误差的是A.滴定前酸式滴定管需用标准盐酸润洗B.用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定C.往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行 滴定D.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的 NaOH溶液
锥形瓶内存有少量蒸馏水,但待测液的物质的量不变,消耗标准液的体积不变,B不会引起误差;锥形瓶不能用待测液润洗,否则会使测定结果偏高。
9.(2016·烟台检测)中和滴定是一种操作简单、准确度高的定量分析方法。实际工作中也可利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点。下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是A.用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度:KMnO4——浅红色B.利用a“Ag++SCN-===AgSCN↓”原理,可用标准KSCN溶液测量AgNO3溶 液浓度:Fe(NO3)3——红色C.利用“2Fe3++2I-===I2+2Fe2+”,用FeCl3溶液测量KI样品中KI的百分含量: 淀粉——蓝色D.利用OH-+H+===H2O来测量某盐酸的浓度时:酚酞——浅红色
滴定反应一旦开始就有I2生成,溶液就呈现蓝色,故无法判断终点。
10.向盛有10 mL NaOH溶液的烧杯中逐滴滴加稀盐酸,下列图像能够体现溶液pH变化情况的是
原溶液为NaOH溶液,pH>7,当向其中逐滴加入盐酸时,pH会减小,当接近中和反应终点时,pH突变,而后pH不断减小并趋于不变,本题选C。
11.如图曲线a和b是盐酸与氢氧化钠相互滴定的滴定曲线,下列叙述正确的是A.盐酸的物质的量浓度为1 ml·L-1B.P点时恰好完全反应,溶液呈中性C.曲线a是盐酸滴定氢氧化钠的滴定曲线D.酚酞不能用作本实验的指示剂
P点表示盐酸与氢氧化钠恰好完全中和,溶液呈中性,B正确。
12.(2016·安徽“江南十校”联考)常温下向25 mL 0.1 ml·L-1NaOH溶液中逐滴滴加0.2 ml·L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是A.水电离出的c(H+):A点小于B点B.在B点,离子浓度大小为c(OH-)>c(H+)> c(Na+)>c(N )C.在C点,滴加的V(HN3)=12.5 mLD.在D点,c(Na+)=2c(HN3)+2c(N )
叠氮酸HN3的Ka=10-4.7,说明HN3是一元弱酸。NaOH抑制水的电离,NaOH溶液的物质的量浓度:A点大于B点,则水电离出c(H+);A点小于B点,A项正确;B点溶液中,c(Na+)>c( )>c(OH-)>c(H+),B项错误;NaN3属于强碱弱酸盐,NaN3溶液因 发生水解而呈碱性,C点溶液呈中性,说明此时HN3过量,V(HN3)>12.5 mL,C项错误;D点溶液中,根据物料守恒,2c(Na+)=c( )+c( ),D项错误。
13.Ⅰ.现有常温下的六份溶液:①0.01 ml· L-1 CH3COOH溶液;②0.01 ml· L-1 HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 ml· L-1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 ml· L-1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。(1)其中水的电离程度最大的是____(填序号,下同),水的电离程度相同的是_______。
酸和碱都会抑制水的电离,故只有⑥(NaCl溶液)对H2O的电离无抑制作用。②③④对水的电离抑制程度相同。
(2)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②____(填“>”、“<”或“=”)③。
因pH=12的氨水中c(NH3·H2O)>0.01 ml·L-1,故②③混合,欲使pH=7,则需体积②>③。
(3)将六份溶液同等稀释10倍后,溶液的pH:①____②,③____④,⑤____⑥(填“>”、“<”或“=”)。
稀释同样的倍数后,溶液的pH:①>②;③>④;⑤>⑥。
(4)将①④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈____________(填字母)。A.酸性 B.碱性 C.中性
由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-), 仅知道c(CH3COO-)>c(H+),无法比较c(H+)与c(OH-)的相对大小,也就无法判断混合液的酸碱性,故选ABC。
Ⅱ.下表中是不同温度下水的离子积的数据:
试回答以下问题:(1)若25<t1<t2,则a_____(填“>”、“<”或“=”)1×10-14,作此判断的理由是_______________________________________。
温度升高,水的电离程度增大,离子积增大
升高温度,促进水的电离,水的离子积常数增大。
(2)25 ℃时,某Na2SO4溶液中c( )=5×10-4 ml·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
c(Na+)= =1.0×10-4 ml·L-1,而25 ℃时c(OH-)=1.0×10-7 ml·L-1,所以c(Na+)∶c(OH-)=(1.0×10-4 ml·L-1)∶(1.0×10-7 ml·L-1)=1 000∶1。
(3)在t2温度下测得某溶液pH=7,该溶液显____(填“酸”、“碱”或“中”)性。将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合。 ①若所得混合液呈中性,则a∶b=______。
t2温度下,pH=6的溶液呈中性,则pH=7的溶液显碱性。若所得混合液呈中性,即n(H+)=n(OH-),1×10-1 ml·L-1×b L= ml·L-1×a L,则a∶b=1∶1。
考纲要求1.了解水的电离、离子积常数。2.了解溶液pH的含义及其测定方法,能进行pH的简单计算。
考点三 酸、碱中和滴定
考点二 溶液的酸碱性和pH
微专题27 关系式法在氧化还原滴定法中的应用
考能提升 探究高考 明确考向
1.水的电离水是极弱的电解质,水的电离方程式为 或 。2.水的离子积常数Kw=c(H+)·c(OH-)。(1)室温下:Kw= 。(2)影响因素:只与 有关,升高温度,Kw 。(3)适用范围:Kw不仅适用于纯水,也适用于稀的 水溶液。(4)Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw不变。
H2O+H2OH3O++OH-
H2OH++OH-
3.影响水电离平衡的因素(1)升高温度,水的电离程度 ,Kw 。(2)加入酸或碱,水的电离程度 ,Kw 。(3)加入可水解的盐(如FeCl3、Na2CO3),水的电离程度 ,Kw 。
4.填写外界条件对水电离平衡的具体影响
1.正误判断,正确的打“√”,错误的打“×”(1)在pH=2的盐酸溶液中由水电离出c(H+)和c(OH-)总是相等的( )(2)在蒸馏水中滴加浓H2SO4,Kw不变( )(3)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( )(4)室温下,0.1 ml·L-1的HCl溶液与0.1 ml·L-1的NaOH溶液中水的电离程度相同( )
(5)25 ℃和60 ℃的水的pH,前者大于后者,但都显中性( )(6)室温下,pH值相同的NaOH溶液与CH3COONa溶液,水的电离程度后者大( )(7)常温下,pH=5的NH4Cl溶液与pH=9的CH3COONa 溶液中,水的电离程度相同( )
2.甲同学认为,在水中加入H2SO4,水的电离平衡向左移动,解释是加入H2SO4后c(H+)增大,平衡左移。乙同学认为,加入H2SO4后,水的电离平衡向右移动,解释为加入H2SO4后,c(H+)浓度增大,H+与OH-中和,平衡右移。你认为哪种说法正确?并说明原因。水的电离平衡移动后,溶液中c(H+)·c(OH-)是增大还是减小?
甲正确,温度不变,Kw是常数,加入H2SO4,c(H+)增大,c(H+)·c(OH-)>Kw,平衡左移。c(H+)·c(OH-)不变,因为Kw仅与温度有关,温度不变,则Kw不变,与外加酸、碱、盐无关。
1.水的离子积常数Kw=c(H+)·c(OH-),其实质是水溶液中的H+和OH-浓度的乘积,不一定是水电离出的H+和OH-浓度的乘积,所以与其说Kw是水的离子积常数,不如说是水溶液中的H+和OH-的离子积常数。即Kw不仅适用于水,还适用于酸性或碱性的稀溶液。不管哪种溶液均有 。2.水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。
题组一 影响水电离平衡的因素及结果判断1.一定温度下,水存在H2OH++OH- ΔH>0的平衡,下列叙述一定正确的是A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小B.将水加热,Kw增大,pH减小C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低D.向水中加入少量固体硫酸钠,c(H+)=10-7 ml·L-1,Kw不变
A项,Kw应不变;C项,平衡应正向移动;D项,由于没有指明温度,c(H+)不一定等于10-7 ml·L-1。
2.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是A.升高温度,可能引起由c向b的变化B.该温度下,水的离子积常数为1.0×10-13C.该温度下,加入FeCl3可能引起由b向a的变化D.该温度下,稀释溶液可能引起由c向d的变化
A项,升高温度,促进水的电离平衡,则c(H+)和c(OH-)都同等程度地增大,若由c向b变化,则c(H+)增大,c(OH-)将变小,错误;B项,根据b点对应的c(H+)和c(OH-)都为1.0×10-7 ml·L-1,所以该温度下,水的离子积常数Kw=1.0×10-7×1.0×10-7=1.0×10-14,错误;C项,加入FeCl3发生水解反应:Fe3++3H2OFe(OH)3+3H+,破坏水的电离平衡,c(H+)增大、Kw不变,c(OH-)变小,则可能引起由b向a变化,正确;D项,c点对应的溶液呈碱性,稀释溶液,c(OH-)变小,Kw不变,c(H+)增大,故可引起由c向b的变化,而不是向d变化,错误。
3.已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。(1)25 ℃时水的电离平衡曲线应为____(填“A”或“B”),请说明理由___________________________________,25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
水电离需要吸热,温度越高Kw越大
25 ℃时,pH=9的NaOH溶液中c(OH-)=1×10-5 ml·L-1,pH=4的硫酸中c(H+)=1×10-4 ml·L-1,当二者恰好反应完时有1×10-5V(碱)=1×10-4V(酸),V(碱)∶V(酸)=10∶1。
(2)95 ℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是_________。
95 ℃时,Kw=1×10-12,pH=a的强酸溶液中,c(H+)=1×10-a ml·L-1,pH=b的强碱溶液中,c(OH-)=10b-12 ml·L-1 ,100×10-a=1×10b-12 ,2-a=b-12,a+b=14。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH___________7,判断的理由是_______________________________________________。
若BOH是弱碱,无法确定酸碱的物质的量的相对多少
由于盐酸中c(H+)>BOH溶液中c(OH-),结合水的电离方程式知二者对水电离程度的抑制能力前者较强,故α1小于α2。若BOH是强碱,等体积混合时酸过量,此时pH<7,若BOH是弱碱,则无法确定碱与酸的物质的量的相对多少,故无法确定反应后溶液的pH。
(4)在曲线B所对应的温度下,将0.02 ml·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=____。
等体积混合时,溶液中Ba2+反应完毕,但此时OH-消耗掉一半,故混合溶液中c(OH-)=0.01 ml·L-1,c(H+)=1×10-10 ml·L-1,故pH=10。
题组二 水电离出的c(H+)或c(OH-)的定量计算4.求算下列常温下溶液中由H2O电离的c(H+)和c(OH-)。(1)pH=2的H2SO4溶液c(H+)=_____________,c(OH-)=____________。
10-12 ml·L-1
10-12 ml·L-1
pH=2的H2SO4溶液中,H+来源有两个:H2SO4的电离和H2O的电离,而OH-只来源于水。应先求算c(OH-),即为水电离的c(H+)或c(OH-)。
(2)pH=10的NaOH溶液c(H+)=_____________,c(OH-)=______________。
10-10 ml·L-1
pH=10的NaOH溶液中,OH-有两个来源:H2O的电离和NaOH的电离,H+只来源于水。应先求出c(H+),即为水电离的c(OH-)或c(H+),c(OH-)=10-4 ml·L-1,c(H+)=10-10 ml·L-1,则水电离的c(H+)=c(OH-)=10-10 ml·L-1。
(3)pH=2的NH4Cl溶液c(H+)=____________。
10-2 ml·L-1
(4)pH=10的Na2CO3溶液c(OH-)=____________。
10-4 ml·L-1
水解的盐溶液中的H+或OH-均由水电离产生,水解显酸性的盐应计算其c(H+),水解显碱性的盐应计算其c(OH-)。pH=2的NH4Cl溶液中由水电离产生的c(H+)=10-2 ml·L-1;pH=10的Na2CO3溶液中由水电离产生的c(OH-)=10-4 ml·L-1。
5.下列四种溶液中,室温下由水电离生成的H+浓度之比(①∶②∶③∶④)是①pH=0的盐酸 ②0.1 ml·L-1的盐酸③0.01 ml·L-1的NaOH溶液 ④pH=11的NaOH溶液A.1∶10∶100∶1 000 B.0∶1∶12∶11C.14∶13∶12∶11 D.14∶13∶2∶3
①中c(H+)=1 ml·L-1,由水电离出的c(H+)与溶液中c(OH-)相等,等于1.0×10-14 ml·L-1;②中c(H+)=0.1 ml·L-1,由水电离出的c(H+)=1.0×10-13 ml·L-1;③中c(OH-)=1.0×10-2 ml·L-1,由水电离出的c(H+)与溶液中c(H+)相等,等于1.0×10-12 ml·L-1;④中c(OH-)=1.0×10-3 ml·L-1,同③所述由水电离出的c(H+)=1.0×10-11 ml·L-1。即(1.0×10-14)∶(1.0×10-13)∶(1.0×10-12)∶(1.0×10-11)=1∶10∶100∶1 000。
理清溶液中H+或OH-的来源(1)常温下,中性溶液c(OH-)=c(H+)=10-7 ml·L-1(2)溶质为酸的溶液①来源OH-全部来自水的电离,水电离产生的c(H+)=c(OH-)。②实例如计算pH=2的盐酸溶液中由水电离出的c(H+),方法是先求出溶液中的c(OH-)=(Kw/10-2) ml·L-1=10-12 ml·L-1,即由水电离出的c(H+)=c(OH-)=10-12 ml·L-1。
(3)溶质为碱的溶液①来源H+全部来自水的电离,水电离产生的c(OH-)=c(H+)。②实例如计算pH=12的NaOH溶液中由水电离出的c(OH-),方法是知道溶液中的c(H+)=10-12 ml·L-1,即由水电离出的c(OH-)=c(H+)=10-12 ml·L-1。(4)水解呈酸性或碱性的盐溶液①pH=5的NH4Cl溶液中H+全部来自水的电离,由水电离的c(H+)=10-5 ml·L-1,因为部分OH-与部分 结合,溶液中c(OH-)=10-9 ml·L-1。②pH=12的Na2CO3溶液中OH-全部来自水的电离,由水电离出的c(OH-)=10-2 ml·L-1。
1.溶液的酸碱性溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。(1)酸性溶液:c(H+) c(OH-),常温下,pH 7。(2)中性溶液:c(H+) c(OH-),常温下,pH 7。(3)碱性溶液:c(H+) c(OH-),常温下,pH 7。2.pH及其测量(1)计算公式:pH= 。
(2)测量方法①pH试纸法:用镊子夹取一小块试纸放在洁净的 或 上,用玻璃棒蘸取待测液点在试纸的中央,变色后与标准比色卡对照,即可确定溶液的pH。②pH计测量法。(3)溶液的酸碱性与pH的关系常温下:
3.溶液pH的计算(1)单一溶液的pH计算强酸溶液:如HnA,设浓度为c ml·L-1,c(H+)=nc ml·L-1,pH=-lgc(H+)=-lg (nc)。强碱溶液(25 ℃):如B(OH)n,设浓度为c ml·L-1,c(H+)= ml·L-1,pH=-lgc(H+)=14+lg(nc)。(2)混合溶液pH的计算类型①两种强酸混合:直接求出c(H+)混,再据此求pH。c(H+)混= 。
②两种强碱混合:先求出c(OH-)混,再据Kw求出c(H+)混,最后求pH。c(OH-)混= 。③强酸、强碱混合:先判断哪种物质过量,再由下式求出溶液中H+或OH-的浓度,最后求pH。c(H+)混或c(OH-)混= 。
1.判断下列溶液在常温下的酸、碱性(在括号中填“酸性”、“碱性”或“中性”)。(1)相同浓度的HCl和NaOH溶液等体积混合( )(2)相同浓度的CH3COOH和NaOH溶液等体积混合( )(3)相同浓度的NH3·H2O和HCl溶液等体积混合( )(4)pH=2的HCl和pH=12的NaOH溶液等体积混合( )(5)pH=3的HCl和pH=10的NaOH溶液等体积混合( )
(6)pH=3的HCl和pH=12的NaOH溶液等体积混合( )(7)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合( )(8)pH=2的HCl和pH=12的NH3·H2O等体积混合( )
2.用pH试纸测溶液的pH时应注意什么问题?记录数据时又要注意什么?是否可用pH试纸测定氯水的pH?
pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能产生误差;用pH试纸读出的pH值只能是整数;不能用pH试纸测定氯水的pH,因为氯水呈酸性的同时呈现强氧化性(漂白性)。
特别提醒(1)溶液呈现酸、碱性的实质是c(H+)与c(OH-)的相对大小,不能只看pH,一定温度下pH=6的溶液也可能显中性,也可能显酸性,应注意温度。(2)使用pH试纸测溶液pH时不能用蒸馏水润湿。(3)25 ℃时,pH=12的溶液不一定为碱溶液,pH=2的溶液也不一定为酸溶液,也可能为能水解的盐溶液。
2.pH=5的H2SO4溶液,加水稀释到500倍,则稀释后c( )与c(H+)的比值为______。
题组一 走出溶液稀释时pH值的判断误区1.1 mL pH=9的NaOH溶液,加水稀释到10 mL,pH=____;加水稀释到100 mL,pH________7。
3.(1)体积相同,浓度均为0.2 ml·L-1的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为______。(2)体积相同,浓度均为0.2 ml·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为______。(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为_______。(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为______。
酸、碱稀释时两个误区(1)不能正确理解酸、碱的无限稀释规律常温下任何酸或碱溶液无限稀释时,溶液的pH都不可能大于7或小于7,只能接近7。
(2)不能正确理解弱酸、弱碱的稀释规律
注:表中a+n<7,b-n>7。
题组二 溶液pH的计算4.按要求计算:常温时下列溶液的pH或浓度(忽略溶液混合时体积的变化):(1)0.1 ml·L-1的CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×10-5)
CH3COOH CH3COO- + H+c(初始) 0.1 0 0c(电离) c(H+) c(H+) c(H+)c(平衡) 0.1-c(H+) c(H+) c(H+)
解得c(H+)=1.3×10-3 ml·L-1,所以pH=-lg c(H+)=-lg(1.3×10-3)=2.9。
NH3·H2O OH- + c(初始) 0.1 ml·L-1 0 0 0.1×1% 0.1×1% 0.1×1% ml·L-1 ml·L-1 ml·L-1则c(OH-)=0.1×1% ml·L-1=10-3ml·L-1c(H+)=10-11 ml·L-1,所以pH=11。
(3)pH=2的盐酸与等体积的水混合
(4)pH=2的盐酸加水稀释到1 000倍
(5)常温下,将0.1 ml·L-1氢氧化钠溶液与0.06 ml·L-1硫酸溶液等体积混合。
(6)取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,求原溶液的浓度。
0.05 ml·L-1
题组三 强酸、强碱混合呈中性pH与体积关系5.在某温度时,测得0.01 ml·L-1的NaOH溶液的pH=11。(1)该温度下水的离子积常数Kw=______。
由题意知,溶液中c(H+)=10-11 ml·L-1,c(OH-)=0.01 ml·L-1,故Kw=c(H+)·c(OH-)=10-13。
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。①若所得混合液为中性,且a=12,b=2,则Va∶Vb=_______。
根据中和反应:H++OH-===H2O。c(H+)·Vb=c(OH-)·Va10-2·Vb=10-13/10-12·Va
根据中和反应H++OH-===H2Oc(H+)·Vb=c(OH-)·Va10-b·Vb=10-13/10-a·Va
②若所得混合液为中性,且a+b=12,则Va∶Vb=________。
有关pH计算的一般思维模型
1.实验原理利用酸碱中和反应,用已知浓度酸(或碱)来测定未知浓度的碱(或酸)的实验方法。以标准盐酸溶液滴定待测的NaOH溶液,待测的NaOH溶液的物质的量浓度为c(NaOH)=。酸碱中和滴定的关键:(1)准确测定 ;(2)准确判断。
2.实验用品(1)仪器图(A)是 ,图B是 、滴定管夹、铁架台、 。
(2)试剂:标准液、待测液、指示剂、蒸馏水。(3)滴定管的使用①酸性、氧化性的试剂一般用酸式滴定管,因为酸性和氧化性物质易 。②碱性的试剂一般用 滴定管,因为碱性物质易 ,致使 无法打开。
3.实验操作实验操作以标准盐酸滴定待测NaOH溶液为例(1)滴定前的准备①滴定管:查漏→洗涤→润洗→装液→调液面→记录。②锥形瓶:注碱液→记体积→加指示剂。(2)滴定
控制滴定管的活塞
锥形瓶内溶液的颜色变化
摇动锥形瓶
(3)终点判断等到滴入最后一滴标准液,指示剂变色,且在半分钟内 原来的颜色,视为滴定终点并记录标准液的体积。(4)数据处理按上述操作重复 次,求出用去标准盐酸体积的平均值,根据c(NaOH)= 计算。
4.常用酸碱指示剂及变色范围
5.指示剂选择的基本原则变色要灵敏,变色范围要小,使变色范围尽量与滴定终点溶液的酸碱性一致。(1)不能用石蕊作指示剂。(2)滴定终点为碱性时,用酚酞作指示剂,例如用NaOH溶液滴定醋酸。(3)滴定终点为酸性时,用甲基橙作指示剂,例如用盐酸滴定氨水。(4)强酸滴定强碱一般用甲基橙,但用酚酞也可以。(5)并不是所有的滴定都必须使用指示剂,如用标准的Na2SO3溶液滴定KMnO4溶液时,KMnO4颜色褪去时即为滴定终点。
1.正误判断,正确的打“√”,错误的打“×”(1)中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2~3 mL( )(2)中和滴定实验时,滴定管、锥形瓶均用待测液润洗( )(3)滴定终点就是酸碱恰好中和的点( )(4)滴定管盛标准溶液时,调液面一定要调到“0”刻度( )(5)滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁( )(2016·海南,8C)
2.KMnO4(H+)溶液、溴水、Na2CO3溶液、稀盐酸应分别盛放在哪种滴定管中?
强氧化性溶液、酸性溶液应盛放在酸式滴定管中,碱性溶液应盛放在碱式滴定管中。即酸性KMnO4溶液、溴水、稀盐酸应盛放在酸式滴定管中,Na2CO3溶液应盛放在碱式滴定管中。
3.酸式滴定管怎样查漏?
将旋塞关闭,滴定管里注入一定量的水,把它固定在滴定管夹上,放置10分钟,观察滴定管口及旋塞两端是否有水渗出,旋塞不渗水才可使用。
题组一 误差分析的全面突破1.用标准盐酸溶液滴定未知浓度的NaOH溶液(酚酞作指示剂),用“偏高”、“偏低”或“无影响”填空。(1)酸式滴定管未用标准溶液润洗( )(2)锥形瓶用待测溶液润洗( )(3)锥形瓶洗净后还留有蒸馏水( )(4)放出碱液的滴定管开始有气泡,放出液体后气泡消失( )(5)酸式滴定管滴定前有气泡,滴定终点时气泡消失( )
(6)部分酸液滴出锥形瓶外( )(7)酸式滴定管滴定前读数正确,滴定后俯视读数(或前仰后俯)( )(8)酸式滴定管滴定前读数正确,滴定后仰视读数(或前俯后仰)( )
题组二 指示剂、仪器的准确选择2.实验室现有3种酸碱指示剂,其pH变色范围如下:甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0用0.100 0 ml·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是A.溶液呈中性,可选用甲基橙或酚酞作指示剂B.溶液呈中性,只能选用石蕊作指示剂C.溶液呈碱性,可选用甲基橙或酚酞作指示剂D.溶液呈碱性,只能选用酚酞作指示剂
NaOH溶液和CH3COOH溶液恰好完全反应时生成CH3COONa,由于CH3COO-水解显碱性,而酚酞的变色范围为8.2~10.0,比较接近。因此答案为D。
3.用已知浓度的NaOH溶液滴定某H2SO4溶液的浓度(如图所示),下表中正确的选项是
题组三 滴定终点的规范描述及数据处理4.(1)用a ml·L-1的HCl滴定未知浓度的NaOH溶液,用酚酞作指示剂,达到滴定终点的现象是______________________________________________________________;若用甲基橙作指示剂,滴定终点现象是_________________________________________________________________。(2)用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,应选用_________作指示剂,达到滴定终点的现象是____________________________________________________________。
当滴入最后一滴标准液,溶液由黄色变为橙色,且半分钟内不恢复黄色
滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不恢复红色
当滴入最后一滴标准液,溶液由无色变为蓝色,且半分钟内不褪色
(3)用标准酸性KMnO4溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,是否需要选用指示剂_____(填“是”或“否”),达到滴定终点的现象是________________________________________________________________________。(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再用KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+,滴定Ti3+时发生反应的离子方程式为_________________________,达到滴定终点时的现象是______________________________________________________。
当滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,且半分钟内不褪色
Ti3++Fe3+===Ti4++Fe2+
当滴入最后一滴标准液,溶液变成红色,且半分钟内不褪色
5.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____________________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并_________________为止。
在求c(NaOH)和进行误差分析时应依据公式:c(NaOH)= 。欲求c(NaOH),须先求V[(HCl)aq]再代入公式;进行误差分析时,要考虑实际操作对每一个量即V[(HCl)aq]和V[(NaOH)aq]的影响,进而影响c(NaOH)。考查酸碱中和滴定实验的规范操作。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填字母)。A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥C.酸式滴定管在滴定前有气泡,滴定后气泡消失D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
考查由于不正确操作引起的误差分析。滴定管未用标准盐酸润洗,内壁附着一层水,可将加入的盐酸稀释,中和相同量的碱,所需盐酸的体积偏大,结果偏高;用碱式滴定管取出的待测NaOH溶液的物质的量一旦确定,倒入锥形瓶后,水的加入不影响OH-的物质的量,也就不影响结果;若排出气泡,液面会下降,故读取V酸偏大,结果偏高;正确读数(虚线部分)和错误读数(实线部分)如图所示:
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为______mL,终点读数为_____mL,所用盐酸溶液的体积为______mL。
读数时,以凹液面的最低点为基准。
(4)某学生根据3次实验分别记录有关数据如下表:
依据上表数据列式计算该NaOH溶液的物质的量浓度。
滴定终点的判断答题模板当滴入最后一滴×××标准溶液后,溶液变成×××色,且半分钟内不恢复原来的颜色。解答此类题目注意三个关键点:(1)最后一滴:必须说明是滴入“最后一滴”溶液。(2)颜色变化:必须说明滴入“最后一滴”溶液后溶液“颜色的变化”。(3)半分钟:必须说明溶液颜色变化后“半分钟内不再恢复原来的颜色”。
题组四 滴定曲线的图像分析6.酸碱中和滴定曲线是以酸碱滴定过程中滴加碱(或酸)的量或中和百分数为横坐标,以溶液pH为纵坐标,绘出溶液pH随碱(或酸)的滴加量而变化的曲线。它描述了滴定过程中溶液pH的变化情况,特别是滴定终点附近溶液pH的突变情况。右图为某浓度的NaOH溶液滴定10.00 mL一定浓度的盐酸的示意图。根据图像分析:(1)HCl溶液的浓度是______________,NaOH溶液的浓度是________________;(2)x=______。
0.050 00 ml·L-1
0.100 0 ml·L-1
由图可知,未滴定时,pH=1,说明盐酸中H+浓度为0.100 0 ml·L-1,即盐酸浓度为0.100 0 ml·L-1,而加入20.00 mL NaOH溶液可以中和10.00 mL 0.100 0 ml·L-1盐酸,说明NaOH溶液浓度为0.050 0 ml·L-1,n(NaOH)=0.050 00 ml·L-1×0.02 L=0.001 ml。
7.已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下,向20 mL 0.01 ml·L-1 CH3COOH溶液中逐滴加入0.01 ml·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:(已知lg4=0.6)(1)a点溶液中c(H+)为_______________,pH约为___。
4×10-4 ml·L-1
(2)a、b、c、d四点中水的电离程度最大的是___点,滴定过程中宜选用______作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
a点是醋酸溶液,b点是醋酸和少量CH3COOK的混合溶液,c点是CH3COOK和少量醋酸的混合溶液,d点是CH3COOK和KOH的混合溶液,酸、碱均能抑制水的电离,CH3COOK水解促进水的电离,所以c点溶液中水的电离程度最大。由于酸碱恰好完全反应时溶液显碱性,故应该选择在碱性范围内变色的指示剂酚酞。滴定终点应在c点以上。
(3)若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。
由于稀氨水显碱性,首先排除选项A和C;两者恰好反应时溶液显酸性,排除选项D。
氧化还原滴定法滴定操作不仅适用于酸碱中和反应,也可迁移应用于氧化还原反应进行物质含量的测定,计算方法主要用“关系式”法。(1)原理以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质。(2)实例 ①酸性KMnO4溶液滴定H2C2O4溶液原理:2 +6H++5H2C2O4===10CO2↑+2Mn2++8H2O。指示剂:酸性KMnO4溶液本身呈紫色,不用另外选择指示剂,当滴入最后一滴酸性KMnO4溶液后,溶液由无色变浅红色,且半分钟内不褪色,说明到达滴定终点。
②Na2S2O3溶液滴定碘液原理:2Na2S2O3+I2===Na2S4O6+2NaI。指示剂:用淀粉作指示剂,当滴入一滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色,说明到达滴定终点。
1.(2016·天津理综,9)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。Ⅰ.测定原理:碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH-===2MnO(OH)2↓
酸性条件下,MnO(OH)2将I-氧化为I2:②MnO(OH)2+I-+H+―→Mn2++I2+H2O(未配平)用Na2S2O3标准溶液滴定生成的I2:③。Ⅱ.测定步骤:a.安装装置,检验气密性,充N2排尽空气后,停止充N2。b.向烧瓶中加入200 mL水样。c.向烧瓶中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧 溶液(过量),开启搅拌器,至反应①完全。d.搅拌并向烧瓶中加入2 mL H2SO4无氧溶液,至反应②完全,溶液为中 性或弱酸性。
e.从烧瓶中取出40.00 mL溶液,以淀粉作指示剂,用0.010 00 ml·L-1 Na2S2O3溶液进行滴定,记录数据。f.……g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。回答下列问题:(1)配制以上无氧溶液时,除去所用溶剂水中氧的简单操作为________。
气体在水中的溶解度随着温度升高而减小,将溶剂水煮沸可以除去所用溶剂水中氧气。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为____。①滴定管 ②注射器 ③量筒
搅拌可以使溶液混合均匀,加快反应速率。
(3)搅拌的作用是______________________________。
在橡胶塞处加入水样及有关试剂,应选择注射器。
使溶液混合均匀,快速完成反应
(4)配平反应②的方程式,其化学计量数依次为_________。
1,2,4,1,1,3
Mn元素的化合价由+4价降低到+2价,碘元素的化合价由-1价升高到0价,根据化合价升降总数相等,反应②配平后化学方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O,故其化学计量数依次为1,2,4,1,1,3。
(5)步骤f为_______________________。
(6)步骤e中达到滴定终点的标志为________________________________。若某次滴定消耗Na2S2O3溶液4.50 mL,水样的DO=_____mg·L-1(保留一位小数)。作为饮用水源,此次测得DO是否达标:____(填“是”或“否”)。
重复步骤e的操作2~3次
溶液蓝色褪去且半分钟内不恢复原色
为了减小实验的误差,滴定操作一般需要重复操作2~3次,因此步骤f为重复步骤e的操作2~3次。
I-被氧化为I2后,再用Na2S2O3溶液滴定,将I2还原为I-,因此滴定结束时,溶液的蓝色消失且半分钟不恢复原色;n(Na2S2O3)=0.010 00 ml·L-1×0.004 5 L=4.5×10-5 ml,根据反应①②③有O2~2MnO(OH)2~ 2I2~4 ,n(O2)= n(Na2S2O3)=1.125×10-5 ml,该河水的DO= mg·L-1=9.0 mg·L-1>5 mg·L-1,此次测得的DO达标。
(7)步骤d中加入H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)___________________________________________________________________________________________________________。
Na2S2O3在酸性条件下发生歧化反应,生成的SO2也能够被生成的I2氧化,同时空气中的O2也能够将I-氧化,反应的离子方程式有2H++ ===S↓+SO2↑+H2O,SO2+I2+2H2O===4H++ +2I-,4H++4I-+O2===2I2+ 2H2O。
2.为测定某石灰石中CaCO3的质量分数,称取W g石灰石样品,加入过量的浓度为6 ml·L-1的盐酸,使它完全溶解,加热煮沸,除去溶解的CO2,再加入足量的草酸铵[(NH4)2C2O4]溶液后,慢慢加入氨水可降低溶液的酸度,则析出草酸钙沉淀:C2O +Ca2+===CaC2O4↓,过滤出CaC2O4后,用稀硫酸溶解:CaC2O4+H2SO4===H2C2O4+CaSO4,再用蒸馏水稀释至V0 mL,取出V1 mL,用a ml·L-1的酸性KMnO4溶液滴定,此时发生反应2MnO +5H2C2O4+6H+===2Mn++10CO2↑+8H2O,若达到滴定终点时消耗a ml·L-1的KMnO4溶液V2 mL,计算样品中CaCO3的质量分数:___________。
本题涉及的化学方程式或离子方程式为CaCO3+2HCl===CaCl2+H2O+CO2↑, +Ca2+===CaC2O4↓,CaC2O4+H2SO4===H2C2O4+CaSO4, +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,由此得出相应的关系式:5CaCO3~5H2C2O4~5 ml 2 mln(CaCO3) a ml·L-1×V2×10-3 L解得:n(CaCO3)=2.5aV2×10-3 ml则原溶液中w(CaCO3) =×100%= %。
3.某实验小组称取重铬酸钾试样2.40 g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,然后加入适量水和数滴淀粉指示剂,用0.24 ml·L-1Na2S2O3标准溶液滴定至终点(发生反应:I2+2 ===2I-+ ,杂质不参与反应),共用去Na2S2O3标准溶液20.00 mL。求所得产品中重铬酸钾的质量分数(写出计算过程)。
称取重铬酸钾试样2.40 g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6 min左右,反应为 +6I-+14H+===2Cr3++3I2+7H2O,然后加入适量水和数滴淀粉指示剂,用0.24 ml·L-1Na2S2O3标准溶液滴定至终点,发生反应:I2+2 ===2I-+ ,共用Na2S2O3标准溶液20.00 mL,依据反应的定量关系为 ~ 3I2 ~ 6Na2S2O3 1 6 0.24 ml·L-1×0.020 0 L n
4.(2016·辽宁高三一模)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:a.软锰矿与过量KOH、KClO3固体熔融生成K2MnO4;b.溶解、过滤后将滤液酸化,使K2MnO4完全转化为MnO2和KMnO4;c.滤去MnO2,将滤液浓缩、结晶得到深紫色的KMnO4产品。(1)溶液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是_________________________________________;
由滤液酸化后,K2MnO4转变为MnO2和KMnO4,则反应为3MnO +4H+===MnO2↓+2MnO +2H2O。
(2)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。①配制250 mL 0.100 ml·L-1标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量为______g;
n=cV=0.100 ml·L-1×0.250 L=0.025 ml,m=nM=0.025 0 ml×158 g·ml-11=3.950 g;
②取上述制得的KMnO4产品0.600 0 g,酸化后用0.100 ml·L-1标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液20.00 mL。计算该KMnO4产品的纯度(写出计算过程)。(有关离子方程式为未配平)
由化学方程式: ,设样品中KMnO4物质的量为n ml,可知8KMnO4~5n 0.100 ml·L-1×20.00 mL×10-3L所以n(KMnO4)= ×0.100 ml·L-1×20.00 mL×10-3 L=3.2×10-3 ml所以m(KMnO4)=nM=3.2×10-3ml×158 g·ml-1=0.505 6 g,KMnO4产品的纯度为 ×100%≈84.27%。
1.(2015·广东理综,12)准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 ml·L-1NaOH溶液滴定。下列说法正确的是A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
A项,滴定管用水洗涤后,还要用待装溶液润洗,否则将引起误差,错误;B项,在用NaOH溶液滴定盐酸的过程中,锥形瓶内溶液由酸性逐渐变为中性,溶液的pH由小变大,正确;C项,用酚酞作指示剂,锥形瓶中溶液应由无色变为粉红色,且半分钟内不恢复原色时才能停止滴定,错误;D项,滴定达终点时,发现滴定管尖嘴部分有悬滴,则碱液的体积偏大,测定结果偏大,错误。
2.(2015·山东理综,13)室温下向10 mL 0.1 ml·L-1NaOH溶液中加入0.1 ml·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)B.a、b两点所示溶液中水的电离程度相同C.pH=7时,c(Na+)=c(A-)+c(HA)D.b点所示溶液中c(A-)>c(HA)
A项,a点NaOH与HA恰好完全反应,溶液的pH为8.7,呈碱性,说明HA为弱酸,NaA发生了水解反应,则溶液中:c(Na+)>c(A-)>c(OH-)>c(HA) >c(H+),错误;B项,a点NaA发生了水解反应,促进了水的电离,b点主要由于HA的电离而使溶液呈酸性,抑制了水的电离,所以a点水的电离程度大于b点水的电离程度,错误;C项,根据电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),pH=7,则c(H+)=c(OH-),可得c(Na+)=c(A-),错误;D项,b点溶液中溶质为等物质的量NaA和HA,溶液呈酸性,说明HA的电离程度大于NaA的水解程度,所以c(A-)>c(HA),正确。
3.(2013·新课标全国卷Ⅱ,13)室温时,M(OH)2(s)M2+(aq)+2OH-(aq) Ksp=a,c(M2+)=b ml·L-1时,溶液的pH等于
由Ksp=c(M2+)·c2(OH-)得c(OH-)= ml·L-1,Kw=c(H+)·c(OH-)得c(H+)= ml·L-1,pH=-lg =14+ 。
4.(2012·新课标全国卷,11)已知温度T ℃时水的离子积常数为Kw,该温度下,将浓度为a ml·L-1的一元酸HA与b ml·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是A.a=bB.混合溶液的pH=7C.混合溶液中,c(H+)= ml·L-1D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
判断溶液呈中性的依据是c(H+)=c(OH-)。A项,a=b,酸碱恰好完全反应生成正盐和水,由于酸碱强弱未知,不能确定溶液的酸碱性;B项,未说明温度为25 ℃,故混合溶液的pH=7时不一定呈中性;C项,混合溶液中,c(H+)·c(OH-)=Kw,因为c(H+)= ml·L-1,则c(OH-)= ml·L-1,c(H+)=c(OH-),故溶液呈中性;D项,c(H+)+c(B+)=c(OH-)+c(A-),只能说明溶液中电荷守恒,无法判断溶液的酸碱性。
5.[2015·山东理综,31(3)]利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b ml·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b ml·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的_____ (填“上方”或“下方”)。BaCl2溶液的浓度为___________ml·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将______(填“偏大”或“偏小”)。
“0”刻度位于滴定管的上方。由题意可得关系式BaCl2~ ~H+,则有c(BaCl2)×y×10-3L=b ml·L-1×(V0-V1)×10-3 L,解得c(BaCl2)= ml·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则V1变小,Ba2+浓度测量值将偏大。
1.(2016·绵阳诊断)25 ℃时,水的电离达到平衡:H2OH++OH-。下列叙述错误的是A.向水中通入氨气,平衡逆向移动,c(OH-)增大B.向水中加入少量稀硫酸,c(H+)增大,Kw不变C.将水加热平衡正向移动,Kw变大D.升高温度,平衡正向移动,c(H+)增大,pH不变
向水中通入NH3,c(OH-)增大,平衡左移,A正确;向水中加入少量稀H2SO4,c(H+)增大,但温度不变,Kw不变,B正确;将水加热,水的电离平衡正向移动,Kw变大,C正确;升高温度,能促进水的电离,c(H+)增大,pH减小,D错误。
2.水的电离常数如下图两条曲线所示,曲线中的点都符合c(H+)·c(OH-)=常数,下列说法错误的是 A.图中温度T1 >T2B.图中五点Kw间的关系:B>C>A=D=EC.曲线a、b均代表纯水的电离情况D.若处在B点时,将pH=2的硫酸溶液与pH= 12的KOH溶液等体积混合后,溶液显碱性
D项,B点Kw=10-12,H2SO4中c(H+)=10-2 ml·L-1,KOH中c(OH-)= ml·L-1=1 ml·L-1,等体积混合后,KOH过量,溶液呈碱性,正确。
3.(2017·岳阳检测)某温度下,水的离子积常数Kw=1×10-12。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为A.1∶10 B.9∶1C.1∶9 D.99∶21
设稀硫酸的体积为a,NaOH溶液的体积为b,则10-3b-10-4a=10-5(a+b),a∶b=9∶1。
4.在25 ℃时,向V mL pH=m的HNO3中滴加pH=n的KOH溶液10V mL时,溶液中 的物质的量恰好等于加入的K+的物质的量,则m+n的值为A.13 B.14 C.15 D.不能确定
溶液中 的物质的量恰好等于加入K+的物质的量,说明反应HNO3+KOH===KNO3+H2O恰好完全进行,溶液呈中性,故n(HNO3)=n(KOH),即V×10-3×10-m=10V×10-3×10n-14,解得:m+n=13。
5.25 ℃时,Kw=1.0×10-14;100 ℃时,Kw=1×10-12,下列说法正确的是A.100 ℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的 pH=7B.25 ℃时,0.2 ml·L-1 Ba(OH)2溶液和0.2 ml·L-1 HCl等体积混合,所得 溶液的pH=7C.25 ℃时,0.2 ml·L-1 NaOH溶液与0.2 ml·L-1 CH3COOH恰好中和,所 得溶液的pH=7D.25 ℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的 pH>7
100 ℃时,NaOH和H2SO4恰好中和时,pH=6,A错误;25 ℃时,c(OH-)=0.4 ml·L-1,c(H+)=0.2 ml·L-1,等体积混合后pH大于7,B错误;C项,由于CH3COO-的水解pH大于7;D项,氨水过量pH>7,正确。
6.将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;则下列叙述正确的是A.若V1>V2,则说明HA的酸性比HB的酸性强B.若V1>V2,则说明HA的酸性比HB的酸性弱C.因为两种酸溶液的pH相等,故V1一定等于V2D.HA、HB分别和NaOH中和后,所得的溶液都一定呈中性
中和等量的氢氧化钠需要等量的一元酸,若V1>V2,说明HA的浓度小,比HB的电离程度大,HA的酸性强,A正确、B错误;C项,因为酸的电离程度不一定相同,所以需要的体积不一定相同,错误;D项,因为不能确定酸的强弱,不能确定盐溶液的酸碱性,错误。
7.(2016·郑州模拟)常温下,0.1 ml·L-1某一元酸(HA)溶液中 =1×10-8,下列叙述正确的是A.该一元酸溶液的pH=1B.该溶液中由水电离出的c(H+)=1×10-11ml·L-1C.该溶液中水的离子积常数为1×10-22D.用pH=11的NaOH溶液V1 L和V2 L 0.1·ml·L-1该一元酸(HA)溶液混合, 若混合溶液的pH=7,则V1<V2
将c(OH-)= 代入原题关系式中可得 =1×10-8,解得c(H+)=1×10-3 ml·L-1,所以该溶液的pH=3,A项错;酸溶液中水的电离看氢氧根离子,c(OH-)= ml·L-1=1×10-11 ml·L-1,所以由水电离子出的c(H+)=1×10-11ml·L-1,B项正确;温度一定,水的离子积是一个常数,C项错误;由于HA是弱酸,二者等体积混合呈酸性,当pH=7时应有V1>V2,D项错。
8.(2016·昆明四校联考)用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中会引起实验误差的是A.滴定前酸式滴定管需用标准盐酸润洗B.用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定C.往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行 滴定D.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的 NaOH溶液
锥形瓶内存有少量蒸馏水,但待测液的物质的量不变,消耗标准液的体积不变,B不会引起误差;锥形瓶不能用待测液润洗,否则会使测定结果偏高。
9.(2016·烟台检测)中和滴定是一种操作简单、准确度高的定量分析方法。实际工作中也可利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点。下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是A.用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度:KMnO4——浅红色B.利用a“Ag++SCN-===AgSCN↓”原理,可用标准KSCN溶液测量AgNO3溶 液浓度:Fe(NO3)3——红色C.利用“2Fe3++2I-===I2+2Fe2+”,用FeCl3溶液测量KI样品中KI的百分含量: 淀粉——蓝色D.利用OH-+H+===H2O来测量某盐酸的浓度时:酚酞——浅红色
滴定反应一旦开始就有I2生成,溶液就呈现蓝色,故无法判断终点。
10.向盛有10 mL NaOH溶液的烧杯中逐滴滴加稀盐酸,下列图像能够体现溶液pH变化情况的是
原溶液为NaOH溶液,pH>7,当向其中逐滴加入盐酸时,pH会减小,当接近中和反应终点时,pH突变,而后pH不断减小并趋于不变,本题选C。
11.如图曲线a和b是盐酸与氢氧化钠相互滴定的滴定曲线,下列叙述正确的是A.盐酸的物质的量浓度为1 ml·L-1B.P点时恰好完全反应,溶液呈中性C.曲线a是盐酸滴定氢氧化钠的滴定曲线D.酚酞不能用作本实验的指示剂
P点表示盐酸与氢氧化钠恰好完全中和,溶液呈中性,B正确。
12.(2016·安徽“江南十校”联考)常温下向25 mL 0.1 ml·L-1NaOH溶液中逐滴滴加0.2 ml·L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是A.水电离出的c(H+):A点小于B点B.在B点,离子浓度大小为c(OH-)>c(H+)> c(Na+)>c(N )C.在C点,滴加的V(HN3)=12.5 mLD.在D点,c(Na+)=2c(HN3)+2c(N )
叠氮酸HN3的Ka=10-4.7,说明HN3是一元弱酸。NaOH抑制水的电离,NaOH溶液的物质的量浓度:A点大于B点,则水电离出c(H+);A点小于B点,A项正确;B点溶液中,c(Na+)>c( )>c(OH-)>c(H+),B项错误;NaN3属于强碱弱酸盐,NaN3溶液因 发生水解而呈碱性,C点溶液呈中性,说明此时HN3过量,V(HN3)>12.5 mL,C项错误;D点溶液中,根据物料守恒,2c(Na+)=c( )+c( ),D项错误。
13.Ⅰ.现有常温下的六份溶液:①0.01 ml· L-1 CH3COOH溶液;②0.01 ml· L-1 HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 ml· L-1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 ml· L-1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。(1)其中水的电离程度最大的是____(填序号,下同),水的电离程度相同的是_______。
酸和碱都会抑制水的电离,故只有⑥(NaCl溶液)对H2O的电离无抑制作用。②③④对水的电离抑制程度相同。
(2)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②____(填“>”、“<”或“=”)③。
因pH=12的氨水中c(NH3·H2O)>0.01 ml·L-1,故②③混合,欲使pH=7,则需体积②>③。
(3)将六份溶液同等稀释10倍后,溶液的pH:①____②,③____④,⑤____⑥(填“>”、“<”或“=”)。
稀释同样的倍数后,溶液的pH:①>②;③>④;⑤>⑥。
(4)将①④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈____________(填字母)。A.酸性 B.碱性 C.中性
由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-), 仅知道c(CH3COO-)>c(H+),无法比较c(H+)与c(OH-)的相对大小,也就无法判断混合液的酸碱性,故选ABC。
Ⅱ.下表中是不同温度下水的离子积的数据:
试回答以下问题:(1)若25<t1<t2,则a_____(填“>”、“<”或“=”)1×10-14,作此判断的理由是_______________________________________。
温度升高,水的电离程度增大,离子积增大
升高温度,促进水的电离,水的离子积常数增大。
(2)25 ℃时,某Na2SO4溶液中c( )=5×10-4 ml·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
c(Na+)= =1.0×10-4 ml·L-1,而25 ℃时c(OH-)=1.0×10-7 ml·L-1,所以c(Na+)∶c(OH-)=(1.0×10-4 ml·L-1)∶(1.0×10-7 ml·L-1)=1 000∶1。
(3)在t2温度下测得某溶液pH=7,该溶液显____(填“酸”、“碱”或“中”)性。将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合。 ①若所得混合液呈中性,则a∶b=______。
t2温度下,pH=6的溶液呈中性,则pH=7的溶液显碱性。若所得混合液呈中性,即n(H+)=n(OH-),1×10-1 ml·L-1×b L= ml·L-1×a L,则a∶b=1∶1。












