





人教版 (新课标)选修2 化学与技术课题2 海水的综合利用备课ppt课件
展开第1课时 海水中盐的开发和利用
1.能说出海水晒盐的原理和工艺流程。2.会运用电解饱和食盐水的反应原理,能记住氯碱工业的工艺流程及产品。
一、海水制盐1.海水中盐的种类海水中含有多种盐类,主要是氯化钠、氯化镁、硫酸钙等,以氯化钠的含量最高。2.海水制盐的方法海水制盐的方法有蒸发法、电渗析法、冷冻法等,其中电渗析法和冷冻法在制盐的同时也可以得到淡水。
3.蒸发法目前,海水制盐的方法仍以蒸发法(即盐田法)为主。海水引入贮水池,待澄清后流入蒸发池,经过风吹、日晒,海水逐渐蒸发浓缩,达到饱和析出食盐晶体,分离后所得的母液叫苦卤。(1)海水晒盐的流程可表示如下:(2)苦卤是指分离食盐晶体后所得到的母液,主要成分是氯化钾、氯化镁等。
二、食盐资源的利用1.电解饱和食盐水的原理(1)饱和食盐水中的离子:存在Na+、Cl-、H+、OH-四种离子。通电后,Na+和H+向阴极移动,Cl-和OH-向阳极移动。
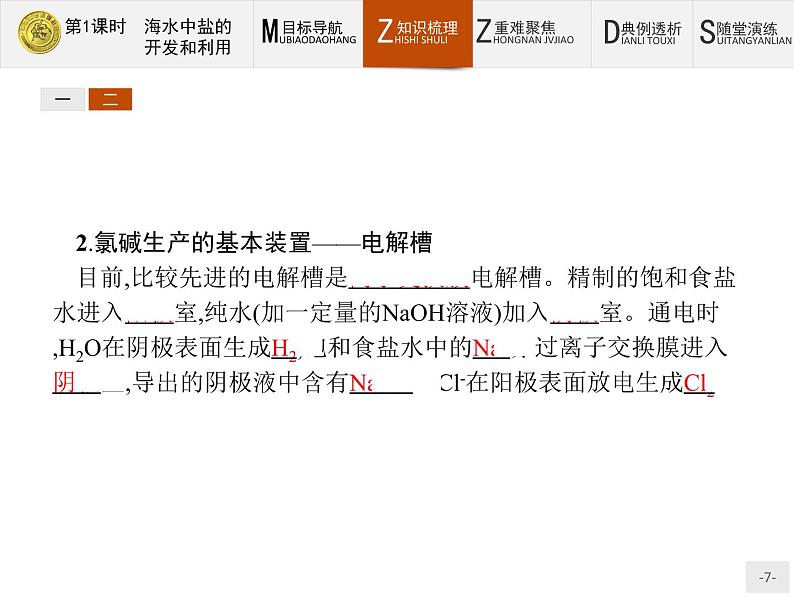
2.氯碱生产的基本装置——电解槽目前,比较先进的电解槽是离子交换膜电解槽。精制的饱和食盐水进入阳极室,纯水(加一定量的NaOH溶液)加入阴极室。通电时,H2O在阴极表面生成H2,饱和食盐水中的Na+穿过离子交换膜进入阴极室,导出的阴极液中含有NaOH。Cl-在阳极表面放电生成Cl2。
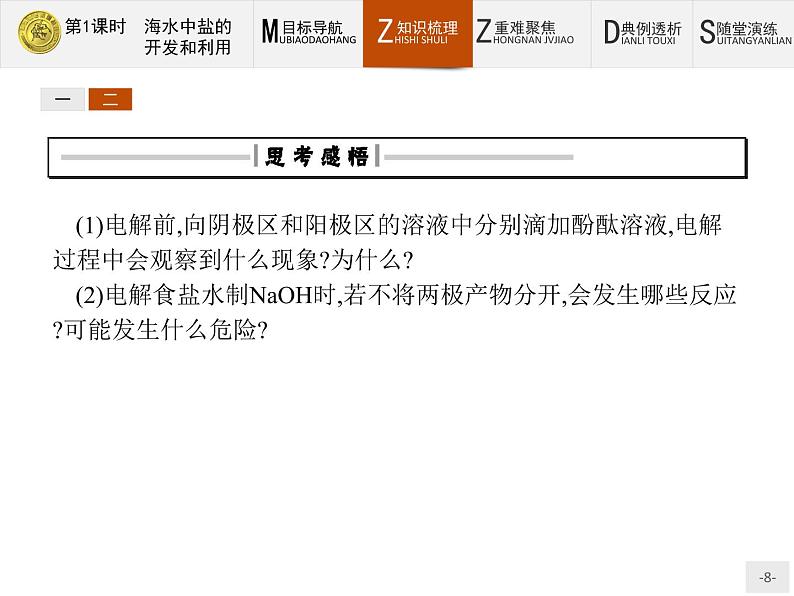
(1)电解前,向阴极区和阳极区的溶液中分别滴加酚酞溶液,电解过程中会观察到什么现象?为什么?(2)电解食盐水制NaOH时,若不将两极产物分开,会发生哪些反应?可能发生什么危险?提示:(1)阴极区溶液变为红色。由于H+被消耗,破坏了附近水的电离平衡,使OH-浓度增大,c(OH-)>c(H+),溶液呈碱性,即生成NaOH。
一、海水中盐的开发与利用1.海水制盐的方法(1)海水制盐常用的方法有三种,即蒸发法、电渗析法和冷冻法。(2)目前,由海水制食盐的方法主要是蒸发法(盐田法),即海水晒盐,其流程如下图:
(2)生产装置:离子交换膜电解槽主要由阳极(用金属钛网制成,涂有钛、钌等氧化物涂层)、阴极(由碳钢网制成,上面涂有镍涂层)、离子交换膜、电解槽框和导电铜棒等组成,每台电解槽由若干个单元槽串联或并联组成。
(3)主要生产过程:
二、离子交换膜法制烧碱1.离子交换膜法电解制碱的主要生产流程
2.离子交换膜法电解原理精制的饱和食盐水进入阳极室,加入NaOH的纯水进入阴极室,通电时,水在阴极表面放电生成H2,Na+穿过离子交换膜由阳极室进入阴极室,导出的阴极液中含NaOH,Cl-则在阳极表面放电生成Cl2,电解后的淡盐水从阳极导出。由电解槽流出的阴极液中含有30%的NaOH,称为液碱,液碱经蒸发、结晶可以得到固碱。阴极区的另一产物湿氢气经冷却、洗涤、压缩后被送往氢气贮柜;阳极区产物湿氯气经冷却、干燥、净化、压缩后可得到液氯。3.优点离子交换膜法制碱技术具有设备占地面积小、能连续生产、生产能力强、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业的发展方向。
特别提醒(1)离子交换膜的特征:只允许阳离子通过,且阻止阴离子和气体通过。(2)离子交换膜的作用:①可防止H2和Cl2混合发生爆炸;②防止Cl2与NaOH反应生成NaClO影响烧碱质量。(3)用惰性电极电解时,阳离子的放电顺序:Ag+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+(和金属活动性顺序刚好相反);阴离子的放电顺序:S2->I->Br->Cl->OH->含氧酸根离子。
【例题1】 目前,海水制盐的主要方法是( )A.分馏法B.蒸发法C.电渗析法D.电解法解析:蒸发法原理简单,操作易行,是海水制盐的主要方法。答案:B
【例题2】 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:依据上图完成下列填空:(1)在电解过程中,与电源正极相连的电极上所发生的反应为 ;与电源负极相连的电极附近,溶液pH (填“不变”“升高”或“下降”)。 (2)工业食盐含Ca2+、Mg2+等杂质,精制过程中这些离子发生反应的离子方程式为 。
(5)脱盐工序中利用NaOH和NaCl溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl。 (6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
1 2 3 4
1下列关于离子交换膜电解槽电解饱和食盐水的叙述不正确的是( )A.精制饱和食盐水注入阳极室B.Cl-和Na+透过阳离子交换膜进入阳极室C.阴极区溶液使酚酞溶液呈红色D.阳极产生使湿润的淀粉碘化钾试纸变蓝的气体解析:阳离子交换膜的功能是只允许阳离子通过而不允许阴离子通过,因此Cl-不能透过阳离子交换膜。答案:B
2NaCl是从海水中提取出来的一种重要物质,除了作调味品以外,它还是一种重要的化工原料。下列产品或物质能以NaCl为主要原料制取的是( )①金属钠 ②氯气 ③烧碱 ④盐酸 ⑤纯碱A.①②B.①②③C.①②③④D.①②③④⑤解析:电解熔融的氯化钠可制得金属钠和氯气;氯碱工业(电解饱和食盐水)可制得氯气、氢气和烧碱,进而可由氢气和氯气反应制得HCl,HCl溶于水即得盐酸;侯氏制碱法利用NaCl制取纯碱。答案:D
3下列关于“氯碱工业”的说法中,正确的是( )A.粗盐必须在净化后才能注入电解槽中电解B.电解时,阳极室产生Cl2和NaOH溶液,阴极室产生H2C.电解时,可用铁丝网作阳极,石墨作阴极D.电解槽中的离子交换膜可阻止水分子和离子通过解析:氯碱工业中,阳极必须用石墨,如果用铁丝网作阳极,铁会优先于Cl-放电,Fe-2e-Fe2+,不会生成Cl2;在阴极区H+放电,破坏了水的电离平衡,同时生成NaOH;电解槽中阳离子交换膜只允许阳离子通过而不允许阴离子通过。答案:A
4氢氧化钠是一种用途广泛的化工原料,我国氯碱工业的设备多采用离子交换膜电解槽。(1)为使电解NaCl溶液的速率加快,下列措施不可行的是 。 A.增大电极面积B.升高饱和NaCl溶液的温度C.加大阴极与阳极间的距离D.提高电解时的电源电压(2)如果将某离子交换膜电解槽①电解时的电压增大到原来的2倍;②电解时的电流增大到原来的2倍;③电解时温度从30 ℃提高到60 ℃,则电解速率一定会达到原来2倍的是 (填标号)。
高中化学第二节 烯烃 炔烃获奖ppt课件: 这是一份高中化学<a href="/hx/tb_c4002464_t3/?tag_id=26" target="_blank">第二节 烯烃 炔烃获奖ppt课件</a>,共17页。PPT课件主要包含了抗疫“明星”口罩,CH3-CH=CH2,制造口罩的原料之一,含有不饱和碳碳双键,官能团碳碳双键,单烯烃,通式为CnH2n,烯烃的结构,C杂化方式,sp2等内容,欢迎下载使用。
高中化学人教版 (新课标)选修2 化学与技术课题2 海水的综合利用复习ppt课件: 这是一份高中化学人教版 (新课标)选修2 化学与技术课题2 海水的综合利用复习ppt课件,共20页。PPT课件主要包含了获取纯净的水,海水的综合利用,氯碱工业,汽油C5C11,煤油C11C16,柴油C15C18,重油C20以上,减压蒸馏塔,催化裂化,石油气C4以下等内容,欢迎下载使用。
高中化学人教版 (新课标)选修2 化学与技术课题2 海水的综合利用课文内容ppt课件: 这是一份高中化学人教版 (新课标)选修2 化学与技术课题2 海水的综合利用课文内容ppt课件,共60页。PPT课件主要包含了特别提醒,石油的炼制,煤的综合利用等内容,欢迎下载使用。













