



高中化学鲁科版 (2019)选择性必修1第2节 化学能转化为电能——电池课文内容ppt课件
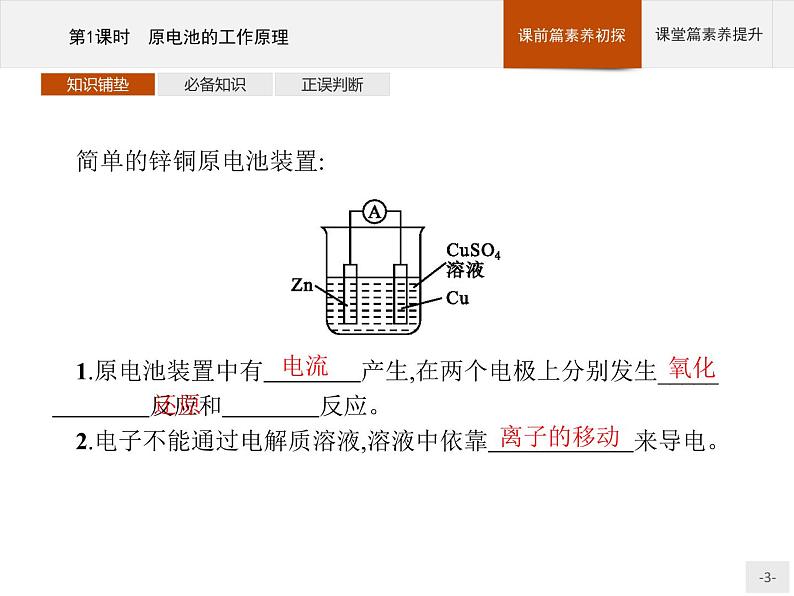
展开简单的锌铜原电池装置:1.原电池装置中有 产生,在两个电极上分别发生_____ 反应和 反应。 2.电子不能通过电解质溶液,溶液中依靠 来导电。
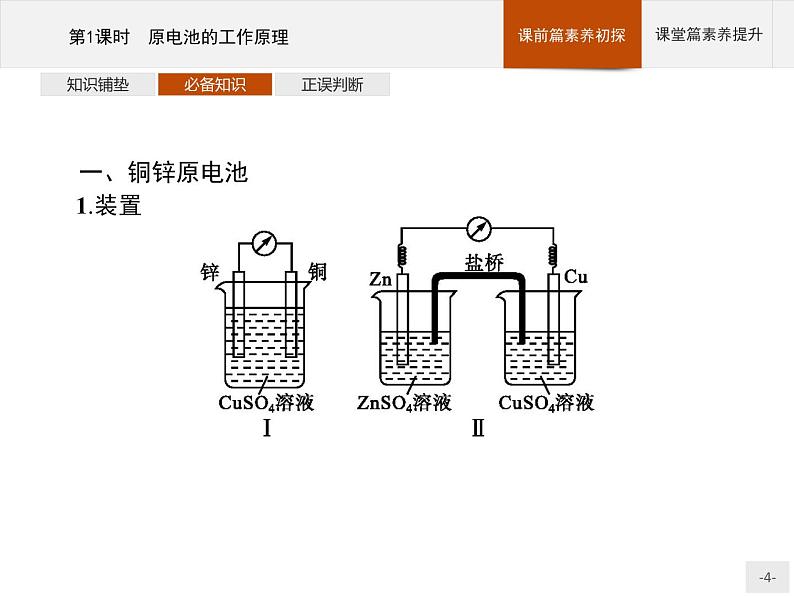
一、铜锌原电池1.装置
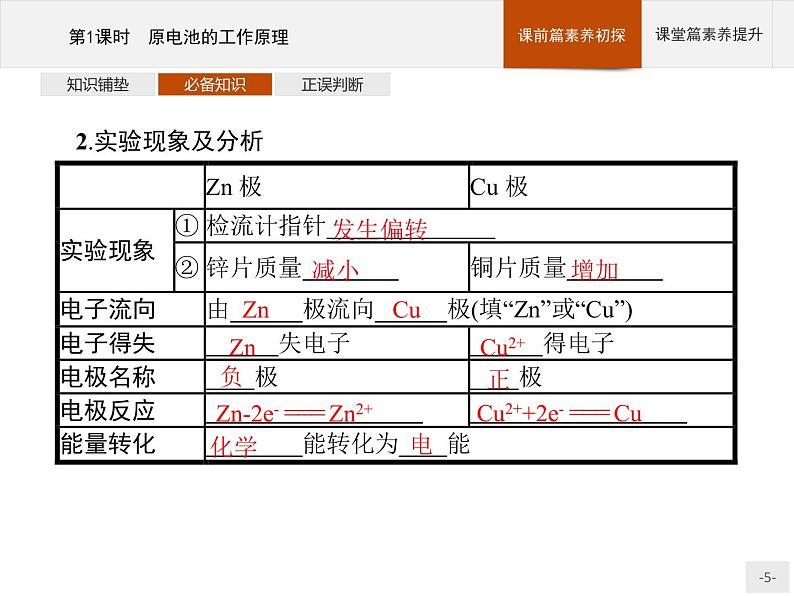
Zn-2e- === Zn2+
Cu2++2e- === Cu
二、原电池的工作原理1.原电池的定义:把 转变为 的装置。 2.原电池的构成条件
3.原电池的工作原理(1)电极。①负极: 电子,发生 反应; ②正极: 电子,发生 反应。 (2)电子定向移动方向和电流方向。①电子从 流出经外电路流入 ; ②电流从 流出经外电路流入 ;故电子定向移动方向与电流方向正好相反。 (3)离子移动方向。电解质溶液中阴离子向 移动,阳离子向 移动。
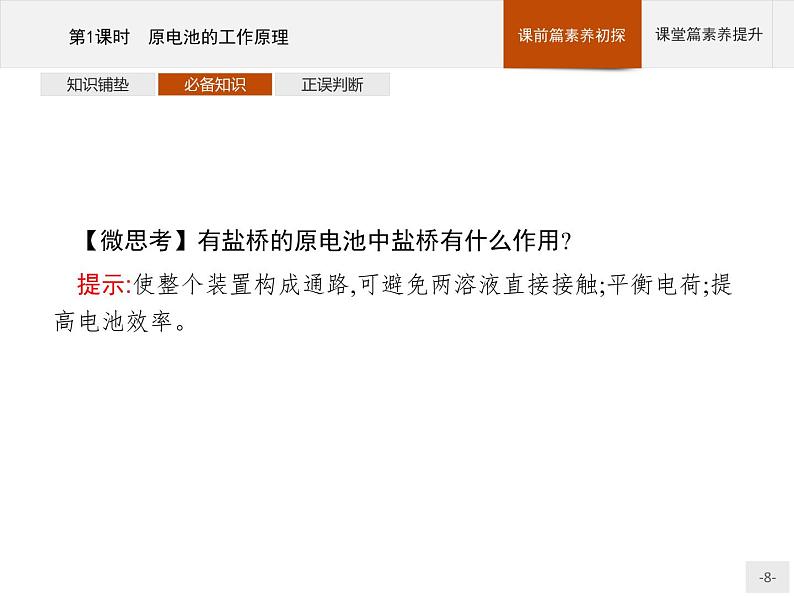
【微思考】有盐桥的原电池中盐桥有什么作用?
提示:使整个装置构成通路,可避免两溶液直接接触;平衡电荷;提高电池效率。
判断下列说法是否正确,正确的打“√”,错误的打“×”。(1)理论上说,任何自发的氧化还原反应都可设计成原电池。 ( )(2)在原电池中,发生氧化反应的一极一定是负极。( )(3)用Mg、Al分别作为电极,用NaOH溶液作为电解液构成的原电池,Mg为正极。( )(4)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动。( )(5)一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率高。( )(6)原电池放电时,外电路中电流由负极流向正极。( )(7)由于反应CaO+H2O === Ca(OH)2可以自发进行,且放出大量的热,故可以设计成原电池。( )
原电池的工作原理及电极反应问题探究用葡萄发电让闹钟正常工作的实验中,工作原理是什么呢?你能用日常生活中的东西设计原电池吗?
提示:葡萄发电类似意大利科学家伏特发明的伏特电池,能产生电流让闹钟正常工作。生活中的苹果、西红柿等都可以设计原电池。
深化拓展1.原电池正、负极的判断【微点拨1】原电池的正极和负极既与电极材料的性质有关,又与电解质溶液有关,不要认为活泼性强的金属一定是作为负极。
【微点拨2】原电池中微粒移动方向(1)电子移动方向:从负极流出沿导线流入正极,电子不能通过电解质溶液。(2)若有盐桥,盐桥中的阴离子移向负极区,阳离子移向正极区。(3)若有交换膜,离子可选择性通过交换膜,如阳离子交换膜,阳离子可通过阳离子交换膜移向正极。
素能应用典例1分析下图所示的四个原电池装置,其中结论正确的是( )A.①②中Mg是负极,③④中Fe是负极B.②中Mg是正极,电极反应为6H2O+6e- === 6OH-+3H2↑C.③中Fe是负极,电极反应为Fe-2e- === Fe2+D.④中Cu是正极,电极反应为2H++2e- === H2↑
答案:B 解析:②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应失去电子,故Al是负极;③中Fe在浓硝酸中钝化,Cu和浓硝酸反应失去电子,因此Cu是负极,A、C错误;②中正极反应为6H2O+6e- === 6OH-+3H2↑,B正确;④中Cu是正极,电极反应为O2+2H2O+4e- === 4OH-,D错误。
规律方法 (1)电极反应的书写方法。
(2)复杂电极反应的书写。复杂电极反应=总反应-较简单一极的电极反应如CH4酸性燃料电池中,电极反应为:CH4+2O2 === CO2+2H2O……总反应2O2+8H++8e-=== 4H2O……正极反应CH4+2H2O-8e- === CO2+8H+……负极反应
变式训练1如图所示,X为单质硅,Y为金属铁,a为NaOH溶液,组装成一个原电池,回答下列问题。(1)正极是 (填名称,下同)发生 反应,电极反应为 。 (2)负极是 ,发生 反应,电极反应为 。 (3)电池总反应为 。
原电池原理的应用问题探究1.若纯锌与粗锌(含Fe、C等)分别与同浓度的稀硫酸反应制取H2,哪种方法产生H2的速率快? 2.将金属a、b用导线相连插入稀硫酸中,发现金属b上产生气泡,则金属a与金属b相比较,谁更活泼?
深化拓展1.加快氧化还原反应的速率一个自发进行的氧化还原反应,形成原电池时会使反应速率加快。例如,在Zn与稀硫酸反应时加入少量CuSO4溶液,Zn可置换出Cu,Cu能与Zn形成原电池使产生H2的反应速率加快。2.比较金属活动性强弱如有两种金属A和B,用导线将A和B连接后,插入到稀硫酸中,一段时间后,若观察到A溶解,而B上有气体放出,则说明A是负极,B是正极,即可以断定金属活动性:A>B。
实例:根据反应Cu+2Ag+ === Cu2++2Ag设计电池:
素能应用典例2根据反应2FeCl3+Fe === 3FeCl2设计一个原电池。要求:(1)画出此原电池的装置图,装置采用烧杯和盐桥。(2)注明原电池的正、负极和外电路中电子的流向。
解析:将题给反应拆成两个半反应:Fe-2e- === Fe2+(氧化反应),2Fe3++2e- === 2Fe2+(还原反应)。负极发生氧化反应,电极材料应选参加反应的单质Fe,正极发生还原反应,电极材料应选比铁不活泼的金属或石墨等导体。负极电解质溶液选不能与铁反应的FeCl2溶液,正极电解质溶液选与铁能反应的FeCl3溶液。
变式训练2-1X、Y、Z、W四块金属板分别用导线两两相连浸入稀硫酸中构成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断四种金属的活动性顺序是( )A.X>Z>W>Y B.Z>X>Y>W C.X>Y>Z>W D.Y>W>Z>X
答案:A 解析:在原电池中,活泼金属作为原电池的负极,失去电子发生氧化反应;不活泼的金属或非金属导体作为原电池的正极,阳离子或氧气等在正极得到电子发生还原反应。电子由负极经导线流向正极,与电流的方向相反。因此,X、Y相连时,X为负极,则活动性X>Y;Z、W相连时,电流方向是W→Z,则活动性Z>W;X、Z相连时,Z极上产生大量气泡,则活动性X>Z;W、Y相连时,W极发生氧化反应,则活动性W>Y。综上所述,可以得出金属的活动性顺序:X>Z>W>Y。
变式训练2-2等质量的两份锌粉a、b,分别加入过量的稀硫酸中,同时向a中滴入少量的CuSO4溶液,如图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
答案:D 解析:a中Zn与CuSO4溶液反应置换出Cu,Zn的量减少,产生H2的量减少,但Zn、Cu和稀硫酸形成原电池,反应速率加快,D项图示符合要求。
1.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有KNO3-琼脂的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )①在外电路中,电流由铜电极流向银电极 ②正极反应为Ag++e- === Ag ③实验过程中取出盐桥,原电池仍继续工作 ④将铜片浸入AgNO3溶液中发生的化学反应与该原电池的总反应相同A.①② B.②③ C.②④ D.③④
答案:C 解析:铜片、银片、Cu(NO3)2溶液、AgNO3溶液及盐桥构成一个原电池,Cu是负极,Ag是正极,其电极反应分别为负极:Cu-2e- === Cu2+,正极:2Ag++2e- === 2Ag,盐桥起到了传导离子、形成闭合回路的作用,电子的流向是由负极经导线流向正极,电流的方向与电子的流向相反,因此C正确。
2.下列关于原电池的叙述正确的是( )A.构成原电池的两极必须是两种不同金属B.原电池是将化学能转化为电能的装置C.原电池工作时总是负极溶解,正极上有物质析出D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原
答案:B 解析:构成原电池的正极材料只要导电即可,可以是非金属如石墨等,A错误;对于燃料电池,电极不参与反应,C、D错误。
3.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是( )A.铜电极上发生氧化反应B.电池工作一段时间后,甲池的c( )减小C.电池工作一段时间后,乙池溶液的总质量增加D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
答案:C 解析:由于锌的活泼性比铜强,则铜电极为正极,在正极上Cu2+得电子发生还原反应生成Cu,A项错误;由于阳离子交换膜只允许阳离子和水分子通过,故甲池的c( )不变,B项错误;在乙池中Cu2++2e- === Cu,同时甲池中的Zn2+通过阳离子交换膜进入乙池中,由于M(Zn2+)>M(Cu2+),故乙池溶液的总质量增加,C项正确;阳离子交换膜允许阳离子通过,电解过程中Zn2+通过阳离子交换膜移向正极保持溶液中电荷平衡,阴离子是不能通过阳离子交换膜的,D项错误。
4.利用反应Cu+2FeCl3 === CuCl2+2FeCl2设计一个原电池,正极为 ,电极反应为 ;负极为 ,电极反应为 ;电解质溶液是 。
答案:Pt(或C) 2Fe3++2e- === 2Fe2+ Cu Cu-2e- === Cu2+ FeCl3溶液 解析:根据已知的氧化还原反应设计原电池。首先将已知的反应拆成两个半反应(即氧化反应和还原反应):Cu-2e- === Cu2+,2Fe3++2e- === 2Fe2+;然后结合原电池的电极反应特点分析可知,该电池的负极应该用Cu作为材料,正极要保证Fe3+得到负极失去的电子,一般用不能还原Fe3+的材料,如Pt或碳棒等,电解质溶液只能是含Fe3+的电解质溶液,如FeCl3溶液等。
鲁科版 (2019)选择性必修1第2节 化学能转化为电能——电池说课课件ppt: 这是一份鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002574_t3/?tag_id=26" target="_blank">第2节 化学能转化为电能——电池说课课件ppt</a>,共22页。PPT课件主要包含了电解质溶液,原电池的工作原理,还原反应,氧化反应,原电池的形成条件,原电池的应用,设计原电池,原电池正负极的判断,活泼的金属,阳离子移向等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 原电池课堂教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 原电池课堂教学课件ppt,共36页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1章 化学反应与能量转化第2节 化学能转化为电能——电池评课课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1章 化学反应与能量转化第2节 化学能转化为电能——电池评课课件ppt,共41页。PPT课件主要包含了分点突破1,原电池的工作原理,分点突破2,原电池原理的应用,关键能力培养,探究与创新能力等内容,欢迎下载使用。













