

2020版高考一轮复习化学新课改省份专用学案:第十章第3课时 实验方法(1)——物质的分离与提纯
展开第3课时 实验方法(1)——物质的分离与提纯
知识点一 物质分离、提纯常用的物理方法
1.混合物的分离是根据混合物中各组分的物理性质或化学性质的差异,通过一定的物理变化或化学变化将混合物分成各组分的纯净物。
2.混合物的提纯是根据混合物中各组分的物理性质或化学性质的差异,通过一定的物理变化或化学变化将混合物中的杂质除去。
分离和提纯的要求不同,设计操作步骤时一定要加以区别。
3.提纯的“四个原则”及“四个必须”
(1)“四个原则”
一是不增加新的杂质;二是不减少被提纯物质;三是被提纯物质与杂质易分离;四是被提纯物质易复原。
(2)“四个必须”
一是除杂试剂必须过量;二是过量试剂必须除尽;三是除杂途径必须最佳;四是除去多种杂质时必须考虑加入试剂的先后顺序。
1.常用装置
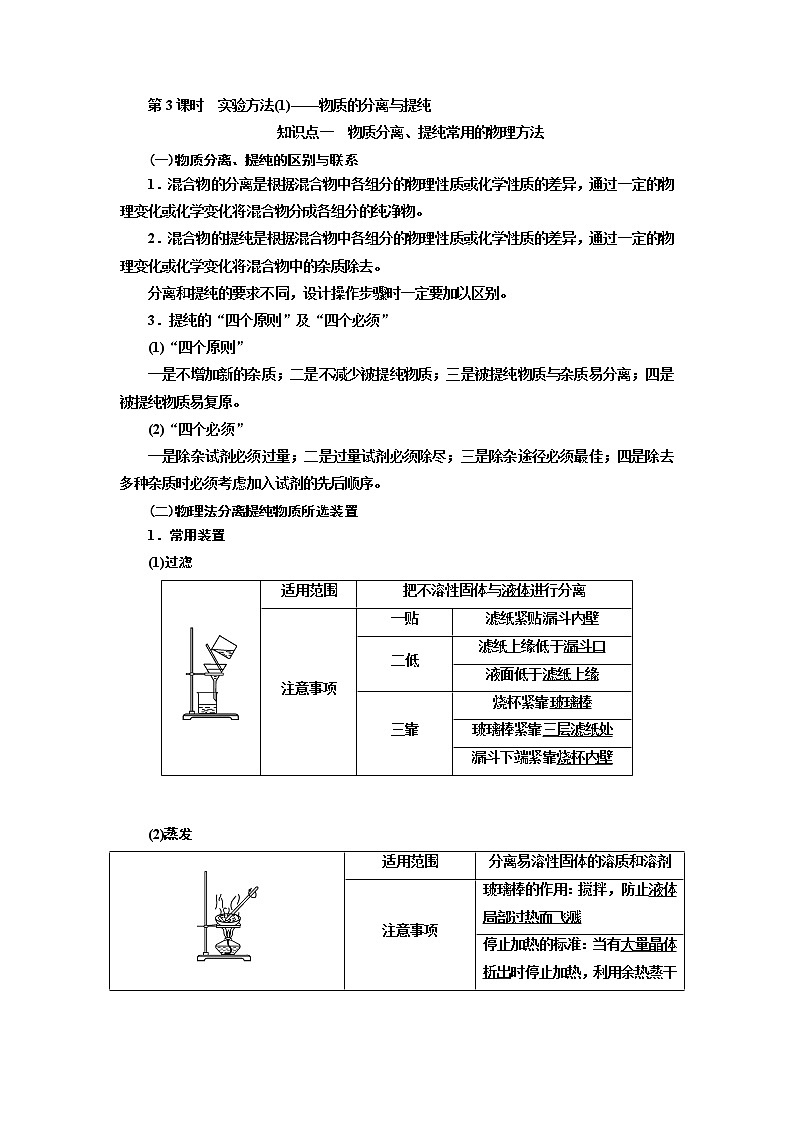
(1)过滤
适用范围 | 把不溶性固体与液体进行分离 | ||
注意事项 | 一贴 | 滤纸紧贴漏斗内壁 | |
二低 | 滤纸上缘低于漏斗口 | ||
液面低于滤纸上缘 | |||
三靠 | 烧杯紧靠玻璃棒 | ||
玻璃棒紧靠三层滤纸处 | |||
漏斗下端紧靠烧杯内壁 | |||
(2)蒸发
适用范围 | 分离易溶性固体的溶质和溶剂 | |
注意事项 | 玻璃棒的作用:搅拌,防止液体局部过热而飞溅 | |
停止加热的标准:当有大量晶体析出时停止加热,利用余热蒸干 |
(3)萃取和分液
适用范围 | 萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来 | |
分液:分离两种互不相溶且易分层的液体 | ||
注意事项 | ①溶质在萃取剂中的溶解度比在原溶剂中大 ②萃取剂与原溶剂不反应、不相溶 ③萃取剂与溶质不反应 ④常用的萃取剂是苯或CCl4,一般不用酒精作萃取剂 |
(4)蒸馏
适用 范围 | 分离沸点相差较大且互溶的液体混合物 | |
注意事项 | 温度计的水银球在蒸馏烧瓶的支管口处 | |
蒸馏烧瓶中要加沸石或碎瓷片,目的是防止暴沸 | ||
冷凝管水流方向为口进,口出 |
(5)升华
适用 范围 | 某种组分易升华的混合物,利用物质升华的性质在加热条件下分离的方法 | |
注意 事项 | 如NaCl固体中的I2可用该方法,但NH4Cl固体中的I2不能用升华的方法分离 |
2.创新装置
(1)过滤装置的创新——抽滤
由于水流的作用,使装置a、b中气体的压强减小,故使过滤速率加快 |
(2)蒸馏装置的创新
由于冷凝管竖立,使液体混合物能冷凝回流,若以此容器作反应容器,可使反应物能循环利用,提高了反应物的转化率 |
1.“固+固”混合物的分离(提纯)
2.“固+液”混合物的分离(提纯)
3.“液+液”混合物的分离(提纯)
[对点训练]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)过滤时,为加快过滤速度,可用玻璃棒搅拌漏斗中液体(×)
(2)蒸发操作时,应使混合物中的水分完全蒸干后,再停止加热(×)
(3)根据食用油和汽油的密度不同,可选用分液的方法分离(×)
(4)用乙醇萃取出溴水中的溴,再用蒸馏的方法分离溴与乙醇(×)
(5)蒸馏时温度计的水银球应插入液体中(×)
(6)蒸馏中,冷却水应从冷凝管的下口通入,上口流出(√)
(7)利用加热的方法分离NH4Cl和I2的固体混合物(×)
(8)提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法(×)
2.(2018·浙江11月选考)下列图示与操作名称不对应的是( )
解析:选A A选项表示加热液体,升华为加热固体,图示与操作名称不对应。
3.下列实验中,所选装置不合理的是( )
A.分离Na2CO3溶液和CH3COOC2H5,选④
B.用CCl4提取碘水中的碘,选③
C.用FeCl2溶液吸收Cl2,选⑤
D.粗盐提纯,选①和②
解析:选A CH3COOCH2CH3难溶于Na2CO3溶液,二者会分层,可以用分液法分离,选择③,A错误;用CCl4萃取碘水中的碘,选择③,B正确;⑤可以用作洗气瓶,也可用作FeCl2溶液吸收Cl2的装置,C正确;粗盐提纯需要过滤、蒸发结晶,选择①和②,D正确。
4.物质的分离提纯操作包括:过滤、蒸馏、分液、结晶(重结晶)、盐析等,选择合适的操作名称填空:
(1)除去Ca(OH)2溶液中悬浮的 CaCO3________。
(2)从碘水中提取碘________。
(3)用自来水制取蒸馏水________。
(4)分离植物油和水________。
(5)从鸡蛋清溶液中提取蛋白质________。
(6)除去KNO3晶体中混有的少量NaCl________。
答案:(1)过滤 (2)萃取、分液 (3)蒸馏 (4)分液
(5)盐析、过滤 (6)重结晶
知识点二 物质分离、提纯常用的化学方法
1.常见气体的除杂方法
气体(括号内为杂质) | 除杂试剂 | 化学方程式或原理 |
C2H2(H2S) | CuSO4溶液 | H2S+CuSO4===CuS↓+H2SO4 |
H2(NH3) | 浓硫酸 | NH3+H2SO4===NH4HSO4 |
Cl2(HCl) | 饱和NaCl 溶液 | HCl极易溶于水,Cl2在饱和NaCl溶液中的溶解度小 |
CO2(HCl) | 饱和NaHCO3 溶液 | HCl+NaHCO3===NaCl+H2O+CO2 |
SO2(HCl) | 饱和NaHSO3 溶液 | HCl+NaHSO3===NaCl+H2O+SO2 |
CO2(SO2) | 饱和NaHCO3 溶液 | SO2+2NaHCO3===Na2SO3+H2O+2CO2 |
CO2(CO) | 灼热CuO | CO+CuOCu+CO2 |
CO(CO2) | NaOH浓溶液 | CO2+2NaOH===Na2CO3+H2O |
N2(O2) | 灼热铜网 | 2Cu+O22CuO |
CH4(CH2===CH2、 CHCH) | 溴水 | CH2===CH2+Br2―→CH2BrCH2Br HCCH+2Br2―→ CHBr2—CHBr2 |
2.常见固体或溶液的除杂方法
物质(括号内为杂质) | 除杂试剂或方法 | 化学方程式或原理 | 分离方法 |
Na2CO3固体 (NaHCO3) | 加热 | 2NaHCO3Na2CO3+H2O+CO2↑ | — |
NaCl溶液 (Na2SO4) | 加适量 BaCl2溶液 | Na2SO4+BaCl2===BaSO4↓+2NaCl | 过滤 |
NaCl固体 (NH4Cl) | 加热 | NH4ClNH3↑+HCl↑ | — |
FeCl2溶液 (FeCl3) | 加过量铁粉 | 2FeCl3+Fe===3FeCl2 | 过滤 |
FeCl3溶液 (FeCl2) | 通Cl2 | 2FeCl2+Cl2===2FeCl3 | — |
NaHCO3溶液 (Na2CO3) | 通CO2 | Na2CO3+CO2+H2O===2NaHCO3 | — |
Cu(NO3)2溶 液(AgNO3) | 加过量铜粉 | 2AgNO3+Cu===Cu(NO3)2+2Ag | 过滤 |
I2(SiO2) | 加热 | I2升华、冷却、凝华,得I2 | — |
Fe2O3 (Al2O3) | 加过量 NaOH溶液 | Al2O3+2NaOH===2NaAlO2+H2O | 过滤 |
NH4Cl溶液 (FeCl3) | 加适量氨水 | FeCl3+3NH3·H2O=== Fe(OH)3↓+3NH4Cl | 过滤 |
KNO3固体 (NaCl) | 水 | 根据二者的溶解度随温度的变化不同 | 降温 结晶 |
NaCl溶液 (MgCl2) | 加适量 NaOH溶液 | MgCl2+2NaOH=== Mg(OH)2↓+2NaCl | 过滤 |
C(CuO) | 加过量 稀盐酸 | CuO+2HCl===CuCl2+H2O | 过滤 |
CuO(Fe) | 磁铁 | Fe能被磁铁吸引 | — |
CuS(FeS) | 加过量 稀盐酸 | FeS+2HCl===FeCl2+H2S↑ | 过滤 |
镁粉 (铝粉) | 加过量 NaOH溶液 | 2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑ | 过滤 |
3.物质分离、提纯常用的化学方法
方法 | 原理 | 杂质成分 |
沉淀法 | 将杂质离子转化为沉淀 | Cl-、SO、CO及能形成弱碱的阳离子 |
气化法 | 将杂质离子转化为气体 | CO、HCO、SO、HSO、S2-、NH |
杂转 纯法 | 将杂质转化为需要提纯的物质 | 杂质中含不同价态的相同元素(用氧化剂或还原剂)、同一种酸的正盐与酸式盐(用对应的酸或碱) |
氧化 还原法 | 用氧化剂(还原剂)除去具有还原性(氧化性)的杂质 | 如用酸性KMnO4溶液除去CO2中的SO2,用灼热的铜网除去N2中的O2 |
热分 解法 | 加热使不稳定的物质分解除去 | 如除去NaCl中的NH4Cl等 |
酸碱 溶解法 | 利用物质与酸或碱溶液反应的差异进行分离 | 如用过量的NaOH溶液可除去Fe2O3中的Al2O3 |
电解法 | 利用电解原理除去杂质 | 含杂质的金属(M)作阳极、纯金属(M)作阴极,含M的盐溶液作电解质溶液 |
调pH法 | 加入试剂调节溶液pH使溶液中某种成分生成沉淀而分离 | 如向含有Cu2+和Fe3+的溶液中加入CuO、Cu(OH)2或Cu2(OH)2CO3等,调节pH使Fe3+转化为Fe(OH)3而除去 |
[对点训练]
1.(2019·深圳三校第一次联考)除去下列物质中所含的杂质,选用的试剂正确的是( )
选项 | 物质(杂质) | 试剂 |
A | Al2O3(SiO2) | NaOH溶液 |
B | CO2(SO2) | Na2CO3溶液 |
C | FeCl2溶液(FeCl3) | Fe粉 |
D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 |
解析:选C 因Al2O3和SiO2均与NaOH溶液反应,不能选择NaOH溶液来除杂,可选盐酸溶解后过滤,最后滤液通过蒸发、灼烧得Al2O3,故A错误;CO2和SO2均与Na2CO3溶液反应,达不到除杂的目的,可选饱和NaHCO3溶液利用洗气法除杂,故B错误;Fe不与FeCl2溶液反应,与FeCl3溶液反应生成FeCl2,除去杂质FeCl3且不引入新的杂质,故C正确;NaHCO3和Na2CO3均与Ca(OH)2溶液反应,达不到除杂的目的,可通入足量的二氧化碳来除杂,故D错误。
2.(2018·浙江4月选考)下列操作或试剂的选择不合理的是( )
A.可用蒸发结晶的方法从碘水中提取碘单质
B.可用灼烧法除去氧化铜中混有的铜粉
C.可用硫酸鉴别碳酸钠、硅酸钠和硫酸钠
D.可用含氢氧化钠的氢氧化铜悬浊液鉴别乙醇、乙醛和乙酸
解析:选A 从碘水中提取碘单质应用萃取的方法。
3.某硝酸钠固体中混有少量硫酸铵和碳酸氢钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
选择试剂 | ① | Na2CO3溶液 | ④ |
实验操作 | ② | ③ | 加热 |
下列试剂或操作不合理的是( )
A.试剂①为Ba(OH)2溶液 B.操作②为结晶
C.操作③为过滤 D.试剂④为稀HNO3
解析:选B 选择Ba(OH)2溶液除去SO、NH和HCO,NH3·H2O通过加热除去,操作②为加热。过量的Ba2+用Na2CO3溶液除去,过量的OH-和CO用硝酸除去,则操作③为过滤,试剂④为HNO3。
4.下列有关说法正确的是( )
A.分离Fe2O3、Al2O3的操作依次为溶解、过滤、灼烧
B.蒸馏、过滤、分液、洗气四种分离物质的方法,均不可能发生化学变化
C.通入过量CO2可除去NaHCO3溶液中的杂质Na2CO3
D.向MgCl2溶液中加入CaCO3粉末,充分搅拌后过滤可除去杂质FeCl3
解析:选C 若用过量NaOH溶解Fe2O3、Al2O3的混合物,过滤后可得到Fe2O3和NaAlO2溶液,NaAlO2溶液通过灼烧无法得到Al2O3,同理分析可知用过量的酸溶解上述混合物也无法经题述三步操作得到两种氧化物,A错误;洗气可能发生化学变化,B错误;在溶液中Na2CO3与CO2反应可得到NaHCO3,C正确;虽然CaCO3粉末可促使Fe3+水解彻底形成Fe(OH)3沉淀,但又会引入新杂质Ca2+,D错误。








