化学人教版 (新课标)第三章 水溶液中的离子平衡综合与测试教案及反思
展开(教师用书备选)
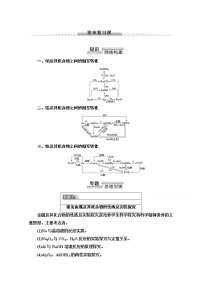
溶液中水的电离分析 |
(1)溶液中水电离的定量计算
①酸溶液:c(H+)H2O=c(OH-)H2O=c(OH-);
②碱溶液:c(OH-)H2O=c(H+)H2O=c(H+);
③水解呈酸性的盐溶液:c(H+)H2O=c(OH-)H2O=c(H+);
④水解呈碱性的盐溶液:c(OH-)H2O=c(H+)H2O=c(OH-)。
(2)酸、碱反应过程中某些性质的变化(以氨水中滴加盐酸为例)
⇒
1.已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO。某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。下列对该溶液的叙述不正确的是 ( )
A.该温度高于25 ℃
B.由水电离出来的H+的浓度为1×10-10 mol·L-1
C.加入NaHSO4晶体抑制水的电离
D.取该溶液加水稀释100倍,溶液中的水电离出的c(H+)减小
D [A项,Kw=1×10-6×1×10-6=1×10-12,温度高于25 ℃;B、C项,NaHSO4电离出的H+抑制H2O电离,c(H+)H2O=c(OH-)=1×10-10 mol·L-1;D项,加H2O稀释,c(H+)减小,H+对H2O电离的抑制减小,c(H+)H2O增大。]
2.常温下,在20 mL a mol·L-1盐酸中滴加a mol·L-1 MOH(一元碱)溶液,混合溶液中由水电离的c(H+)与MOH溶液体积的关系如图所示。下列说法正确的是( )
A.a=0.01
B.Y点溶液中:c(M+)=c(Cl-)>c(H+)=c(OH-)
C.微热Z点对应的溶液,溶液的pH增大
D.若R点时V[MOH(aq)]=x mL,则常温下MOH的电离常数Kb=
D [Z点对应溶液中水的电离程度最大,则Z点时酸和碱恰好定全反应:MOH+HCl===MCl+H2O,又水电离的c(H+)大于10-7 mol·L-1,说明MOH是弱碱。Y点对应的溶液中溶质是MCl和HCl,溶液呈酸性,Z点之后继续加入MOH溶液,R点对应的溶液呈中性。A项,X点对应的溶液为a mol·L-1盐酸,c(H+)==0.1 mol·L-1,c(HCl)=0.1 mol·L-1,错误;B项,Y点对应的溶液呈酸性,则c(Cl-)>c(M+),c(H+)>c(OH-),错误;C项,Z点对应的溶液呈酸性,加热时M+的水解程度增大,溶液酸性增强,pH减小,错误;D项,R点对应的溶液中c(MOH)=×a mol·L-1,c(M+)=×a mol·L-1,c(H+)=c(OH-)=1×10-7 mol·L-1,Kb==,正确。]
滴定曲线有关的定量分析 |
(1)分析步骤:首先看纵坐标,搞清楚是酸加入碱中,还是碱加入酸中;其次看起点,起点可以看出酸性或碱性的强弱;再次找滴定终点和pH=7的中性点,判断滴定终点的酸碱性,然后确定中性点(pH=7)的位置;最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。
(2)滴定过程中的定量关系:①电荷守恒关系在任何时候均存在;②物料守恒可以根据加入酸的物质的量和加入碱的物质的量进行确定,但不一定为等量关系。
3.常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00 mL 0.10 mol·L-1HCl溶液和20.00 mL 0.10 mol·L-1CH3COOH溶液,得到两条滴定曲线,如图所示,则下列说法正确的是( )
图1 图2
A.图2是滴定盐酸的曲线
B.a与b的关系是a<b
C.E点对应离子浓度由大到小的顺序可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.这两次滴定都应选用甲基橙作为指示剂
C [A项,开始时,HCl溶液的pH较小,错误;B项,a点的V(X)=20 mL,b点的V(X)<20 mL,故a>b,错误;D项,NaOH溶液滴定CH3COOH溶液,终点为碱性,应选用酚酞作指示剂,错误。]
4.室温下,将0.10 mol·L-1盐酸滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积的变化曲线如图所示。已知pOH=-lg c(OH-),下列说法正确的是( )
A.M点所示溶液中c(NH)+c(NH3·H2O)=c(Cl-)
B.N点所示溶液中c(NH)>c(Cl-)
C.Q点消耗盐酸的体积等于氨水的体积
D.M点和N点所示溶液中水的电离程度相同
D [横轴表示所加盐酸的体积,纵轴表示pH、pOH,pH越小溶液酸性越强,pOH越小溶液碱性越强,故M点所在曲线表示pH变化曲线,N点所在曲线表示pOH变化曲线。由图像可知,Q点溶液呈中性,M点溶液的溶质为NH4Cl、NH3·H2O,溶液显碱性;N点溶液中含有NH4Cl,可能含有HCl,溶液显酸性。分析图像可知,M点溶液的溶质为NH4Cl、NH3·H2O,结合物料守恒可知:c(NH)+c(NH3·H2O)>c(Cl-),A项错误;N点溶液显酸性,则c(H+)>c(OH-),根据电荷守恒,有:c(NH)+c(H+)=c(Cl-)+c(OH-),所以c(NH)<c(Cl-),B项错误;盐酸和氨水恰好完全反应得到的NH4Cl溶液呈酸性,Q点溶液呈中性,则Q点氨水过量,C项错误;M点溶液显碱性,pH=a,则由水电离的c(H+)=10-a mol·L-1,N点溶液显酸性,pOH=a,则由水电离的c(H+)=c(OH-)=10-a mol·L-1,故M点和N点所示溶液中水的电离程度相同,D项正确。]
中和滴定的拓展应用 |
【典例】 利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。
取0.009 500 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O+6I-+14H+===3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O===S4O+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液________________________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为________%(保留1位小数)。
[解析] 利用I2遇淀粉溶液显蓝色来判断滴定终点时,当溶液蓝色褪去,且半分钟内不恢复即可说明达到滴定终点。根据题中反应可得:Cr2O~3I2~6S2O,则1.200 0 g样品中含有Na2S2O3·5H2O的质量=××248 g·mol-1=1.140 g,样品纯度=×100%=95.0%。
[答案] 蓝色褪去,且半分钟内不恢复蓝色 95.0%
5.测定K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)中铁的含量。
(1)称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是________。
(2)向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________。
[解析] (1)KMnO4能将样品溶液中Fe2+氧化成Fe3+,将C2O氧化成CO2,达到滴定终点时,KMnO4稍过量,溶液中出现粉红色。(2)加入过量锌粉能将溶液中Fe3+还原为Fe2+,酸化后Fe2+与KMnO4溶液反应,根据化合价变化可找出关系式为5Fe2+~MnO,根据消耗KMnO4溶液的浓度和体积可知溶液中n(Fe2+)=c mol·L-1×V×10-3 L×5=5×10-3 cV mol,则该晶体中铁元素的质量分数为×100%或×100%。
[答案] (1)粉红色出现 (2)×100%
选修4 化学反应原理第二章 化学反应速率和化学平衡综合与测试教学设计: 这是一份选修4 化学反应原理第二章 化学反应速率和化学平衡综合与测试教学设计,共9页。
高中化学人教版 (新课标)选修4 化学反应原理第一章 化学反应与能量综合与测试教案及反思: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第一章 化学反应与能量综合与测试教案及反思,共4页。
人教版 (新课标)必修1第四章 非金属及其化合物综合与测试教案设计: 这是一份人教版 (新课标)必修1第四章 非金属及其化合物综合与测试教案设计,共6页。