

- (新教材)2019-2020学年鲁科版化学必修第二册教师用书:第3章第1节课时1 认识有机化合物的性质和结构特点 其他 0 次下载
- (新教材)2019-2020学年鲁科版化学必修第二册教师用书:第2章第3节课时1 化学反应的快慢 其他 0 次下载
- (新教材)2019-2020学年鲁科版化学必修第二册教师用书:第1章第3节课时2 研究同主族元素的性质和预测元素及其化合物的性质 其他 0 次下载
- (新教材)2019-2020学年鲁科版化学必修第二册教师用书:第2章第3节课时2 化学反应的限度 其他 0 次下载
- (新教材)2019-2020学年鲁科版化学必修第二册教师用书:第2章第2节课时1 化学反应中能量变化的本质及转化形式 其他 0 次下载
鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律第2节 化学反应与能量转化教案
展开目标与素养:1.理解原电池的构成和工作原理,知道如何设计原电池。(科学探究)2.了解常见的化学电源。(社会责任)
一、初识氢氧燃料电池
负极反应:2H2-4e-===4H+。
正极反应:O2+4e-+4H+===2H2O。
总反应方程式:2H2+O2===2H2O。
此装置中的能量变化:化学能转化为电能。
稀硫酸的作用:传导电荷,导线的作用:传导电子。
二、设计原电池(以Zn+2H+===Zn2++H2↑为例)
1.设计思路
Zn为还原剂,金属锌可作为负极反应物;H+为氧化剂,可作为正极反应物,由稀盐酸或稀硫酸作为电解质溶液提供,正极材料应选不与H+直接发生反应的导体充当,如金属铜、石墨等。
2.实验装置示意图
现象:铜片上有气泡产生,锌片不断溶解,电流表指针偏转。
结论:导线中有电流通过,此装置中化学反应由化学能转化为电能。
三、原电池
1.概念:利用氧化还原反应将化学能直接转化成电能的装置。
2.构成条件
理论上,自发的氧化还原反应均可设计构成原电池。
具体条件是(1)具有活动性不同的两个电极(金属与金属或金属与能导电的非金属);
(2)溶液:两电极均插入电解质溶液中;
(3)导线:两极用导线相连,形成闭合回路。
3.常见电池
(1)干电池:又称一次电池,如锌锰电池。
(2)充电电池:又称二次电池,如铅蓄电池。
(3)燃料电池的优点:其能量转换效率高,对环境无污染。
微点拨:(1)原电池中电极不一定参加化学反应,如氢氧燃料电池中电极不参加反应。
(2)金属K、Na、Ca活泼性强,不作原电池电极。
1.判断正误(正确的打“√”,错误的打“×”)
(1)原电池是电能转化为化学能的装置。( )
(2)将铜片和锌片用导线连接插入酒精中,电流表指针发生偏转。( )
(3)原电池中外电路中的电子的流向是由正极流向负极。( )
(4)原电池工作时,负极发生氧化反应。( )
(5)蓄电池是常见的一次电池。( )
[答案](1)× (2)× (3)× (4)√ (5)×
2.关于化学反应中的能量变化,下列说法不正确的是( )
A.化学反应中的能量变化,除热能之外,还可以是光能、电能
B.化学反应中的能量变化,服从能量守恒定律
C.燃料电池工作时,化学能转变为电能
D.在一个确定的化学反应中,反应物的总能量总是高于生成物的总能量
D [在吸热反应中反应物的总能量低于生成物的总能量,在放热反应中反应物的总能量高于生成物的总能量。]
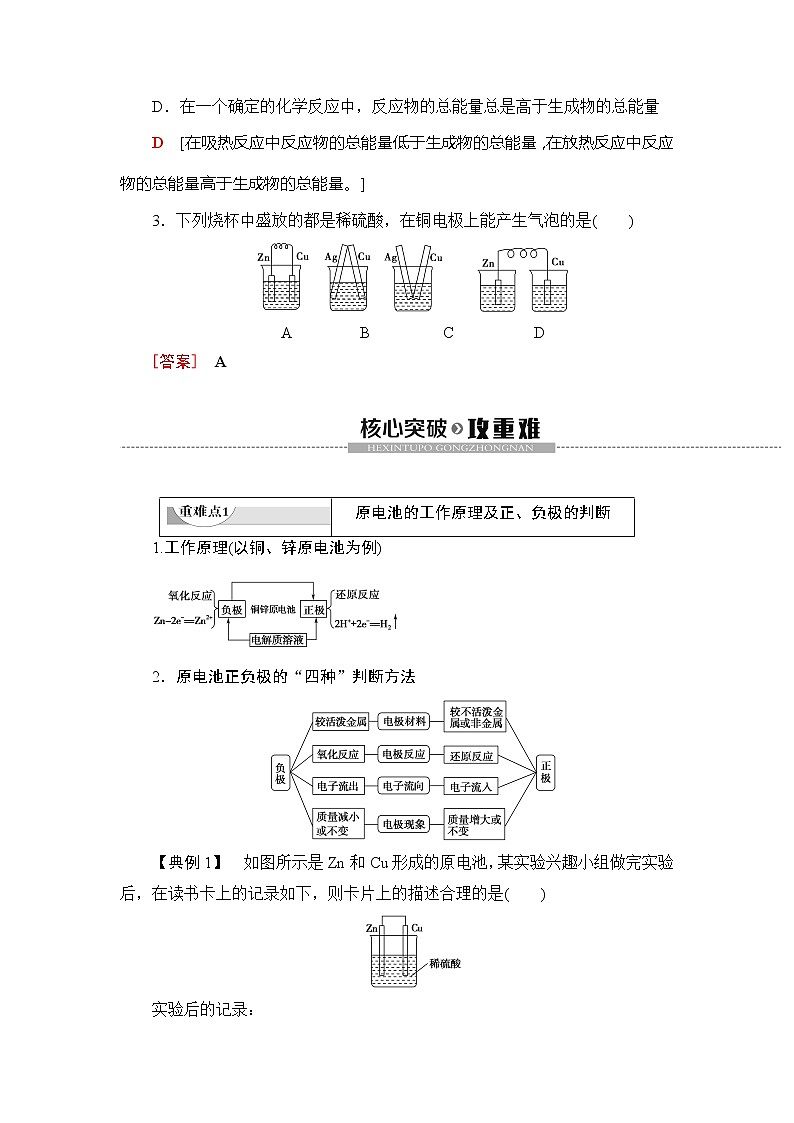
3.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( )
A B C D
[答案] A
1.工作原理(以铜、锌原电池为例)
2.原电池正负极的“四种”判断方法
【典例1】 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SOeq \\al(2-,4)向Cu极移动
④若有0.5 ml电子流经导线,则可产生0.25 ml气体
⑤电子的流向是Cu→Zn
⑥正极反应式:Cu—2e-===Cu2+,发生氧化反应
A.①②③ B.②④
C.②③④ D.③④⑤
B [铜、锌形成原电池的时候,锌是负极,铜为正极;锌失去电子生成锌离子进入溶液中,电子通过外电路流向正极,溶液中的氢离子在正极上得到电子,生成氢气,发生还原反应;阳离子向正极移动,所以阴离子硫酸根离子向负极移动;若有0.5 ml电子流经导线,由于正极的电极反应式为2H++2e-===H2↑,所以会产生0.25 ml氢气;电子的流向是由负极流向正极,所以应该是由Zn→Cu;正极反应式是2H++2e-===H2↑,发生还原反应。]
1.有关原电池的下列说法中正确的是( )
A.在外电路中电子由正极流向负极
B.在原电池中负极发生还原反应
C.原电池工作时,阳离子向正极方向移动
D.原电池中正极一定是不活泼金属
C [在原电池外电路中,电子从负极流向正极;原电池中负极发生氧化反应;随着反应的进行,阳离子在正极被还原,所以电解质溶液中的阳离子向正极移动;原电池中一般正极金属比负极金属活泼性差,但不一定是不活泼金属,故选C。]
1.加快化学反应速率
实验室用锌和稀硫酸反应制备氢气时,常用粗锌,产生氢气的速率更快。原因是粗锌中的杂质和锌、稀硫酸构成原电池,电子定向移动,加快了锌与硫酸反应的速率。
2.比较金属的活泼性
一般情况下,在原电池中,负极金属的活泼性比正极金属的活泼性强。
3.设计原电池
(1)首先将氧化还原反应分成两个半反应。
(2)根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。
【典例2】 根据下列事实:
①X+Y2+===X2++Y;
②Z+2H2O(冷)===Z(OH)2+H2↑;
③Z2+氧化性比X2+弱;
④由Y、W电极组成的电池,电极反应为W2++2e-===W、Y-2e-===Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为( )
A.X>Z>Y>W B.Z>W>X>Y
C.Z>Y>X>W D.Z>X>Y>W
D [由①得还原性:X>Y;由②知单质Z能与冷水反应,Z为活泼的金属单质;由③得还原性:Z>X;由④得还原性:Y>W,则有还原性Z>X>Y>W。]
(1)上题中④原电池的电池总反应为
。
(2)上题中①中的反应若设计成原电池,则负极是 。
[答案](1)W2++Y===Y2++W。
(2)X。
2.利用生活或实验室中的常用物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。填写下列空白:
(1)实验原理:Fe+2H+===Fe2++H2↑。
(2)实验用品:电极( 、 )、稀硫酸、 、 (填写所缺的实验用品)、耳机(或者电流表)。
(3)实验装置(如图)。
(4)原理分析。
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓”的声音。其原因是在原电池中,由化学能转化为 。
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的 极,电极反应: ;另一极应该接电流表的 极,电极发生了 反应。
[解析] 原电池的构成条件是电极、导线、电解质溶液。负极应用铁钉或铁条,正极可选铜棒、铜钉或石墨(如铅笔芯)等,电解质溶液盛放在烧杯中,原电池是将化学能转化为电能的装置,电流表的负极应与电源负极相连,负极发生氧化反应,正极发生还原反应。
[答案] (2)铁钉(或铁条) 铜钉(其他的惰性电极如铅笔芯、铂等) 烧杯 导线
(4)①电能 ②负 Fe-2e-===Fe2+ 正 还原
1.在理论上不能用于设计原电池的化学反应是( )
A.HCl+NaOH===NaCl+H2O
B.2CH3OH+3O2―→2CO2+4H2O
C.4Fe(OH)2+2H2O+O2===4Fe(OH)3
D.2H2+O2===2H2O
A [原电池的化学反应原理是自发的氧化还原反应,有电子的转移,而A项中的反应是中和反应,没有电子的转移,故选A项。]
2.已知空气锌电池的电极反应为锌电极:Zn+2OH--2e-===ZnO+H2O;石墨电极:eq \f(1,2)O2+H2O+2e-===2OH-。可以判断石墨电极是( )
A.负极,发生还原反应 B.正极,发生氧化反应
C.负极,发生氧化反应 D.正极,发生还原反应
D [空气锌电池中,失去电子的一极是负极,发生氧化反应,得到电子的一极是正极,发生还原反应。]
3.在盛有稀硫酸的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SOeq \\al(2-,4)浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
D [本题符合铜锌原电池的形成条件,原电池工作时,电子由负极(锌)经外电路(导线)流向正极(铜)。负极锌片:Zn-2e-===Zn2+;正极铜片:2H++2e-===H2↑,总反应为Zn+2H+===Zn2++H2↑,原电池中没有O2产生。没有参与反应的SOeq \\al(2-,4),浓度不会逐渐增大。]
4.某原电池的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池正确的组成是( )
C [离子方程式中Zn失电子生成Zn2+,故Zn为负极。Cu2+得电子生成Cu,故含Cu2+的溶液为电解质溶液。]
5.分别按图甲、乙所示装置进行实验,两个烧杯中的溶液为同浓度的稀硫酸,甲中A为电流表。请回答下列问题:
甲 乙
(1)下列叙述正确的是 。
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片作正极,乙中铜片作负极
C.两烧杯中溶液的H+浓度均减小
D.甲产生气泡的速率比乙的慢
(2)甲装置中的能量转化形式: 能转化为 能,乙装置中的能量转化形式: 能转化为 能。
(3)某同学发现甲装置中不仅铜片上有气泡产生,且锌片上也产生了气泡,原因可能是 。
(4)在甲装置中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应 。
[解析](1)甲装置为原电池,乙中Zn与稀硫酸接触反应;甲装置中铜片作正极,H+在铜片上得电子被还原为H2,形成原电池后产生气泡的速率比乙装置中产生气泡的速率快;随着两烧杯溶液中H+不断被消耗,溶液中的H+浓度均减小。(2)甲装置中,锌、铜及稀硫酸形成原电池,是将化学能转化为电能,乙装置主要是锌与稀硫酸反应,该反应是将化学能转化为热能。(3)锌片上产生气泡,原因可能是锌片不纯,锌与杂质形成原电池。(4)若将稀硫酸换成CuSO4溶液,则铜片上会析出Cu。
[答案](1)C (2)化学 电 化学 热 (3)锌片不纯,锌与杂质形成原电池 (4)Cu2++2e-===Cu
原电池的工作原理及正、负极的判断
原电池原理的应用
选项
正极
负极
电解质溶液
A
Cu
Zn
HCl
B
Zn
Cu
CuSO4
C
Cu
Zn
CuSO4
D
Cu
Zn
ZnCl2
高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用教学设计: 这是一份高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用教学设计,共10页。教案主要包含了乙酸的物理性质与分子结构,乙酸的化学性质等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用教案设计: 这是一份高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用教案设计,共8页。教案主要包含了乙醇的物理性质与分子结构,乙醇的化学性质和用途等内容,欢迎下载使用。
化学必修 第二册第3章 简单的有机化合物第3节 饮食中的有机化合物教学设计: 这是一份化学必修 第二册第3章 简单的有机化合物第3节 饮食中的有机化合物教学设计,共8页。教案主要包含了化学反应速率,影响化学反应速率的因素,溶剂等内容,欢迎下载使用。













