

广西南宁市第二中学2020届高三下学期模拟考试理综试题
展开广西南宁市第二中学2020届高三下学期
模拟考试理综化学试题
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 F 19 Na 23 Al 27 Si 28
S 32 Cl 35.5 K 39 Mn 55 Fe 56 Cu 64 As 75 Se 79 Br 80 Ag 108 I 127
7.下列有关资源开发和利用的说法正确的是
A.海水制盐后可以利用氯碱工业,电解饱和食盐水制备金属钠
B.海带中的碘是以I-形式存在,向浸泡过海带灰的水中滴加淀粉,有蓝色出现
C.将生活垃圾分类回收,加工、使之再生、再利用,对废旧金属进行回收利用就是保护金属资源的途径之一
D.工业上对煤进行干馏、液化和气化等物理方法处理,目的是降低污染和获得更多化工原料
8.我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
下列说法不正确的是
A.异戊二烯所有碳原子可能共平面
B.可用溴水鉴别M和对二甲苯
C.对二甲苯的一氯代物只有 2种
D.M的某种同分异构体含有苯环且能与钠反应放出氢气
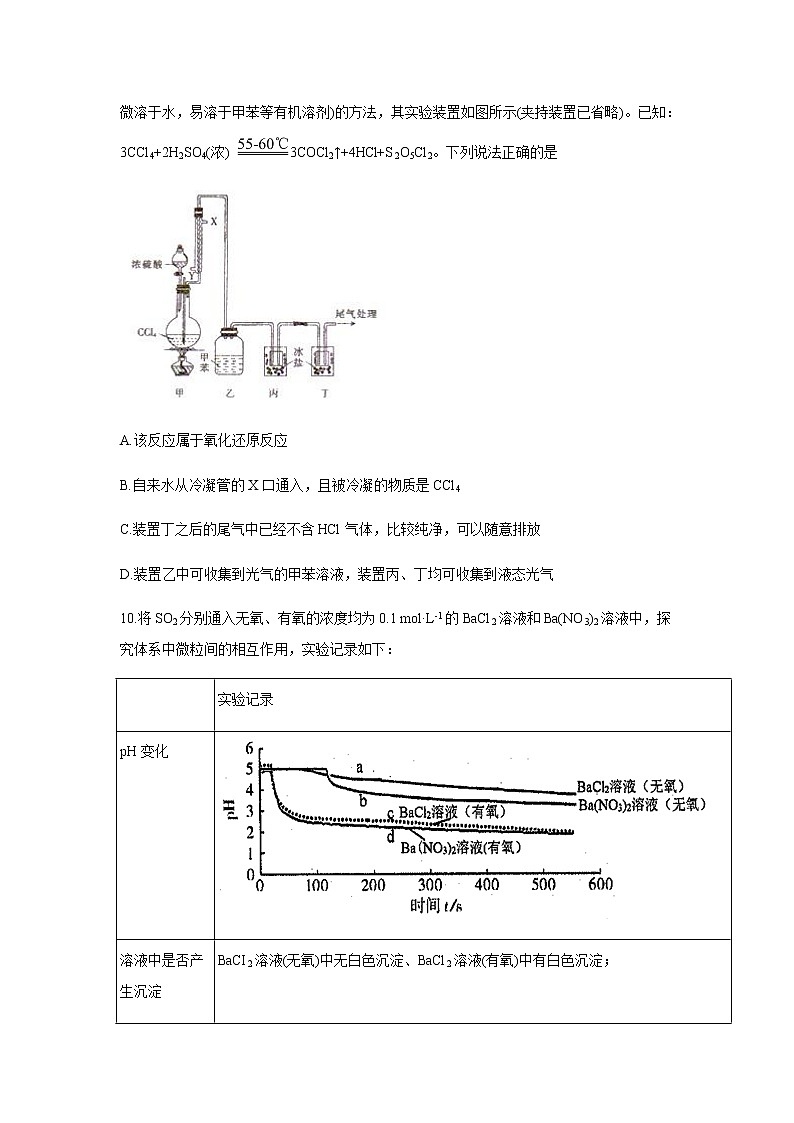
9.《战争的气体化学和分析》 中介绍了一种制取COC12(光气,熔点为-118℃,沸点为8.2℃,微溶于水,易溶于甲苯等有机溶剂)的方法,其实验装置如图所示(夹持装置已省略)。已知:3CCl4+2H2SO4(浓) 3COCl2↑+4HCl+S2O5Cl2。下列说法正确的是
A.该反应属于氧化还原反应
B.自来水从冷凝管的X口通入,且被冷凝的物质是CCl4
C.装置丁之后的尾气中已经不含HCl气体,比较纯净,可以随意排放
D.装置乙中可收集到光气的甲苯溶液,装置丙、丁均可收集到液态光气
10.将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的BaCl2溶液和Ba(NO3)2溶液中,探究体系中微粒间的相互作用,实验记录如下:
| 实验记录 |
pH变化 | |
溶液中是否产生沉淀 | BaCI2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀; Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
下列说法不正确的是
A.曲线a所示溶液pH降低的原因:SO2+H2OH2SO3H++HSO3-
B.曲线c所示溶液中发生反应:2Ba2++O2+2SO2+2H2O=2BaSO4↓+4H+
C.与曲线a、b、c对比,可知曲线d所表示的过程中NO3-是氧化SO2的主要微粒
D.依据该实验预测0.2 mol/L的KNO3溶液(无氧)也可以氧化SO2
11.常温时,把浓度为0.1 mol·L-1盐酸分别滴加到浓度为0.1 mol·L-1 的MOH 和NOH两种一元碱,所得到滴定曲线如图所示,下列说法正确的是
A. Kb(NOH)≈10-21
B.碱性:MOH>NOH,且两次滴定时均可用酚酞作为指示剂
C.滴定NOH,当加入盐酸体积为10 mL时,溶液中必有:c(Cl-)+c(OH-)=c(H+)+c(N+)
D.当两溶液均恰好滴定完全时,两溶液的pH一定相等
12.以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是
A.该电池下方是负极,发生氧化反应
B.若以甲烷为燃料气时,负极反应式为CH4+5O2--8e-=CO32-+2H2O
C.该电池使用过程中需补充Li2CO3和K2CO3
D.空气极发生的电极反应式为:O2+4e-+2CO2 =2CO32-
13.新冠肺炎疫情牵动人心,化学在对抗疫情中起到重要作用。已知短周期主族元素W、X、Y、Z的原子序数依次增大,W的最外层电子数等于电子层数等于原子序数,W与X形成的一种原子数比为1:1的液体是强力的氧化剂可用于杀菌消毒,YZX的水溶液是84消毒液的主要成分,Z的单质是一种黄绿色气体。下列说法不正确的是
A. X没有最高正价,但是有正价
B.W与X形成的化合物中绝对不含非极性共价键
C.Y单质的还原性是短周期里最强的
D.Z最高价氧化物水化物是一种具有强氧化性的强酸
26.二氯化二硫(S2Cl2)是一 种黄红色液体, 有刺激性、窒息性恶臭。生产中使用它作橡胶的低温硫化剂和黏结剂。向熔融的硫中通入限量氯气即可生成S2Cl2,进一步氯化可得SCl2。S2Cl2、 SCl2的某些性质如下表所示:
| 水溶性 | 密度(g/cm3) | 熔点 | 沸点 |
S2Cl2 | 空气中发烟雾,遇水即水解 | 1.687 | -76 ℃ | 138℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | -122 ℃ | 59 ℃ |
实验室可用如图所示装置制备少量S2Cl2。请回答下列问题:
(1)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式为___________。
(2)从上图所示装置中选用某一装置制取Cl2,发生反应的离子方程式为_________________。
(3)欲得到较纯净的S2Cl2,上述仪器装置的连接顺序为:e→___→___→___→___→___→___→a→b→___→___(按气流方向填小写字母代号)。
(4)仪器D的名称是_______,D中碱石灰的作用是__________________________。
(5)为了获得更纯净的S2Cl2,需要对产品进行的操作是_________________。
(6)若将S2Cl2放入水中同时产生黄色沉淀和无色刺激性气味气体,写出反应的化学方程式:______________________________;该反应中被氧化和被还原的元素的质量之比为_______。
27. (14 分)细菌冶金是近年来新兴的绿色冶金工艺,它主要是应用细菌法溶浸贫矿、废矿、尾矿和炉渣等,以回收某些贵重有色金属和稀有金属,节约矿产资源,最大限度地利用矿藏的一种冶金方法。其中细菌治铜的生产流程为:
(1)上述生产流程中有三步用到了同一种分离方法,实验室中不能用这种分离方法来分离液态胶体中分散质的原因是_____________________________。
(2)绿矾(FeSO4·7H2O)是一种良好的还原剂,也可用来制取治疗缺铁性贫血的药剂和食品调味剂。在保存绿矾时,必须__________。在溶液B中加入适量(NH4)2SO4固体,加热浓缩时,可以得到(NH4)2Fe(SO4)4· 6H2O的原因是________________________________________。
(3)溶液B中一定含有的金属阳离子是_______________。若在溶液A中不加足量而加入少量铁屑,只会发生一个反应。则此反应的平衡常数的表达式为______________。
(4)写出黄铜矿中的CuS·FeS在氧化亚铁硫杆菌和稀硫酸作用下被空气氧化生成溶液A的离子方程式:___________________________________________。
(5)氧化亚铜可用作船底防污漆,以杀死低级海生动物而保护船体,也可用作陶瓷和搪瓷的着色剂和红色玻璃的染色剂,氧化亚铜也是一种重要的半导体材料。请用浓的强碱溶液,根据反应2Cu+H2OCu2O+H2↑,设计出工业生产氧化亚铜的一 种方法:
(只要求画实验装置图,其他必要材料任选)。
28. (14 分) CO是水煤气的主要成份之一,是一种无色剧毒气体,根据信息完成下列各题。
I、已知下列热化学方程式:
2C(s) +O2(g)= 2CO(g) △H = -221 kJ/mol
C(s) + O2(g)= CO2(g) △H = -393 kJ/mol
(1)24 g单质碳在不足量的O2中燃烧时,生成等物质的量的CO和CO2气体,则和24 g单质碳完全燃烧生成CO2相比较,损失热量_________kJ。
II、850℃时,在10 L体积不变的容器中投入2 mol CO和3 mol H2O,发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g),当CO的转化率达60%时,反应达平衡。
(2) 850℃时,该反应的平衡常数为_____________________。
(3)该条件下,将CO和H2O都改为投入2 mol, 达平衡时,H2的浓度为________mol/L,下列情况能说明该反应一定达平衡的是__________。
A.CO和H2O蒸气的浓度之比不再随时间改变
B.气体的密度不再随时间改变
C.CO和CO2的浓度之比不再随时间改变
D.气体的平均摩尔质量不再随时间改变
III、(4)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:
①在阳极区发生的反应包括________________和 H++HCO3-=CO2↑+H2O
②简述CO32-在阴极区再生的原理:_____________________________________。
(5)含硫各微粒(H2SO3、 HSO3- 和SO32- )存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图所示
下列说法正确的是____________(填标号)。
A. pH=7时,溶液中c( Na+)<c (HSO3- )+c(SO32-)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的NaHSO3,应将溶液的pH控制在4~5为宜
D. pH=9时溶液中c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
35.【化学--选修 3:物质结构与性质】(15分)
镓(Ga)、锗(Ge)、 硅(Si)、 硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]___________;与硒同周期的p区元素中第一电离能大于硒的元素有_______种;SeO3的空间构型是____________。
(2)根据元素周期律,原子半径Ga_______As,第一电离能Ga_______As。(填“大于”或“小于”)。
(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是________。硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等, 与氯、溴结合能形成SiCl4、SiBr4, 上述四种物质沸点由高到低顺序为_____________,丁硅烯(Si4H8)中σ键与π键个数之比为__________。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因___________________________。
| GaN | GaP | GaAs |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(5)GaN晶胞结构如图1所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。
①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为______________;
②从GaN晶体中“分割”出的平行六面体如图2。若该平行六面体的体积为cm3,GaN晶体的密度为_______g/cm3(用a、NA表示)。
36.【化学---选修 5:有机化学基础】(15分)
香料甲和G都在生活中有很多用途,其合成路线如下:
已知:①R1-CHO+R2-CH2-CHO (R1、R2代表烃基或氢原子)
②D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39。
(1)A的名称是______, G中含氧官能团的名称是_____________。
(2)②的反应类型是______,B和F的结构简式分别为______________、_____________。
(3)写出一种能鉴别A和D的试剂_________ ;C有多种同分异构体,其中属于芳香族化合物的有_____________种。
(4)写出反应①的化学方程式:__________________________。
(5)G的同分异构体是一种重要的药物中间体,其合成路线与G相似,请以为原料设计它的合成路线(其他所需原料自选)。____________________。








