

2021版高考化学一轮复习课时跟踪检测(十八)常见无机物的转化(含解析)新人教版
展开课时跟踪检测(十八)常见无机物的转化
1.下列物质的转化在给定条件下能实现的是( )
A.NaCl(aq)NaHCO3(s)Na2CO3(s)
B.CuCl2Cu(OH)2Cu
C.AlNaAlO2(aq)NaAlO2(s)
D.MgO(s)Mg(NO3)2(aq)Mg(s)
解析:选C A项,NaCl溶液中通入CO2不能生成NaHCO3,错误;B项,Cu(OH)2与葡萄糖反应生成Cu2O,不是Cu,错误;C项,Al和NaOH溶液反应生成NaAlO2和H2,加热NaAlO2溶液可以得到NaAlO2固体,正确;D项,制取金属镁应该电解熔融MgCl2,电解Mg(NO3)2溶液不能生成金属镁,错误。
2.甲、乙、丙三种物质有如图转化关系:甲乙丙甲,则甲不可能是( )
A.Al2O3 B.NH4Cl
C.CO2 D.SiO2
解析:选B A项,若甲为Al2O3,则Al2O3与NaOH溶液反应生成NaAlO2(乙),NaAlO2与适量盐酸反应生成Al(OH)3(丙),灼烧Al(OH)3可得Al2O3;B项,若甲为NH4Cl,则NH4Cl与NaOH溶液反应后生成NH3·H2O(乙),NH3·H2O与盐酸反应又生成NH4Cl(甲),不符合题图转化关系;C项,若甲为CO2,则CO2与足量NaOH溶液反应生成Na2CO3(乙),Na2CO3中加入少量盐酸,可生成NaHCO3(丙),加热NaHCO3可得到CO2;D项,若甲为SiO2,则SiO2与NaOH溶液反应生成Na2SiO3(乙),Na2SiO3中加入盐酸可得H2SiO3(丙),加热H2SiO3可得SiO2。
3.下列各组物质中,不是按(“―→”表示一步完成)关系相互转化的是( )
选项 | A | B | C | D |
a | Fe | NaOH | Al(OH)3 | HNO3 |
b | FeCl3 | Na2CO3 | NaAlO2 | NO |
c | FeCl2 | NaCl | Al2O3 | NO2 |
解析:选C C项,NaAlO2不能直接转化为Al2O3,Al2O3也无法一步转化为Al(OH)3。
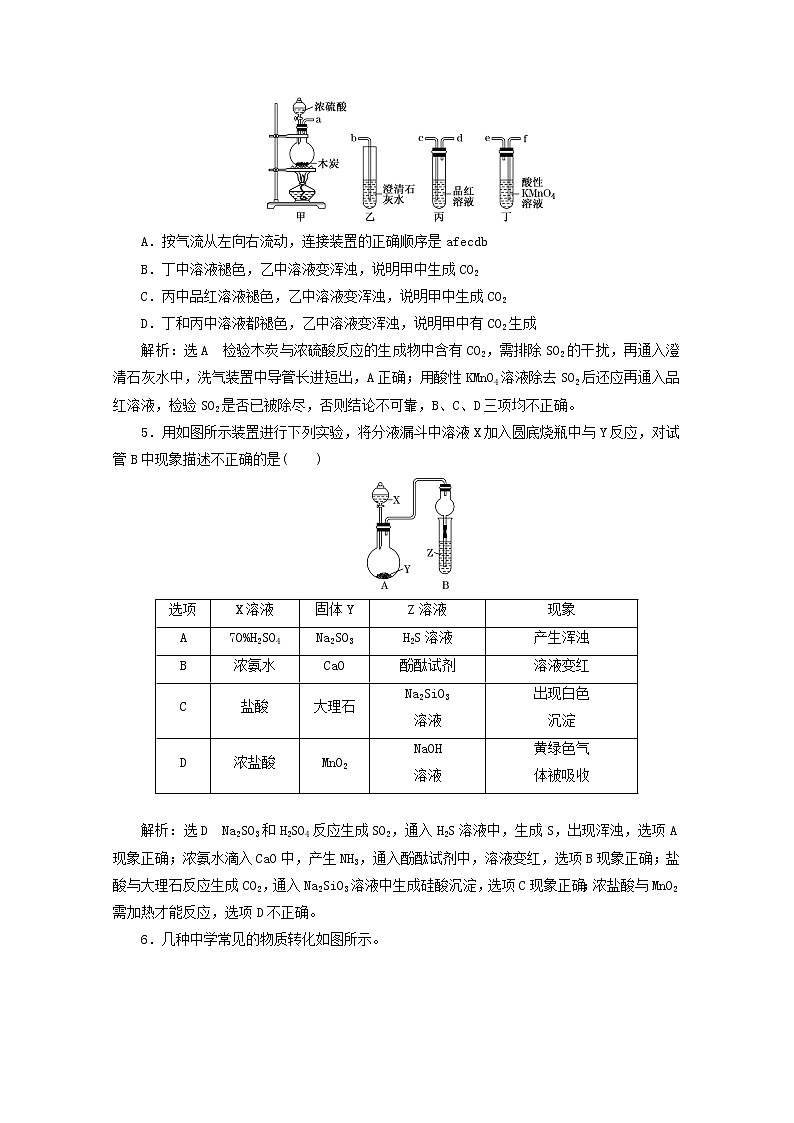
4.选用如图所示仪器中的两个或几个(内含物质)组装成实验装置,以验证木炭可被浓硫酸氧化成CO2,下列说法正确的是( )
A.按气流从左向右流动,连接装置的正确顺序是afecdb
B.丁中溶液褪色,乙中溶液变浑浊,说明甲中生成CO2
C.丙中品红溶液褪色,乙中溶液变浑浊,说明甲中生成CO2
D.丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有CO2生成
解析:选A 检验木炭与浓硫酸反应的生成物中含有CO2,需排除SO2的干扰,再通入澄清石灰水中,洗气装置中导管长进短出,A正确;用酸性KMnO4溶液除去SO2后还应再通入品红溶液,检验SO2是否已被除尽,否则结论不可靠,B、C、D三项均不正确。
5.用如图所示装置进行下列实验,将分液漏斗中溶液X加入圆底烧瓶中与Y反应,对试管B中现象描述不正确的是( )
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
A | 70%H2SO4 | Na2SO3 | H2S溶液 | 产生浑浊 |
B | 浓氨水 | CaO | 酚酞试剂 | 溶液变红 |
C | 盐酸 | 大理石 | Na2SiO3 溶液 | 出现白色 沉淀 |
D | 浓盐酸 | MnO2 | NaOH 溶液 | 黄绿色气 体被吸收 |
解析:选D Na2SO3和H2SO4反应生成SO2,通入H2S溶液中,生成S,出现浑浊,选项A现象正确;浓氨水滴入CaO中,产生NH3,通入酚酞试剂中,溶液变红,选项B现象正确;盐酸与大理石反应生成CO2,通入Na2SiO3溶液中生成硅酸沉淀,选项C现象正确;浓盐酸与MnO2需加热才能反应,选项D不正确。
6.几种中学常见的物质转化如图所示。
下表中R、X、Y、Z对应物质正确的是( )
选项 | R | X | Y | Z |
A | 紫色石蕊 | Fe2O3 | Fe2O3和Cu | Cu |
B | 甲基橙 | Fe(NO3)2 | Fe(OH)2 | Cu2(OH)2CO3 |
C | 酚酞 | Fe(OH)3 | FeO和Fe | CuO |
D | Fe2O3 | NaAlO2 | Na2SiO3 | Cu(OH)2 |
解析:选B Cu不和稀硫酸反应,A项错误;甲基橙遇稀硫酸变红色,Fe(NO3)2遇稀硫酸变成铁盐,Fe(OH)2与硫酸反应生成FeSO4,Cu2(OH)2CO3与硫酸反应生成CuSO4,B项正确;稀硫酸不能使酚酞变色,C项错误;硫酸与Fe2O3反应生成Fe2(SO4)3,溶液呈黄色得不到红色溶液,稀硫酸与NaAlO2反应得不到黄色溶液,稀硫酸与Na2SiO3反应得不到浅绿色溶液,D项错误。
7.合成氨及其相关工业中,部分物质间的转化关系如图所示。下列说法不正确的是( )
A.甲、乙、丙三种物质中都含有氮元素
B.反应Ⅱ、Ⅲ和Ⅳ的氧化剂相同
C.Ⅵ的产物可在上述流程中被再次利用
D.Ⅴ中发生反应:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl
解析:选B 甲是N2,与H2化合生成NH3。反应Ⅴ是侯氏制碱法原理,丁是NaHCO3,受热分解生成Na2CO3。NH3发生催化氧化生成NO,NO与O2反应生成NO2,NO2溶于水生成HNO3,HNO3和NH3反应生成NH4NO3,即乙是NO,丙是NO2。甲、乙、丙三种物质中都含有氮元素,A正确;反应Ⅳ中的氧化剂和还原剂均是NO2,B错误;NaHCO3分解生成的CO2可以循环利用,C正确。
8.硫酰氯(SO2Cl2)是重要的化学试剂,其熔点为-54.1 ℃,沸点为69.1 ℃,遇冷水逐渐分解,其制备原理为SO2(g)+Cl2(g)===SO2Cl2(l) ΔH=-97.3 kJ·mol-1,现用如图所示装置(夹持仪器已略去)进行实验。
下列说法正确的是( )
A.A的作用是冷凝回流,冷凝水应b口进a口出
B.乙和丙中分别盛装饱和食盐水和浓硫酸
C.活性炭可加快反应速率
D.B中最好盛装碱石灰,其作用只是为了除去多余的SO2和Cl2
解析:选C 由于反应放热会使SO2Cl2挥发损失,所以冷凝管的作用为冷凝回流,冷凝水应a口进b口出,A项错误;由于SO2Cl2遇冷水逐渐分解,所以制得的氯气应先用饱和食盐水除去挥发出来的HCl,再用浓硫酸除去水蒸气,B项错误;从反应原理看,活性炭不参与反应,而活性炭的特点是表面积大,具有吸附作用,所以其可增大两种反应物的接触面积,使反应速率加快,C项正确;B中盛装碱石灰,既要防止多余的SO2和Cl2逸出污染环境,也要防止空气中的水蒸气进入装置使SO2Cl2水解,D项错误。
9.甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是( )
选项 | 假设 | 结论 |
A | 甲为Al(OH)3 | 丁可能是盐酸 |
B | 甲为Na2CO3溶液 | 戊可能是CO2 |
C | 甲为Fe | 丁可能是盐酸 |
D | 甲为N2 | 戊可能是O2 |
解析:选C Al(OH)3为两性氢氧化物,可与酸、碱反应生成Al3+、AlO,AlO和Al3+在溶液中可发生反应生成Al(OH)3,A正确;若甲为Na2CO3溶液,可与CO2反应生成NaHCO3,与Ca(OH)2反应可生成NaOH,NaHCO3与NaOH反应可生成Na2CO3,B正确;若甲为Fe,丁为盐酸,则乙为FeCl2,丙可能为氯化铁或氧化铁等,但它们与FeCl2均不能反应生成Fe,C错误;若甲为N2,戊是O2,则丙为NO,乙可为NH3,NO和NH3在一定条件下反应可生成N2,D正确。
10.如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是( )
选项 | W | X | Y | Z | |
A | N2 | NH3 | NO2 | HNO3 | |
B | Na | Na2O2 | NaOH | NaCl | |
C | Fe | FeCl3 | Fe(OH)2 | FeCl2 | |
D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
解析:选D 常温下N2不能直接转化为NH3、NO2、HNO3,A项错误;常温下Na与O2反应生成Na2O而不是Na2O2,B项错误;常温下Fe不能一步转化为Fe(OH)2,Fe和Cl2在点燃时发生反应生成FeCl3,C项错误;Al与盐酸反应转化为AlCl3,与NaOH溶液反应转化为NaAlO2,与硫酸反应转化为Al2(SO4)3,AlCl3与过量NaOH溶液反应转化为NaAlO2,NaAlO2与过量硫酸反应转化为Al2(SO4)3,Al2(SO4)3与BaCl2溶液反应转化为AlCl3,D项正确。
11.利用如图所示装置模拟工业NaClO3与Na2SO3在浓H2SO4存在下制备ClO2,并以ClO2为原料制备NaClO2(已知:高于60 ℃时,NaClO2分解生成NaClO3和NaCl)。
下列说法不正确的是( )
A.逐滴加入浓硫酸可提高ClO2的利用率
B.装置④中所得产物中可能含有Na2SO4杂质
C.从装置④反应后的溶液中获得晶体,可采用常压蒸发结晶
D.制备NaClO2结束时,应关闭分液漏斗活塞,打开K1,关闭K2
解析:选C 逐滴加入浓硫酸可以控制生成ClO2的速率,使ClO2与NaOH、H2O2溶液充分反应,提高ClO2的利用率,故A正确;装置②中能生成少量的SO2,SO2与NaOH、H2O2溶液反应生成Na2SO4,故B正确;高于60 ℃时,NaClO2分解生成NaClO3和NaCl,若采用常压蒸发结晶,NaClO2易发生分解反应,故C错误;制备NaClO2结束时,应关闭分液漏斗活塞,打开K1,关闭K2,用①中NaOH溶液吸收尾气,故D正确。
12.某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO),下列说法不正确的是( )
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。
A.装置的连接顺序为a→f→e→j→i→h→g(或g→h)→b→c→d
B.装置戊中发生的化学方程式为2NO+2Fe2FeO+N2
C.装置丁的作用是除去挥发出来的硝酸和产生的NO2
D.装置乙的作用是干燥,防止水蒸气进入戊中干扰反应
解析:选D 根据实验原理利用NO被灼热的铁粉还原为N2,同时生成FeO,所以首先应制备纯净的干燥的NO,利用铜与稀硝酸反应生成NO,由于硝酸具有挥发性,所以制得的NO中会混有硝酸和水蒸气,则先通过装置丁除去挥发出的HNO3等酸性气体,然后再通过己干燥,得到纯净的干燥的NO进入戊中与铁粉反应,最后处理多余的NO,又因为NaOH溶液不与NO反应,而浓硝酸可氧化NO生成NO2,所以最终先通过乙氧化NO,后再通过丙吸收,故装置接口的连接顺序为a→f→e→j→i→h→g(或g→h)→b→c→d,A正确;装置戊中NO被灼热的铁粉还原为N2,同时生成FeO,反应的化学方程式为2NO+2Fe2FeO+N2,B正确;装置丁盛放的是水,其作用是除去挥发出的HNO3等酸性气体,C正确;装置乙盛放的是浓硝酸,依题意可以氧化NO,便于NaOH溶液吸收,D错误。
13.某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图1所示(部分产物已略去):
(1)写出F的电子式________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是________。
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,生成的CO2物质的量与所用盐酸体积如图2所示,则A与B溶液反应后溶液中溶质的化学式为____________________________。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_________________________________________。
(5)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E 与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式为_______
_______________________________________________________________。
(6)若A是一种溶液,只可能含有H+、NH、Mg2+、Fe3+、Al3+、CO 、SO中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图3所示,由此可知,该溶液中肯定含有的离子的物质的量浓度之比为___________________
____________________________________________________________。
解析:(1)C在D中燃烧发出苍白色火焰,C为H2,D为Cl2,F为HCl,其电子式为。(2)根据题意知M为NaCl,电解饱和食盐水,得B为NaOH溶液,A是酸性氧化物,用于制造玻璃,A为SiO2,E为Na2SiO3,其水溶液俗称水玻璃。(3)CO2和NaOH溶液反应溶质可能为NaOH、Na2CO3,Na2CO3,Na2CO3、NaHCO3,NaHCO3,从产生气体到气体最大量消耗盐酸的体积大于0.1,说明溶质为Na2CO3和NaHCO3。(4)能和NaOH溶液反应的金属单质为Al,2Al+2OH-+2H2O===2AlO+3H2↑,NaAlO2溶液与过量盐酸发生的离子反应依次是AlO+H++H2O===Al(OH)3↓,Al(OH)3+3H+===Al3++3H2O,现象是先有白色胶状沉淀,然后沉淀消失。(5)A是一种化肥,且与B反应产生气体,则A为铵盐,E为NH3,NH3和Cl2发生氧化还原反应,化学方程式为3Cl2+8NH3===N2+6NH4Cl。(6)由图可知,开始没有沉淀产生,说明溶液中有H+,发生H++OH-===H2O,存在H+则溶液中没有CO,随着沉淀量增多,到达某一时刻,沉淀不再改变,说明溶液中有NH,发生反应NH+OH-===NH3·H2O,然后沉淀量减少直至消失,说明含有Al3+,由电荷守恒判断,溶液中含有SO,结合各阶段消耗B溶液的体积,可得c(H+)∶
c(Al3+)∶c(NH)∶c(SO)=1∶1∶2∶3。
答案:(1) (2)水玻璃 (3)NaHCO3、Na2CO3
(4)溶液中逐渐有白色沉淀生成,且不断增加,随后沉淀逐渐减少最终消失 (5)3Cl2+8NH3===N2+6NH4Cl
(6)c(H+)∶c(Al3+)∶c(NH)∶c(SO)=1∶1∶2∶3
14.实验室常用的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氧气:
①如果用B装置,通常使用的试剂是_________________________________________;
②如果用C装置,通常使用的试剂是_______________________________________;
③检查B装置气密性的操作方法是________________________________________
________________________________________________________________________。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是________(填字母,下同)。
a.密度 b.颜色
c.溶解性 d.热稳定性
e.与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________。
a.CO2 b.H2 c.Cl2
①写出A装置中发生反应的离子方程式:________________________________
________________________________________________________________________。
②D装置中烧杯中应盛放________,目的是___________
________________________________________________________________________。
③若要收集干燥纯净的X气体,上述装置应如何改进:
________________________________________________________________________。
解析:(1)①如果用B装置,实验室制取氧气常用高锰酸钾或氯酸钾与二氧化锰在加热条件下分解制备氧气;②如果用C装置,反应不需要加热,则可以用过氧化氢溶液在二氧化锰作催化剂条件下分解制备氧气;③检查B装置气密性是否良好的操作方法是连接一段导气管并将其插入水中,用酒精灯微热(或用手捂住)试管,如果导管口有气泡产生,松开手或停止加热,冷却后,在导管里回升一段水柱,且保持一段时间不下降则说明B装置气密性良好。(2)收集气体的方法的选择可依据气体的密度、溶解性、和是否与氧气反应,如气体与氧气反应则只能用排水法收集,气体是否有颜色、气体热稳定性与收集方法无关。(3)A与D连接是利用向上排气法收集气体;吸收装置是用液体吸收气体防止污染空气;制取CO2时不需要加热也不必处理尾气,H2不能用向上排空气法收集,且尾气处理时一般采用点燃的方法,故X可能是Cl2。①A装置中二氧化锰和浓盐酸加热反应生成氯气、氯化锰和水。②D装置中连接烧杯的目的是用来吸收尾气,防止污染空气,实验室一般用NaOH溶液吸收多余的Cl2。③生成的氯气中含氯化氢气体和水蒸气,通过饱和食盐水除去HCl,通过浓硫酸除去水蒸气,若要收集干燥纯净的X气体,装置应在盛有浓硫酸的洗气瓶前加一个装有饱和NaCl溶液的洗气瓶。
答案:(1)①氯酸钾和二氧化锰(或高锰酸钾) ②过氧化氢溶液和二氧化锰 ③连接一段导气管并将其插入水中,用酒精灯微热(或用手捂住)试管,如果导管口有气泡产生,松开手或停止加热,冷却后,在导管里回升一段水柱,且保持一段时间不下降则说明B装置气密性良好
(2)bd (3)c
①MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
②NaOH溶液 吸收尾气Cl2,防止污染空气
③在盛有浓硫酸的洗气瓶前加一个装有饱和NaCl溶液的洗气瓶
15.三氯化硼是重要的化工原料。可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
[查阅资料] ①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;
②2B+6HCl2BCl3+3H2,硼也能与强碱反应。
某研究性学习小组用如图所示装置制备三氯化硼。
回答下列问题:
(1)A装置中反应的离子方程式:_____________________________________________
________________________________________________________________________。
(2)B装置的作用是________________________________;如果拆去B装置,可能的后果是________________________________________________________________________。
(3)D装置中发生反应的化学方程式:___________________________________。
(4)G装置的作用是____________________;为使实验装置简便,可用一个装置代替F和G装置。该装置所用仪器是________,所装试剂是________。
(5)A、D两处加热的先后顺序是________,其理由是__________________________
________________________________________________________________________。
(6)检验制得的产品中含有硼粉的实验操作是___________________________________
________________________________________________________________________。
解析:(1)装置A制取Cl2,因此离子反应方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。(2)盐酸易挥发,制取的Cl2中含有HCl,B装置的作用是除去Cl2中的HCl杂质气体;如果拆去B装置,可能的后果是硼粉与HCl反应生成的产物中有H2,加热H2与Cl2的混合气体,易发生爆炸。(3)D装置中发生的反应是硼粉与Cl2反应生成BCl3,反应的化学方程式为2B+3Cl22BCl3。(4)G装置其作用是吸收未反应完的Cl2,防止污染空气;为使实验装置简便,可用一个装置代替F和G装置,可防止空气中的水蒸气进入E,又能吸收未反应完的Cl2,该装置所用仪器是干燥管或U形管,所装试剂是碱石灰。(5)A、D两处加热的先后顺序是先A后D,其理由是排尽装置中的空气,避免氧气与硼粉反应生成B2O3。(6)检验制得的产品中含有硼粉的实验操作是取少量样品于试管中,滴加浓NaOH溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
答案:(1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(2)除去Cl2中的HCl杂质气体 硼粉与HCl反应生成的产物中有H2,加热H2与Cl2的混合气体,易发生爆炸
(3)2B+3Cl22BCl3
(4)吸收未反应完的Cl2,防止污染空气 干燥管或U形管 碱石灰
(5)先A后D 排尽装置中的空气,避免氧气与硼粉反应生成B2O3
(6)取少量样品于试管中,滴加浓NaOH溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉








