
还剩11页未读,
继续阅读
2019届二轮复习 原子结构 化学键 学案(全国通用)
展开
原子结构 化学键
一、考纲要求
1. 了解元素、核素和同位素的含义。
2. 了解原子结构。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3. 了解原子核外电子的排布。
4. 了解化学键的定义。了解离子键、共价键的形成。
二、考题规律
原子结构的有关高考题多以信息题的形式出现。考查的内容:微粒的质子数、中子数、质量数、核外电子数、原子序数、核电荷数等相互求算。核外电子的排布除考查核外电子排布规律外,主要是将电子排布与分子构成联系起来考查,化学键是研究微粒间相互作用的基础理论,是在离子化合物和共价化合物以及原子结构和元素周期律等知识的基础上,介绍了离子键、共价键的知识,内容抽象,理论性强,概念多,常与原子结构等内容综合考查。
三、考向预测
预计今后的高考将以新材料、新发现、新科学成就、同位素的应用为题材考查原子结构、核素、同位素、元素、同系物、同素异形体、同分异构体等概念,考查以物质的量为核心的微粒结构之间关系的计算,这是高考命题的热点。我们在复习中要注意社会热点和新的科学成就,加强对概念的理解,注意对概念的应用。
一、原子结构
1. 构成原子的微粒
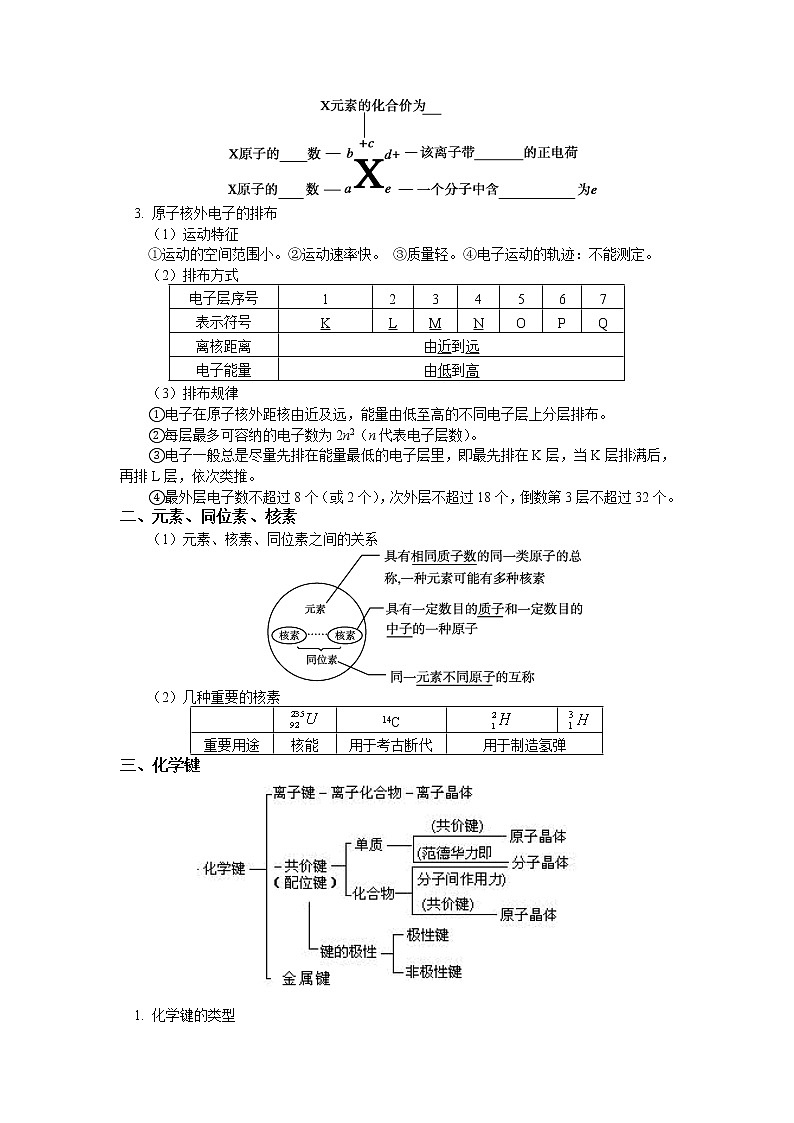
2. 符号 X 中各数字的含义
3. 原子核外电子的排布
(1)运动特征
①运动的空间范围小。②运动速率快。 ③质量轻。④电子运动的轨迹:不能测定。
(2)排布方式
电子层序号
1
2
3
4
5
6
7
表示符号
K
L
M
N
O
P
Q
离核距离
由近到远
电子能量
由低到高
(3)排布规律
①电子在原子核外距核由近及远,能量由低至高的不同电子层上分层排布。
②每层最多可容纳的电子数为2n2(n代表电子层数)。
③电子一般总是尽量先排在能量最低的电子层里,即最先排在K层,当K层排满后,再排L层,依次类推。
④最外层电子数不超过8个(或2个),次外层不超过18个,倒数第3层不超过32个。
二、元素、同位素、核素
(1)元素、核素、同位素之间的关系
(2)几种重要的核素
14C
重要用途
核能
用于考古断代
用于制造氢弹
三、化学键
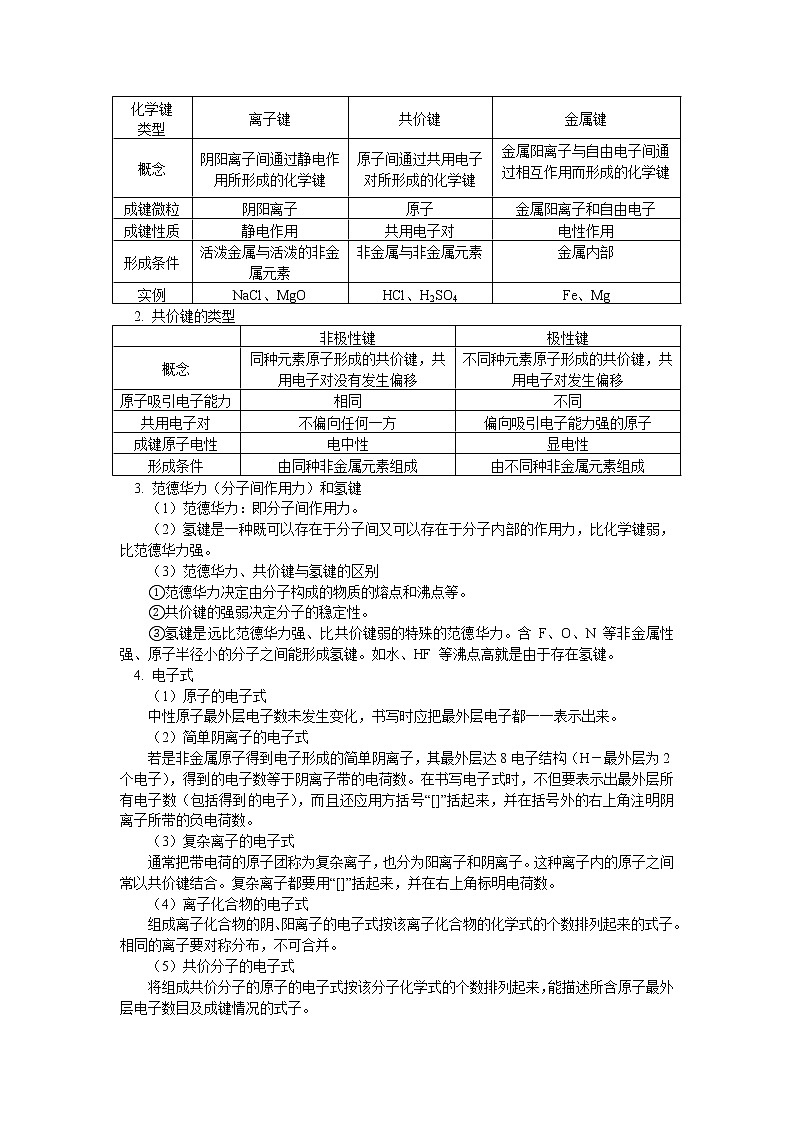
1. 化学键的类型
化学键
类型
离子键
共价键
金属键
概念
阴阳离子间通过静电作用所形成的化学键
原子间通过共用电子对所形成的化学键
金属阳离子与自由电子间通过相互作用而形成的化学键
成键微粒
阴阳离子
原子
金属阳离子和自由电子
成键性质
静电作用
共用电子对
电性作用
形成条件
活泼金属与活泼的非金属元素
非金属与非金属元素
金属内部
实例
NaCl、MgO
HCl、H2SO4
Fe、Mg
2. 共价键的类型
非极性键
极性键
概念
同种元素原子形成的共价键,共用电子对没有发生偏移
不同种元素原子形成的共价键,共用电子对发生偏移
原子吸引电子能力
相同
不同
共用电子对
不偏向任何一方
偏向吸引电子能力强的原子
成键原子电性
电中性
显电性
形成条件
由同种非金属元素组成
由不同种非金属元素组成
3. 范德华力(分子间作用力)和氢键
(1)范德华力:即分子间作用力。
(2)氢键是一种既可以存在于分子间又可以存在于分子内部的作用力,比化学键弱,比范德华力强。
(3)范德华力、共价键与氢键的区别
①范德华力决定由分子构成的物质的熔点和沸点等。
②共价键的强弱决定分子的稳定性。
③氢键是远比范德华力强、比共价键弱的特殊的范德华力。含 F、O、N 等非金属性强、原子半径小的分子之间能形成氢键。如水、HF 等沸点高就是由于存在氢键。
4. 电子式
(1)原子的电子式
中性原子最外层电子数未发生变化,书写时应把最外层电子都一一表示出来。
(2)简单阴离子的电子式
若是非金属原子得到电子形成的简单阴离子,其最外层达8电子结构(H-最外层为2个电子),得到的电子数等于阴离子带的电荷数。在书写电子式时,不但要表示出最外层所有电子数(包括得到的电子),而且还应用方括号“[]”括起来,并在括号外的右上角注明阴离子所带的负电荷数。
(3)复杂离子的电子式
通常把带电荷的原子团称为复杂离子,也分为阳离子和阴离子。这种离子内的原子之间常以共价键结合。复杂离子都要用“[]”括起来,并在右上角标明电荷数。
(4)离子化合物的电子式
组成离子化合物的阴、阳离子的电子式按该离子化合物的化学式的个数排列起来的式子。相同的离子要对称分布,不可合并。
(5)共价分子的电子式
将组成共价分子的原子的电子式按该分子化学式的个数排列起来,能描述所含原子最外层电子数目及成键情况的式子。
聚焦热点1:构成原子微粒间的关系
例1 质子数和中子数相同的原子A,其阳离子An+核外共有x个电子,则A的质量数为( )
A. 2(x+n) B. 2(x-n) C. 2x D. n+2x
分析:阳离子An+核外共有x个电子,即失去n个电子后还有x个,原子原来有x+n个电子,质子数也为x+n,质子数和中子数相同,且质子数加中子数等于质量数,所以A的质量数为2(x+n)
答案:A
点评:此类题首先要看清提供的是阴离子还是阳离子的电子数,阳离子是原子失去电子形成的,所以求原子电子数要用离子的电子数加上已经失去的电子,阴离子是原子得到电子形成的,所以求原子电子数要用离子的电子数减去已经得到的电子。
例2 某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是( )
A. (A-N+m) mol B. (A-N) mol
C. (A+N) mol D. mol
分析:X原子的质子数为(A-N)个,一个HmX中所含的质子数为(A-N+m)个,HmX的摩尔质量为(A+m)g/mol,所以a g HmX中所含质子的物质的量为mol。
答案:D
点评:解决本题的关键是确定一个HmX中所含的质子数。
例3 某元素的一个原子形成的离子可表示为abXn-,下列说法正确的是( )
A. abXn-含有的中子数为a+b
B. abXn-含有的电子数为a-n
C. X原子的质量数为a+b+n
D. X原子的质量约为 g
分析:中子数等于质量数减去质子数,为b-a,A错;该离子含有的电子数为a+n,B错;原子变成离子时,质量数与核外电子数无关,所以X原子的质量数为b,C错;质量数为相对原子质量的近似整数值,所以b即为1 mol X原子的质量,则一个X原子的质量为 g,D正确。
答案:D
点评:这道题考查了构成原子的各微粒间的关系。这里需要注意的是所给的微粒是离子而非原子。
聚焦热点2:元素、核素、同位素
例1 (海南)是常规核裂变产物之一,可以通过测定大气或水中的含量变化来检测核电站是否发生放射性物质泄漏。下列有关的叙述中错误的是
A. 的化学性质与相同 B. 的原子序数为53
C. 的原子核外电子数为78 D. 的原子核内中子数多于质子数
分析:A选项考查同位素的化学性质相同这一知识点,B选项考查中数字的含义,C中电子数=53,故C错,D是中子数的计算。
答案:C
点评:本题考查同位素、核素,体现了社会热点问题。由于日本福岛核问题而使成为社会关注的焦点。这类题紧扣社会热点问题或主题,注意每年都可把与化学相关得热点、焦点作为备考点。
例2 ( 山东高考)16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )
A. 16O2与18O2互为同分异构体
B. 16O与18O核外电子排布的方式不同
C. 通过化学变化可以实现16O与18O间的相互转化
D. 标准状况下,1.12 L16O2和1.12 L18O2均含有0.1NA个氧原子
分析:A中是同一种物质,故A错;B中的两种氧原子的电子数相等,核外电子排布也相同,故B错;16O和18O之间的转化是原子核的变化,不是化学变化,故C错;1.12 L标准状况下O2的物质的量为0.05 mol,含有氧原子数为0.1NA,故D正确。
答案:D
点评:此题考查了同分异构体、电子排布等有关内容。一定要弄清同分异构体、同位素和同素异形体的区别。同时要明确化学反应的实质。
例3 有下列符号:35Cl和 37Cl、O2和O3、1H216O和2H218O。下列有关说法正确的是( )
A. 35Cl和 37Cl互称为同素异形体 B. O2和O3是氧元素的两种同位素
C. 35和37表示的是质量数 D. 1H216O和 2H218O表示同一种水分子
分析:35Cl和 37Cl是氯元素的两种同位素,A错。O2和O3是氧元素形成的两种性质不同的单质,是氧元素的两种同素异形体,B错。1H216O 由2个普通氢原子(1H)和1个16O原子构成,其质量数为18;而2H218O 由2个重氢原子(2H)和1个18O原子构成,其质量数为22,显然不是相同的水分子,D错。
答案:C
点评:本题重点考查了一些重要的概念。这也是高考的一个发展方向。在平时的学习中还是要深入去理解、掌握概念的内涵和外延。相似的概念还要把握其异同点。
聚焦热点3:核外电子排布及元素推断
聚焦热点3:核外电子排布及元素推断
例1 今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层恰为A原子L层电子数的2倍,A和B分别为( )
A. 硅原子和钠原子 B. 硼原子和氦原子
C. 氯原子和碳原子 D. 碳原子和铝原子
分析:根据题中信息,B原子的M层上肯定要有电子,则L层上已排满8个电子,A原子L层上是4个电子,A、B原子结构示意图分别为
答案:D
点评:抓住给定的信息是解元素推断题的关键,必要时还要会顺藤摸瓜。
例2 在第n电子层中,当它作为原子的最外层时,容纳电子数最多与(n-1)层相同。当它作为电子的次外层时,其电子数比(n-1)层多10个,则此电子层是( )
A. K层 B. L层 C. M层 D. N层
分析:由题意很容易排除A、B两项。M层作为最外层最多容纳8个电子,与L层相同;而当M层作为次外层时,最多容纳18个电子,比L层多10个。故本题答案为C。
答案:C
点评:此题要注意应用核外电子排布的原则。同时要注意这几条原则是相互制约的。
例3 (浙江高考)X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. XZ2、X2M2、W2Z2均为直线型的共价化合物
C. 由X元素形成的单质不一定是原子晶体
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
分析:X、Y、Z、M、W依次为C、N、O、H、Na。A. 错误,原子半径:C>N>O 。B. 错误,W2Z2即Na2O2为离子化合物。C. 石墨、C60等为非原子晶体。D. NH4HCO3为离子化合物,符合条件,反例CH3-NO2为共价化合物。
答案:C
点评:试题在推理判断能力的考查中渗透了结构、性质和用途等基础知识的考查。首先以具体元素推断为基础,运用周期表,结合周期律,考虑位、构、性关系推断X、Y、Z、W、M分别是什么元素。在此基础上应用知识解决题给选项的问题。
聚焦热点4:化学键
例1 下列有关化学用语使用正确的是 ( )
A. 硫原子的原子结构示意图:
B. NH4Cl的电子式:
C. 原子核内有10个中子的氧原子:O
D. CO2的电子式:
分析:A项是S2-的结构示意图;B项中没有标出Cl-的电子式,应表示为
D项CO2的电子式为 。故选C。
答案:C
点评:这道题易错选B或D。电子式书写时常见的错误①漏写未参与成键的电子,如:N2:,应写为:。②化合物类型不清楚,漏写或多写[ ]及错写电荷数。③书写不规范,错写共用电子对,如:N2的电子式为④ 不考虑原子最外层有几个电子均写成8电子结构。
例2 下列物质中含有相同的化学键类型的是( )
A. NaCl、HCl、H2O、NaOH B. Cl2、Na2S、HCl、SO2
C. HBr、CO2、H2O、CS2 D. Na2O2、H2O2、H2O、O3
分析:A项,NaOH、NaCl中均含有离子键,HCl、H2O中含有共价键;B项,Na2S中含有离子键,Cl2、HCl、SO2中含有共价键;C项,各物质都只含有共价键;D项,Na2O2中含有离子键和共价键,H2O2、H2O、O3均只含有共价键。
答案:C
点评:(1)离子化合物中一定存在离子键,如NaCl等,也可能含有离子键和共价键,如NaOH、Na2SO4等。而共价化合物中只存在共价键。
(2)共价键可以存在于离子化合物、共价化合物中,某些非金属单质中也存在共价键,如H2、O2、N2、Cl2等。稀有气体分子中不存在化学键。
例3 (全国卷)下列判断错误的是
A. 沸点: B. 熔点:
C. 酸性: D. 碱性:
分析:B考查不同类型晶体的熔沸点高低,一般认为是:原子晶体>离子晶体>分子晶体,所以B正确;C项正确,一般元素非金属性越强,对应最高价氧化物的水化物的酸性越强;D正确,一般元素金属性越强,对应最高价氧化物的水化物的碱性越强。A项错误,NH3分子间存在氢键,故最高,AsH3、PH3分子间不存在氢键,只有范德华力,组成和结构相似的分子相对分子质量越大,其分子间作用力越大,熔沸点越高,故应改为:NH3>AsH3>PH3;
答案:A
点评:考查基本概念:如晶体熔沸点高低的判断,氢键与范德华力对物质的物性的影响,金属性、非金属性的强弱判断方法的具体应用,这些都需平时反复训练。
一、同位素及相对原子质量
同
位
素
定义
具有相同质子数和不同中子数的同一元素的原子互称同位素
特性
1. 同一元素的各种同位素化学性质几乎完全相同.
2. 天然存在的某种元素里,不论是游离态还是化合态,各种同位素的原子含量一般是不变的.
判定
方法
它反映的是同种元素的不同原子间的关系.故单质、化合物间不可能是同位素。如H2和D2及H2O和D2O之间不存在同位素关系。只有质子数相同而中子数不同的原子才是同位素;如和是同位素,而和N不是同位素。
注意
天然存在的元素中,许多都有同位素(但并非所有元素都有同位素)。因而发现的原子种数多于元素的种数。
相对原子质量和近似相对原子质量
同位素的相对原子质量和近似相对原子质量
按初中所学的相对原子质量的求算方式是:一个原子的质量与一个12C原子质量的的比值。显然,所用原子质量是哪种同位素原子的质量,其结果只能是该同位素的相对原子质量。故该定义严格说应是同位素的相对原子质量。该比值的近似整值即为该同位素的近似相对原子质量,其数值等于该同位素的质量数。
元素的相对原子质量和近似相对原子质量
因天然元素往往不止一种原子,因而用上述方法定义元素的相对原子质量就不合适了。元素的相对原子质量是用天然元素的各种同位素的相对原子质量及其原子含量算出来的平均值。数字表达式为=M1×a1%+M2×a2%+……。若用同位素的质量数替代其相对原子量进行计算,其结果就是元素的近似相对原子质量(计算结果通常取整数)。我们通常采用元素的近似相对原子质量进行计算。
二、典型的微粒结构
1. 核外电子排布的特例归纳(短周期元素)
(1)最外层有1个电子的元素:H、Li、Na。
(2)最外层有2个电子的元素:He、Be、Mg。
(3)最外层电子数等于次外层电子数的元素:Be、Ar。
(4)最外层电子数是次外层电子数2倍的元素: C ;是次外层3倍的元素:O
(5)电子层数与最外层电子数相等的元素:H、Be、Al。
(6)电子总数为最外层电子数2倍的元素:Be。
(7)次外层电子数是最外层电子数2倍的元素:Li、Si。
(8)内层电子总数是最外层电子数2倍的元素:Li、P。
2. 核外电子数相等的微粒
练习题
(答题时间:60分钟)
一、选择题
1. 下列说法正确的是( )
A. 由分子组成的物质中一定存在共价键
B. 由非金属元素组成的化合物一定是共价化合物
C. 非极性键只存在于双原子单质分子里
D. 两种非金属元素原子间不可能形成离子键
2. 美国科学家将两种元素铅和氢的原子核对撞,获得了一种质子数为118,中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是( )
A. 57 B. 47 C. 61 D. 293
3. 已知某元素阴离子Rn-的原子核内的中子数为(A-x+n),其中A为原子的质量数。则mg Rn-中的电子总数为( )
A. B. C. D.
4. X、Y、Z和R分别代表四种元素,如果四种aXm+、bYn+、cZn-、dRm-离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是( )
A. a-c=m-n B. a-b=n-m C. c-d=m+n D. b-d=n+m
*5. (试题调研,天津十校联考)法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子被称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是( )
A. 该粒子不显电性 B. 该粒子质量数为4
C. 在周期表中与氢元素占同一位置 D. 该粒子质量比氢原子大
6. 下列说法正确的是( )
A. 原子中,核内中子数与核外电子数的差值为143
B. 纯碱CuSO4·5H2O和生石灰分别属于卤、混合物和氧化物
C. 凡是能电离出离子的化合物都是离子化合物
D. NH3硫酸钡和水分另属于非电解质、强电解质和弱电解质
7. 水是最宝贵的资源之一。下列表述正确的是( )
A. H2O的电子式为
B. 4℃时,纯水的pH=7
C. 中,质量数之和是质子数之和的两倍
D. 273K、101kPa,水分子间的平均距离:(气态)>(液态)>(固态)
8. 周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述中不正确的是( )
A. WZ2分子中所有原子最外层都为8电子结构
B. WX2、ZX2的化学键类型和晶体类型都相同
C. WX2是以极性键结合成的非极性分子
D. 原子半径大小顺序为X<W<Y<Z
9. 究太空的奥秘需要推进力强大的火箭。氢化锂(LiH)、氘化锂(LiD)、氚化锂(LiT)在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中。下列有关说法中,正确的是( )
A. LiH、LiD、LiT各1 mol 时,质量相同
B. LiH、LiD、LiT中氢元素的化合价均为+1价
C. H、D、T之间互称为同位素
D. LiH、LiD、LiT在反应中常作氧化剂
*10. (全国理综Ⅱ)短周期元素W、X、Y、Z的原子序数依次增大,且W、X、 Y+、 Z的最外层电子数与其电子层数的比值依次为2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述错误的是( )
A. X和其他三种元素均可形成至少2种二元化合物
B. W和X、Z两种元素分别形成的二元化合物中,均有直线型分子
C. W、X和Y三种元素可以形成碱性化合物
D. Z和其他三种元素形成的二元化合物,其水溶液均显酸性
11. 下列叙述中正确的是 ( )
A. O3和NO2都是共价化合物
B. 有化学键断裂的变化属于化学变化
C. 在离子化合物与共价化合物中,都不存在单个小分子
D. 在反应O3+2KI+H2O===2KOH+I2+O2中,参加反应的所有臭氧都作氧化剂
12. 有X和X+两种粒子,下列叙述正确的是 ( )
A. 一定都是由质子、中子、电子组成的
B. 化学性质几乎完全相同
C. 质子数一定相等,质量数和中子数一定不相等
D. 核电荷数和核外电子数一定相等
二、填空题
13. 在遭遇冰雪灾害时,经常使用一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
(1)m=________,该融雪剂的化学式为________.
(2)Z、W元素的名称为__________、__________.
(3)下列说法正确的是________.
A. XY2和WZ2都为离子化合物
B. XY2中仅含离子键,WZ2中仅含极性共价键
C. H2Z比HY的稳定性强
D. X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________.
A. XY2的电子式:X2+[]2-
B. WZ2的结构式:Z==W==Z
C. Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-===2Y-+Z↓
D. 用电子式表示XY2的形成过程为:
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是____.
14. A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10电子的化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的原子结构示意图为______________;化合物BA4的电子式为____________.
(2)化合物Y2X2中含有的化学键类型有________(填序号).
A. 离子键 B. 极性共价键 C. 非极性共价键 D. 氢键
(3)A与X和A与Z均能形成18个电子的化合物,这两种化合物发生反应的化学方程式为_________________________________________________________.
*15. X、Y、Z三种主族元素位于周期表中连续的三个不同周期。原子序数:Z>X>Y,其中Y原子的次外层电子数为2,X原子的次外层电子数与Y、Z原子的次外层电子数均不相同,X与Y的族序数之和等于Z的族序数。已知X的氢氧化物难溶于水,Y的最高价氧化物对应的水化物是一种强酸。由此推出:
(1)X是________,Y是________,Z是________。
(2)将X的单质投入到Z单质的水溶液中,观察到的现象是_______________,有关反应的化学方程式是_____________________。
(3)写出X的单质与Y的单质反应的化学方程式________________________________。
*16. A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E的电子数少8.
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,C元素在周期表中的位置为 ___________________,乙与甲的水溶液反应的离子方程式为____
(2)B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与
丙反应产生无色无味的气体,该反应的化学方程式为_______________________.
(3)“神舟七号”飞船上的能量主要来自太阳能和燃料电池,H2、O2和甲的水溶液可形成氢氧燃料电池,负极的电极反应为________________________,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为_______ NA.
(4)有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,与E的电子
数相同,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为_______________________,1 mol戊与过量盐酸反应的离子方程式是______________________,戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是________________________________;8 g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375 kJ的热量,写出该反应的热化学方程式_________________________________________.
练习题答案
1. D 解析:由分子组成的物质也可能是稀有气体,稀有气体为单原子分子,不存在化学键,A错;由非金属元素组成的化合物如NH4Cl是离子化合物,B错;非极性键不仅存在于双原子单质分子里,也存在于离子化合物(如Na2O2)和多原子共价化合物(如H2O2)中,C错;两种非金属元素原子间不能得失电子形成离子键,只能通过共用电子对形成共价键,D正确。
2. A
解析:对原子而言,核外电子数等于质子数,故中子数与核外电子数之差为:175-118。
3. D 解析:Rn-的原子核内的中子数为(A-x+n),原子的质量数为A,故原子的质子数为: A-(A-x+n)=x-n,原子的电子数也为x-n,Rn-的电子数为x,mgR n-中的电子总数就是。
4. D 解析:解析一:本题可用“抽象问题具体化”的方法来解
设m=1,n=2,可视Xm+为Na+, Yn+为Mg2+,Zn-为O2-,Rm-为F-,
则a=11,b=12,c=8,d=9,由此不难得出正确答案为D。
解法二:离子电子层结构相同,则核外电子数相等,故a-m=b-n=c+n=d+m,则通过变换得出正确答案为D。
*5. C 解析:“四中子”无质子,只有四个中子,所以A、B、D正确。
6. D 解析:A 项143 是中子数;B 项蓝矾是纯净物;C项共价化合物溶解于水也能电离出离子。
7. C 解析:本题主要考查有关水的化学基本用语。A项,水是共价化合物,其分子的电子式为;B项,温度升高,水的电离程度增大,α(OH-)=α(H+)<7;C项,一个分子中,其质量数为20,质子数为10,D项,在温度压强一定时,它只能呈一种状态。综上分析可知,本题选C项
8. D 解析:本题主要考查元素周期表和原子核外电子的排布及晶体结构等内容。由短周期元素Y原子的内层电子总数是其最外层电子数的2.5倍,可知Y为14号元素硅,由于W、X、Y、Z的原子序数依次增大,且W、Y为同一主族元素,所以W为碳元素;又由于W与X可形成共价化合物WX2,则X为氧元素;又由X、Z同主族知Z为硫元素;在CS2分子中所有原子最外层都是8电子结构,A正确;CO2与SO2都是共价化合物,且它们都是分子晶体,B正确;在CO2分子中CO键为极性键,而CO2分子为非极性分子,C正确;显然,C、O、Si、S四种原子的原子半径的大小关系为Si>S>C>O,故D选项不正确。
9. C 解析:H、D、T的中子数不同,即质量数不同;1 mol的LiH、LiD、LiT的质量不同,A错;Li为金属元素,只呈+1价,故LiH、LiD、LiT中氢元素的化合价均为-1价,B错;KH、D、T之间互称为同位素,C正确;由于在LiH、LiD、LiT中,氢元素处于-1价,易升高,故在反应中常作还原剂,D错。
*10. D 解析:W、X、Y、Z都是短周期元素,电子层都不超过3。Y+的最外层电子数与其电子层数的比值为4,Y+的最外层电子数只能为8,Y+的电子层数为2,故Y为Na;Z的原子序数大于Y,且最外层电子数与电子层数(3层)的比值为2,故Z为S;X为第2周期元素,X为O,四种元素都不是零族元素,W为C。O与其他三种元素都能形成至少2种二元化合物,A说法正确;CS2和CO2都是直线型分子,B说法正确;Na2CO3和NaHCO3都是显碱性的化合物,C说法正确;Na2S溶液显碱性,D说法错误。
11. D 解析:O3为单质,A项错误;化学变化的实质是旧化学键断裂和新化学键生成,仅有化学键断裂不是化学反应,如氯化钠溶于水,离子键断裂,属于物理变化,B项错误;离子化合物中不存在分子,共价化合物中有的不含有分子,如二氧化硅,有的却含有分子,如水、氯化氢等,C项错误;臭氧中的三个氧原子是按照一定方式结合的,虽然反应后有两个氧原子化合价没有变化,但臭氧作为一个整体,化合价发生了变化,D项正确。
12. C 解析:X、X+是同种元素的不同核素的原子和离子,A-Z可能为0即中子数可能为0,A错误;原子与离子的化学性质不同,B错误;C正确;X和X+的核电荷数相等,但核外电子数不相等,D错误。
13. 解析:(1)由X原子的结构示意图可推知其为,该元素为Ca,根据CaY2可知Y为-1价,又因为Y-与Ca2+的电子层结构相同,可知 Y为Cl.
(2)Z、W原子的最外层电子数是其电子层数的2倍,则Z、W是C或S.Z与Y相邻
则Z是S,W是C.
(3)CaCl2是仅含离子键的离子化合物,CS2是仅含极性键的共价化合物,A错误,B
正确;S的非金属性弱于Cl,则H2S的稳定性比HCl弱,C错误.Ca2+、Cl-具有相同的电子层结构,但Ca元素的核电荷数大,离子半径小,D错误.
(4)XY2为CaCl2,其电子式为[]-Ca2+[]-,H2S的水溶液显弱酸,应写成分子式,即Cl2+H2S===2H++2Cl-+S↓,A、C错误.
(5)氢键影响物质的熔沸点,使水的沸点升高。
答案:(1)20 CaCl2 (2)硫 碳 (3)B (4)B、D (5)水分子间存在氢键
14. 解析:(1)Y2X2与水反应生成X单质,其溶液可使酚酞试液变红,Y为Na,X为O.又X与Z同主族,则Z为S,A、B、X、Y、Z原子序数递增,B与Z最外层电子数之比为2∶3,B为C,又A与B和X均可形成10电子化合物,A为H.化合物BA4为CH4.(2)Y2X2为Na2O2,既含有离子键又含有非极性共价键.(3)H2O2具有氧化性,H2S具有强还原性,H2O2与H2S反应生成H2O和S。
答案:(1)
(2)AC
(3)H2O2+H2S===2H2O+S↓
*15. 解析:Y原子的次外层电子数为2,说明Y位于第二周期,同时Y的最高价氧化物对应的水化物是一种强酸,推得Y为N;结合“原子序数:Z>X>Y”,可知X位于第三周期,Z位于第四周期。又因为X原子的次外层电子数与Y、Z原子的次外层电子数均不相同,推得X的核外电子排布为2,8,x;Z的核外电子排布为2,8,18,z。第三周期元素的氢氧化物难溶于水的有Mg(OH)2或Al(OH)3,Y(N)位于第ⅤA族,Y、Z为主族元素,则可知X必定为Mg,推知Z为Br。
答案:(1)Mg N Br
(2)溴水褪色 Mg+Br2===MgBr2
(3)3Mg+N2 Mg3N2
*16. 解析:A、B、C、D、E都是短周期元素形成的离子,电子总数不超过18,而A、B、C、D四种离子的电子数均比E的电子数少8,则A、B、C、D是10电子离子,而E为18电子离子.
(1)A与B结合成的化合物甲中既有离子键又有共价键,甲可能为NaOH,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,则乙为Al(OH)3,A为OH-,B为Na+,C为Al3+,C元素在周期表中的位置为第三周期第ⅢA族,Al(OH)3溶于NaOH溶液的离子反应方程式为Al(OH)3+OH-===AlO+2H2O.
(2)B与E结合成化合物丙,其中离子数之比为2∶1,则丙为Na2O2,A与D结合成H2O,H2O与Na2O2反应产生无色无味的气体O2,该反应的化学方程式为:2Na2O2+2H2O===4NaOH+O2↑.
(3)H2、O2和NaOH的水溶液可形成氢氧燃料电池,负极的电极反应为:2H2+4OH--4e-===4H2O,当生成1.8 L饮用水时,电池内转移的电子数约为:×2×NA=200NA.
(4)n(N)∶n(H)=1∶2,且是18电子离子,故戊为N2H4;因为其分子结构中只有单键,与氨相似, 则戊的结构式为,它与盐酸的反应类似于NH3与盐酸的反应,故1 mol戊与过量盐酸反应的离子方程式为:N2H4+2H+===N2H.戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,这是因为戊中氮元素的化合价为-2价,处于氮的中间价态,既可以升高,又可以降低.1 mol N2H4完全反应放出的热量为×32 g=1 500 kJ,故该反应的热化学方程式为:N2H4(l)+2H2O2(l)===N2(g)+4H2O(g),ΔH=-1 500 kJ/mol.
答案:(1)第三周期第ⅢA族 Al(OH)3+OH-=== AlO+2H2O
(2)2Na2O2+2H2O===4NaOH+O2↑
(3)2H2+4OH--4e-===4H2O 200
(4);N2H4+2H+===N2H;戊中氮元素的化合价为-2价,既可以升高,又可以降低.N2H4(l)+2H2O2(l)===N2(g)+4H2O(g),ΔH=-1 500 kJ/mol
一、考纲要求
1. 了解元素、核素和同位素的含义。
2. 了解原子结构。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3. 了解原子核外电子的排布。
4. 了解化学键的定义。了解离子键、共价键的形成。
二、考题规律
原子结构的有关高考题多以信息题的形式出现。考查的内容:微粒的质子数、中子数、质量数、核外电子数、原子序数、核电荷数等相互求算。核外电子的排布除考查核外电子排布规律外,主要是将电子排布与分子构成联系起来考查,化学键是研究微粒间相互作用的基础理论,是在离子化合物和共价化合物以及原子结构和元素周期律等知识的基础上,介绍了离子键、共价键的知识,内容抽象,理论性强,概念多,常与原子结构等内容综合考查。
三、考向预测
预计今后的高考将以新材料、新发现、新科学成就、同位素的应用为题材考查原子结构、核素、同位素、元素、同系物、同素异形体、同分异构体等概念,考查以物质的量为核心的微粒结构之间关系的计算,这是高考命题的热点。我们在复习中要注意社会热点和新的科学成就,加强对概念的理解,注意对概念的应用。
一、原子结构
1. 构成原子的微粒
2. 符号 X 中各数字的含义
3. 原子核外电子的排布
(1)运动特征
①运动的空间范围小。②运动速率快。 ③质量轻。④电子运动的轨迹:不能测定。
(2)排布方式
电子层序号
1
2
3
4
5
6
7
表示符号
K
L
M
N
O
P
Q
离核距离
由近到远
电子能量
由低到高
(3)排布规律
①电子在原子核外距核由近及远,能量由低至高的不同电子层上分层排布。
②每层最多可容纳的电子数为2n2(n代表电子层数)。
③电子一般总是尽量先排在能量最低的电子层里,即最先排在K层,当K层排满后,再排L层,依次类推。
④最外层电子数不超过8个(或2个),次外层不超过18个,倒数第3层不超过32个。
二、元素、同位素、核素
(1)元素、核素、同位素之间的关系
(2)几种重要的核素
14C
重要用途
核能
用于考古断代
用于制造氢弹
三、化学键
1. 化学键的类型
化学键
类型
离子键
共价键
金属键
概念
阴阳离子间通过静电作用所形成的化学键
原子间通过共用电子对所形成的化学键
金属阳离子与自由电子间通过相互作用而形成的化学键
成键微粒
阴阳离子
原子
金属阳离子和自由电子
成键性质
静电作用
共用电子对
电性作用
形成条件
活泼金属与活泼的非金属元素
非金属与非金属元素
金属内部
实例
NaCl、MgO
HCl、H2SO4
Fe、Mg
2. 共价键的类型
非极性键
极性键
概念
同种元素原子形成的共价键,共用电子对没有发生偏移
不同种元素原子形成的共价键,共用电子对发生偏移
原子吸引电子能力
相同
不同
共用电子对
不偏向任何一方
偏向吸引电子能力强的原子
成键原子电性
电中性
显电性
形成条件
由同种非金属元素组成
由不同种非金属元素组成
3. 范德华力(分子间作用力)和氢键
(1)范德华力:即分子间作用力。
(2)氢键是一种既可以存在于分子间又可以存在于分子内部的作用力,比化学键弱,比范德华力强。
(3)范德华力、共价键与氢键的区别
①范德华力决定由分子构成的物质的熔点和沸点等。
②共价键的强弱决定分子的稳定性。
③氢键是远比范德华力强、比共价键弱的特殊的范德华力。含 F、O、N 等非金属性强、原子半径小的分子之间能形成氢键。如水、HF 等沸点高就是由于存在氢键。
4. 电子式
(1)原子的电子式
中性原子最外层电子数未发生变化,书写时应把最外层电子都一一表示出来。
(2)简单阴离子的电子式
若是非金属原子得到电子形成的简单阴离子,其最外层达8电子结构(H-最外层为2个电子),得到的电子数等于阴离子带的电荷数。在书写电子式时,不但要表示出最外层所有电子数(包括得到的电子),而且还应用方括号“[]”括起来,并在括号外的右上角注明阴离子所带的负电荷数。
(3)复杂离子的电子式
通常把带电荷的原子团称为复杂离子,也分为阳离子和阴离子。这种离子内的原子之间常以共价键结合。复杂离子都要用“[]”括起来,并在右上角标明电荷数。
(4)离子化合物的电子式
组成离子化合物的阴、阳离子的电子式按该离子化合物的化学式的个数排列起来的式子。相同的离子要对称分布,不可合并。
(5)共价分子的电子式
将组成共价分子的原子的电子式按该分子化学式的个数排列起来,能描述所含原子最外层电子数目及成键情况的式子。
聚焦热点1:构成原子微粒间的关系
例1 质子数和中子数相同的原子A,其阳离子An+核外共有x个电子,则A的质量数为( )
A. 2(x+n) B. 2(x-n) C. 2x D. n+2x
分析:阳离子An+核外共有x个电子,即失去n个电子后还有x个,原子原来有x+n个电子,质子数也为x+n,质子数和中子数相同,且质子数加中子数等于质量数,所以A的质量数为2(x+n)
答案:A
点评:此类题首先要看清提供的是阴离子还是阳离子的电子数,阳离子是原子失去电子形成的,所以求原子电子数要用离子的电子数加上已经失去的电子,阴离子是原子得到电子形成的,所以求原子电子数要用离子的电子数减去已经得到的电子。
例2 某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是( )
A. (A-N+m) mol B. (A-N) mol
C. (A+N) mol D. mol
分析:X原子的质子数为(A-N)个,一个HmX中所含的质子数为(A-N+m)个,HmX的摩尔质量为(A+m)g/mol,所以a g HmX中所含质子的物质的量为mol。
答案:D
点评:解决本题的关键是确定一个HmX中所含的质子数。
例3 某元素的一个原子形成的离子可表示为abXn-,下列说法正确的是( )
A. abXn-含有的中子数为a+b
B. abXn-含有的电子数为a-n
C. X原子的质量数为a+b+n
D. X原子的质量约为 g
分析:中子数等于质量数减去质子数,为b-a,A错;该离子含有的电子数为a+n,B错;原子变成离子时,质量数与核外电子数无关,所以X原子的质量数为b,C错;质量数为相对原子质量的近似整数值,所以b即为1 mol X原子的质量,则一个X原子的质量为 g,D正确。
答案:D
点评:这道题考查了构成原子的各微粒间的关系。这里需要注意的是所给的微粒是离子而非原子。
聚焦热点2:元素、核素、同位素
例1 (海南)是常规核裂变产物之一,可以通过测定大气或水中的含量变化来检测核电站是否发生放射性物质泄漏。下列有关的叙述中错误的是
A. 的化学性质与相同 B. 的原子序数为53
C. 的原子核外电子数为78 D. 的原子核内中子数多于质子数
分析:A选项考查同位素的化学性质相同这一知识点,B选项考查中数字的含义,C中电子数=53,故C错,D是中子数的计算。
答案:C
点评:本题考查同位素、核素,体现了社会热点问题。由于日本福岛核问题而使成为社会关注的焦点。这类题紧扣社会热点问题或主题,注意每年都可把与化学相关得热点、焦点作为备考点。
例2 ( 山东高考)16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )
A. 16O2与18O2互为同分异构体
B. 16O与18O核外电子排布的方式不同
C. 通过化学变化可以实现16O与18O间的相互转化
D. 标准状况下,1.12 L16O2和1.12 L18O2均含有0.1NA个氧原子
分析:A中是同一种物质,故A错;B中的两种氧原子的电子数相等,核外电子排布也相同,故B错;16O和18O之间的转化是原子核的变化,不是化学变化,故C错;1.12 L标准状况下O2的物质的量为0.05 mol,含有氧原子数为0.1NA,故D正确。
答案:D
点评:此题考查了同分异构体、电子排布等有关内容。一定要弄清同分异构体、同位素和同素异形体的区别。同时要明确化学反应的实质。
例3 有下列符号:35Cl和 37Cl、O2和O3、1H216O和2H218O。下列有关说法正确的是( )
A. 35Cl和 37Cl互称为同素异形体 B. O2和O3是氧元素的两种同位素
C. 35和37表示的是质量数 D. 1H216O和 2H218O表示同一种水分子
分析:35Cl和 37Cl是氯元素的两种同位素,A错。O2和O3是氧元素形成的两种性质不同的单质,是氧元素的两种同素异形体,B错。1H216O 由2个普通氢原子(1H)和1个16O原子构成,其质量数为18;而2H218O 由2个重氢原子(2H)和1个18O原子构成,其质量数为22,显然不是相同的水分子,D错。
答案:C
点评:本题重点考查了一些重要的概念。这也是高考的一个发展方向。在平时的学习中还是要深入去理解、掌握概念的内涵和外延。相似的概念还要把握其异同点。
聚焦热点3:核外电子排布及元素推断
聚焦热点3:核外电子排布及元素推断
例1 今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层恰为A原子L层电子数的2倍,A和B分别为( )
A. 硅原子和钠原子 B. 硼原子和氦原子
C. 氯原子和碳原子 D. 碳原子和铝原子
分析:根据题中信息,B原子的M层上肯定要有电子,则L层上已排满8个电子,A原子L层上是4个电子,A、B原子结构示意图分别为
答案:D
点评:抓住给定的信息是解元素推断题的关键,必要时还要会顺藤摸瓜。
例2 在第n电子层中,当它作为原子的最外层时,容纳电子数最多与(n-1)层相同。当它作为电子的次外层时,其电子数比(n-1)层多10个,则此电子层是( )
A. K层 B. L层 C. M层 D. N层
分析:由题意很容易排除A、B两项。M层作为最外层最多容纳8个电子,与L层相同;而当M层作为次外层时,最多容纳18个电子,比L层多10个。故本题答案为C。
答案:C
点评:此题要注意应用核外电子排布的原则。同时要注意这几条原则是相互制约的。
例3 (浙江高考)X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. XZ2、X2M2、W2Z2均为直线型的共价化合物
C. 由X元素形成的单质不一定是原子晶体
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
分析:X、Y、Z、M、W依次为C、N、O、H、Na。A. 错误,原子半径:C>N>O 。B. 错误,W2Z2即Na2O2为离子化合物。C. 石墨、C60等为非原子晶体。D. NH4HCO3为离子化合物,符合条件,反例CH3-NO2为共价化合物。
答案:C
点评:试题在推理判断能力的考查中渗透了结构、性质和用途等基础知识的考查。首先以具体元素推断为基础,运用周期表,结合周期律,考虑位、构、性关系推断X、Y、Z、W、M分别是什么元素。在此基础上应用知识解决题给选项的问题。
聚焦热点4:化学键
例1 下列有关化学用语使用正确的是 ( )
A. 硫原子的原子结构示意图:
B. NH4Cl的电子式:
C. 原子核内有10个中子的氧原子:O
D. CO2的电子式:
分析:A项是S2-的结构示意图;B项中没有标出Cl-的电子式,应表示为
D项CO2的电子式为 。故选C。
答案:C
点评:这道题易错选B或D。电子式书写时常见的错误①漏写未参与成键的电子,如:N2:,应写为:。②化合物类型不清楚,漏写或多写[ ]及错写电荷数。③书写不规范,错写共用电子对,如:N2的电子式为④ 不考虑原子最外层有几个电子均写成8电子结构。
例2 下列物质中含有相同的化学键类型的是( )
A. NaCl、HCl、H2O、NaOH B. Cl2、Na2S、HCl、SO2
C. HBr、CO2、H2O、CS2 D. Na2O2、H2O2、H2O、O3
分析:A项,NaOH、NaCl中均含有离子键,HCl、H2O中含有共价键;B项,Na2S中含有离子键,Cl2、HCl、SO2中含有共价键;C项,各物质都只含有共价键;D项,Na2O2中含有离子键和共价键,H2O2、H2O、O3均只含有共价键。
答案:C
点评:(1)离子化合物中一定存在离子键,如NaCl等,也可能含有离子键和共价键,如NaOH、Na2SO4等。而共价化合物中只存在共价键。
(2)共价键可以存在于离子化合物、共价化合物中,某些非金属单质中也存在共价键,如H2、O2、N2、Cl2等。稀有气体分子中不存在化学键。
例3 (全国卷)下列判断错误的是
A. 沸点: B. 熔点:
C. 酸性: D. 碱性:
分析:B考查不同类型晶体的熔沸点高低,一般认为是:原子晶体>离子晶体>分子晶体,所以B正确;C项正确,一般元素非金属性越强,对应最高价氧化物的水化物的酸性越强;D正确,一般元素金属性越强,对应最高价氧化物的水化物的碱性越强。A项错误,NH3分子间存在氢键,故最高,AsH3、PH3分子间不存在氢键,只有范德华力,组成和结构相似的分子相对分子质量越大,其分子间作用力越大,熔沸点越高,故应改为:NH3>AsH3>PH3;
答案:A
点评:考查基本概念:如晶体熔沸点高低的判断,氢键与范德华力对物质的物性的影响,金属性、非金属性的强弱判断方法的具体应用,这些都需平时反复训练。
一、同位素及相对原子质量
同
位
素
定义
具有相同质子数和不同中子数的同一元素的原子互称同位素
特性
1. 同一元素的各种同位素化学性质几乎完全相同.
2. 天然存在的某种元素里,不论是游离态还是化合态,各种同位素的原子含量一般是不变的.
判定
方法
它反映的是同种元素的不同原子间的关系.故单质、化合物间不可能是同位素。如H2和D2及H2O和D2O之间不存在同位素关系。只有质子数相同而中子数不同的原子才是同位素;如和是同位素,而和N不是同位素。
注意
天然存在的元素中,许多都有同位素(但并非所有元素都有同位素)。因而发现的原子种数多于元素的种数。
相对原子质量和近似相对原子质量
同位素的相对原子质量和近似相对原子质量
按初中所学的相对原子质量的求算方式是:一个原子的质量与一个12C原子质量的的比值。显然,所用原子质量是哪种同位素原子的质量,其结果只能是该同位素的相对原子质量。故该定义严格说应是同位素的相对原子质量。该比值的近似整值即为该同位素的近似相对原子质量,其数值等于该同位素的质量数。
元素的相对原子质量和近似相对原子质量
因天然元素往往不止一种原子,因而用上述方法定义元素的相对原子质量就不合适了。元素的相对原子质量是用天然元素的各种同位素的相对原子质量及其原子含量算出来的平均值。数字表达式为=M1×a1%+M2×a2%+……。若用同位素的质量数替代其相对原子量进行计算,其结果就是元素的近似相对原子质量(计算结果通常取整数)。我们通常采用元素的近似相对原子质量进行计算。
二、典型的微粒结构
1. 核外电子排布的特例归纳(短周期元素)
(1)最外层有1个电子的元素:H、Li、Na。
(2)最外层有2个电子的元素:He、Be、Mg。
(3)最外层电子数等于次外层电子数的元素:Be、Ar。
(4)最外层电子数是次外层电子数2倍的元素: C ;是次外层3倍的元素:O
(5)电子层数与最外层电子数相等的元素:H、Be、Al。
(6)电子总数为最外层电子数2倍的元素:Be。
(7)次外层电子数是最外层电子数2倍的元素:Li、Si。
(8)内层电子总数是最外层电子数2倍的元素:Li、P。
2. 核外电子数相等的微粒
练习题
(答题时间:60分钟)
一、选择题
1. 下列说法正确的是( )
A. 由分子组成的物质中一定存在共价键
B. 由非金属元素组成的化合物一定是共价化合物
C. 非极性键只存在于双原子单质分子里
D. 两种非金属元素原子间不可能形成离子键
2. 美国科学家将两种元素铅和氢的原子核对撞,获得了一种质子数为118,中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是( )
A. 57 B. 47 C. 61 D. 293
3. 已知某元素阴离子Rn-的原子核内的中子数为(A-x+n),其中A为原子的质量数。则mg Rn-中的电子总数为( )
A. B. C. D.
4. X、Y、Z和R分别代表四种元素,如果四种aXm+、bYn+、cZn-、dRm-离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是( )
A. a-c=m-n B. a-b=n-m C. c-d=m+n D. b-d=n+m
*5. (试题调研,天津十校联考)法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子被称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是( )
A. 该粒子不显电性 B. 该粒子质量数为4
C. 在周期表中与氢元素占同一位置 D. 该粒子质量比氢原子大
6. 下列说法正确的是( )
A. 原子中,核内中子数与核外电子数的差值为143
B. 纯碱CuSO4·5H2O和生石灰分别属于卤、混合物和氧化物
C. 凡是能电离出离子的化合物都是离子化合物
D. NH3硫酸钡和水分另属于非电解质、强电解质和弱电解质
7. 水是最宝贵的资源之一。下列表述正确的是( )
A. H2O的电子式为
B. 4℃时,纯水的pH=7
C. 中,质量数之和是质子数之和的两倍
D. 273K、101kPa,水分子间的平均距离:(气态)>(液态)>(固态)
8. 周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述中不正确的是( )
A. WZ2分子中所有原子最外层都为8电子结构
B. WX2、ZX2的化学键类型和晶体类型都相同
C. WX2是以极性键结合成的非极性分子
D. 原子半径大小顺序为X<W<Y<Z
9. 究太空的奥秘需要推进力强大的火箭。氢化锂(LiH)、氘化锂(LiD)、氚化锂(LiT)在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中。下列有关说法中,正确的是( )
A. LiH、LiD、LiT各1 mol 时,质量相同
B. LiH、LiD、LiT中氢元素的化合价均为+1价
C. H、D、T之间互称为同位素
D. LiH、LiD、LiT在反应中常作氧化剂
*10. (全国理综Ⅱ)短周期元素W、X、Y、Z的原子序数依次增大,且W、X、 Y+、 Z的最外层电子数与其电子层数的比值依次为2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述错误的是( )
A. X和其他三种元素均可形成至少2种二元化合物
B. W和X、Z两种元素分别形成的二元化合物中,均有直线型分子
C. W、X和Y三种元素可以形成碱性化合物
D. Z和其他三种元素形成的二元化合物,其水溶液均显酸性
11. 下列叙述中正确的是 ( )
A. O3和NO2都是共价化合物
B. 有化学键断裂的变化属于化学变化
C. 在离子化合物与共价化合物中,都不存在单个小分子
D. 在反应O3+2KI+H2O===2KOH+I2+O2中,参加反应的所有臭氧都作氧化剂
12. 有X和X+两种粒子,下列叙述正确的是 ( )
A. 一定都是由质子、中子、电子组成的
B. 化学性质几乎完全相同
C. 质子数一定相等,质量数和中子数一定不相等
D. 核电荷数和核外电子数一定相等
二、填空题
13. 在遭遇冰雪灾害时,经常使用一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
(1)m=________,该融雪剂的化学式为________.
(2)Z、W元素的名称为__________、__________.
(3)下列说法正确的是________.
A. XY2和WZ2都为离子化合物
B. XY2中仅含离子键,WZ2中仅含极性共价键
C. H2Z比HY的稳定性强
D. X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________.
A. XY2的电子式:X2+[]2-
B. WZ2的结构式:Z==W==Z
C. Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-===2Y-+Z↓
D. 用电子式表示XY2的形成过程为:
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是____.
14. A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10电子的化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的原子结构示意图为______________;化合物BA4的电子式为____________.
(2)化合物Y2X2中含有的化学键类型有________(填序号).
A. 离子键 B. 极性共价键 C. 非极性共价键 D. 氢键
(3)A与X和A与Z均能形成18个电子的化合物,这两种化合物发生反应的化学方程式为_________________________________________________________.
*15. X、Y、Z三种主族元素位于周期表中连续的三个不同周期。原子序数:Z>X>Y,其中Y原子的次外层电子数为2,X原子的次外层电子数与Y、Z原子的次外层电子数均不相同,X与Y的族序数之和等于Z的族序数。已知X的氢氧化物难溶于水,Y的最高价氧化物对应的水化物是一种强酸。由此推出:
(1)X是________,Y是________,Z是________。
(2)将X的单质投入到Z单质的水溶液中,观察到的现象是_______________,有关反应的化学方程式是_____________________。
(3)写出X的单质与Y的单质反应的化学方程式________________________________。
*16. A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E的电子数少8.
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,C元素在周期表中的位置为 ___________________,乙与甲的水溶液反应的离子方程式为____
(2)B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与
丙反应产生无色无味的气体,该反应的化学方程式为_______________________.
(3)“神舟七号”飞船上的能量主要来自太阳能和燃料电池,H2、O2和甲的水溶液可形成氢氧燃料电池,负极的电极反应为________________________,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为_______ NA.
(4)有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,与E的电子
数相同,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为_______________________,1 mol戊与过量盐酸反应的离子方程式是______________________,戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是________________________________;8 g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375 kJ的热量,写出该反应的热化学方程式_________________________________________.
练习题答案
1. D 解析:由分子组成的物质也可能是稀有气体,稀有气体为单原子分子,不存在化学键,A错;由非金属元素组成的化合物如NH4Cl是离子化合物,B错;非极性键不仅存在于双原子单质分子里,也存在于离子化合物(如Na2O2)和多原子共价化合物(如H2O2)中,C错;两种非金属元素原子间不能得失电子形成离子键,只能通过共用电子对形成共价键,D正确。
2. A
解析:对原子而言,核外电子数等于质子数,故中子数与核外电子数之差为:175-118。
3. D 解析:Rn-的原子核内的中子数为(A-x+n),原子的质量数为A,故原子的质子数为: A-(A-x+n)=x-n,原子的电子数也为x-n,Rn-的电子数为x,mgR n-中的电子总数就是。
4. D 解析:解析一:本题可用“抽象问题具体化”的方法来解
设m=1,n=2,可视Xm+为Na+, Yn+为Mg2+,Zn-为O2-,Rm-为F-,
则a=11,b=12,c=8,d=9,由此不难得出正确答案为D。
解法二:离子电子层结构相同,则核外电子数相等,故a-m=b-n=c+n=d+m,则通过变换得出正确答案为D。
*5. C 解析:“四中子”无质子,只有四个中子,所以A、B、D正确。
6. D 解析:A 项143 是中子数;B 项蓝矾是纯净物;C项共价化合物溶解于水也能电离出离子。
7. C 解析:本题主要考查有关水的化学基本用语。A项,水是共价化合物,其分子的电子式为;B项,温度升高,水的电离程度增大,α(OH-)=α(H+)<7;C项,一个分子中,其质量数为20,质子数为10,D项,在温度压强一定时,它只能呈一种状态。综上分析可知,本题选C项
8. D 解析:本题主要考查元素周期表和原子核外电子的排布及晶体结构等内容。由短周期元素Y原子的内层电子总数是其最外层电子数的2.5倍,可知Y为14号元素硅,由于W、X、Y、Z的原子序数依次增大,且W、Y为同一主族元素,所以W为碳元素;又由于W与X可形成共价化合物WX2,则X为氧元素;又由X、Z同主族知Z为硫元素;在CS2分子中所有原子最外层都是8电子结构,A正确;CO2与SO2都是共价化合物,且它们都是分子晶体,B正确;在CO2分子中CO键为极性键,而CO2分子为非极性分子,C正确;显然,C、O、Si、S四种原子的原子半径的大小关系为Si>S>C>O,故D选项不正确。
9. C 解析:H、D、T的中子数不同,即质量数不同;1 mol的LiH、LiD、LiT的质量不同,A错;Li为金属元素,只呈+1价,故LiH、LiD、LiT中氢元素的化合价均为-1价,B错;KH、D、T之间互称为同位素,C正确;由于在LiH、LiD、LiT中,氢元素处于-1价,易升高,故在反应中常作还原剂,D错。
*10. D 解析:W、X、Y、Z都是短周期元素,电子层都不超过3。Y+的最外层电子数与其电子层数的比值为4,Y+的最外层电子数只能为8,Y+的电子层数为2,故Y为Na;Z的原子序数大于Y,且最外层电子数与电子层数(3层)的比值为2,故Z为S;X为第2周期元素,X为O,四种元素都不是零族元素,W为C。O与其他三种元素都能形成至少2种二元化合物,A说法正确;CS2和CO2都是直线型分子,B说法正确;Na2CO3和NaHCO3都是显碱性的化合物,C说法正确;Na2S溶液显碱性,D说法错误。
11. D 解析:O3为单质,A项错误;化学变化的实质是旧化学键断裂和新化学键生成,仅有化学键断裂不是化学反应,如氯化钠溶于水,离子键断裂,属于物理变化,B项错误;离子化合物中不存在分子,共价化合物中有的不含有分子,如二氧化硅,有的却含有分子,如水、氯化氢等,C项错误;臭氧中的三个氧原子是按照一定方式结合的,虽然反应后有两个氧原子化合价没有变化,但臭氧作为一个整体,化合价发生了变化,D项正确。
12. C 解析:X、X+是同种元素的不同核素的原子和离子,A-Z可能为0即中子数可能为0,A错误;原子与离子的化学性质不同,B错误;C正确;X和X+的核电荷数相等,但核外电子数不相等,D错误。
13. 解析:(1)由X原子的结构示意图可推知其为,该元素为Ca,根据CaY2可知Y为-1价,又因为Y-与Ca2+的电子层结构相同,可知 Y为Cl.
(2)Z、W原子的最外层电子数是其电子层数的2倍,则Z、W是C或S.Z与Y相邻
则Z是S,W是C.
(3)CaCl2是仅含离子键的离子化合物,CS2是仅含极性键的共价化合物,A错误,B
正确;S的非金属性弱于Cl,则H2S的稳定性比HCl弱,C错误.Ca2+、Cl-具有相同的电子层结构,但Ca元素的核电荷数大,离子半径小,D错误.
(4)XY2为CaCl2,其电子式为[]-Ca2+[]-,H2S的水溶液显弱酸,应写成分子式,即Cl2+H2S===2H++2Cl-+S↓,A、C错误.
(5)氢键影响物质的熔沸点,使水的沸点升高。
答案:(1)20 CaCl2 (2)硫 碳 (3)B (4)B、D (5)水分子间存在氢键
14. 解析:(1)Y2X2与水反应生成X单质,其溶液可使酚酞试液变红,Y为Na,X为O.又X与Z同主族,则Z为S,A、B、X、Y、Z原子序数递增,B与Z最外层电子数之比为2∶3,B为C,又A与B和X均可形成10电子化合物,A为H.化合物BA4为CH4.(2)Y2X2为Na2O2,既含有离子键又含有非极性共价键.(3)H2O2具有氧化性,H2S具有强还原性,H2O2与H2S反应生成H2O和S。
答案:(1)
(2)AC
(3)H2O2+H2S===2H2O+S↓
*15. 解析:Y原子的次外层电子数为2,说明Y位于第二周期,同时Y的最高价氧化物对应的水化物是一种强酸,推得Y为N;结合“原子序数:Z>X>Y”,可知X位于第三周期,Z位于第四周期。又因为X原子的次外层电子数与Y、Z原子的次外层电子数均不相同,推得X的核外电子排布为2,8,x;Z的核外电子排布为2,8,18,z。第三周期元素的氢氧化物难溶于水的有Mg(OH)2或Al(OH)3,Y(N)位于第ⅤA族,Y、Z为主族元素,则可知X必定为Mg,推知Z为Br。
答案:(1)Mg N Br
(2)溴水褪色 Mg+Br2===MgBr2
(3)3Mg+N2 Mg3N2
*16. 解析:A、B、C、D、E都是短周期元素形成的离子,电子总数不超过18,而A、B、C、D四种离子的电子数均比E的电子数少8,则A、B、C、D是10电子离子,而E为18电子离子.
(1)A与B结合成的化合物甲中既有离子键又有共价键,甲可能为NaOH,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,则乙为Al(OH)3,A为OH-,B为Na+,C为Al3+,C元素在周期表中的位置为第三周期第ⅢA族,Al(OH)3溶于NaOH溶液的离子反应方程式为Al(OH)3+OH-===AlO+2H2O.
(2)B与E结合成化合物丙,其中离子数之比为2∶1,则丙为Na2O2,A与D结合成H2O,H2O与Na2O2反应产生无色无味的气体O2,该反应的化学方程式为:2Na2O2+2H2O===4NaOH+O2↑.
(3)H2、O2和NaOH的水溶液可形成氢氧燃料电池,负极的电极反应为:2H2+4OH--4e-===4H2O,当生成1.8 L饮用水时,电池内转移的电子数约为:×2×NA=200NA.
(4)n(N)∶n(H)=1∶2,且是18电子离子,故戊为N2H4;因为其分子结构中只有单键,与氨相似, 则戊的结构式为,它与盐酸的反应类似于NH3与盐酸的反应,故1 mol戊与过量盐酸反应的离子方程式为:N2H4+2H+===N2H.戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,这是因为戊中氮元素的化合价为-2价,处于氮的中间价态,既可以升高,又可以降低.1 mol N2H4完全反应放出的热量为×32 g=1 500 kJ,故该反应的热化学方程式为:N2H4(l)+2H2O2(l)===N2(g)+4H2O(g),ΔH=-1 500 kJ/mol.
答案:(1)第三周期第ⅢA族 Al(OH)3+OH-=== AlO+2H2O
(2)2Na2O2+2H2O===4NaOH+O2↑
(3)2H2+4OH--4e-===4H2O 200
(4);N2H4+2H+===N2H;戊中氮元素的化合价为-2价,既可以升高,又可以降低.N2H4(l)+2H2O2(l)===N2(g)+4H2O(g),ΔH=-1 500 kJ/mol
相关资料
更多








