
2020届二轮复习 考前增分秘笈二 回归教材实验 学案(全国通用)
展开
配制一定物质的量浓度的溶液
(1)主要仪器
(2)注意事项
①容量瓶:只有一个刻度线,只能配制瓶上规定容积的溶液,若配制480 mL溶液应用500 mL容量瓶。
②写所用仪器时,容量瓶必须注明规格。
③容量瓶使用之前必须查漏。
(3)误差分析依据:cB==
焰色反应
(1)步骤:洗—烧—蘸—烧—洗—烧。
(2)用品:铂丝或光洁无锈的铁丝、稀盐酸、样品。
(3)注意事项:焰色反应是物理变化;Na,
K的焰色:黄色、紫色(透过蓝色的钴玻璃)。
钠和过氧化钠
(1)取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的外皮。现象:在钠新切口处可以观察到银白色的金属光泽,切口处在空气中很快变暗(氧化成Na2O)。
(2)把一小块金属钠放在坩埚里加热。现象:钠先熔化成小球,然后燃烧,发出黄色火焰,生成淡黄色的固体(生成Na2O2)。
(3)向盛有水的小烧杯中滴入几滴酚酞溶液,把一小块钠放入水中。现象:钠浮在水面上(密度比水小),熔成小球(反应放热、钠的熔点低),小球四处游动,并有嘶嘶的响声(有气体产生),溶液变为红色(生成碱性物质)。
(4)把水滴入盛有少量Na2O2固体的试管中,立即把带火星的木条放在试管口,检验生成的气体,该反应放出大量的热,同时产生O2。
鉴别Na2CO3和NaHCO3
分别用Na2CO3和NaHCO3做实验,观察现象。
药品 | 现象 | 化学方程式 | 结论 |
Na2CO3 | 澄清的石灰 水不变浑浊 | — | Na2CO3加热不分解 |
NaHCO3 | 澄清的石灰 水变浑浊 | 2NaHCO3 Na2CO3+H2O +CO2↑ | NaHCO3加热分解能生成CO2 |
铝箔在空气中加热
步骤 | 用坩埚钳夹住一小块铝箔在酒精灯上加热至熔化,轻轻晃动 | 再取一小块铝箔,用砂纸仔细打磨(或在酸中处理后用水洗净),除去表面的保护膜,再加热至熔化 |
现象 | 铝箔发红卷缩,变暗失去光泽,熔化的铝并不滴落 | 铝箔发红卷缩,很快就变暗失去光泽,熔化的铝仍不滴落 |
原因 | 氧化铝的熔点高于铝的熔点,包裹在铝的外面,使熔化了的铝不会滴落下来 | 铝很活泼,除去原来的氧化膜后,在加热时又很快生成一层新的氧化膜 |
结论 | ①铝容易被氧化而生成一层致密的氧化膜:4Al+3O22Al2O3 ②氧化铝的熔点比铝的熔点高 | |
铝热反应
(1)药品:氧化铁、铝粉、氯酸钾固体、镁条。
(2)原理:Fe2O3+2Al2Fe+Al2O3。
(3)注意事项:①蒸发皿要垫适量的细沙:一是防止蒸发皿炸裂,二是防止熔融的液体溅出伤人。②铝粉与FeO、Fe3O4、CuO、Cu2O、MnO2、Cr2O3等发生铝热反应。
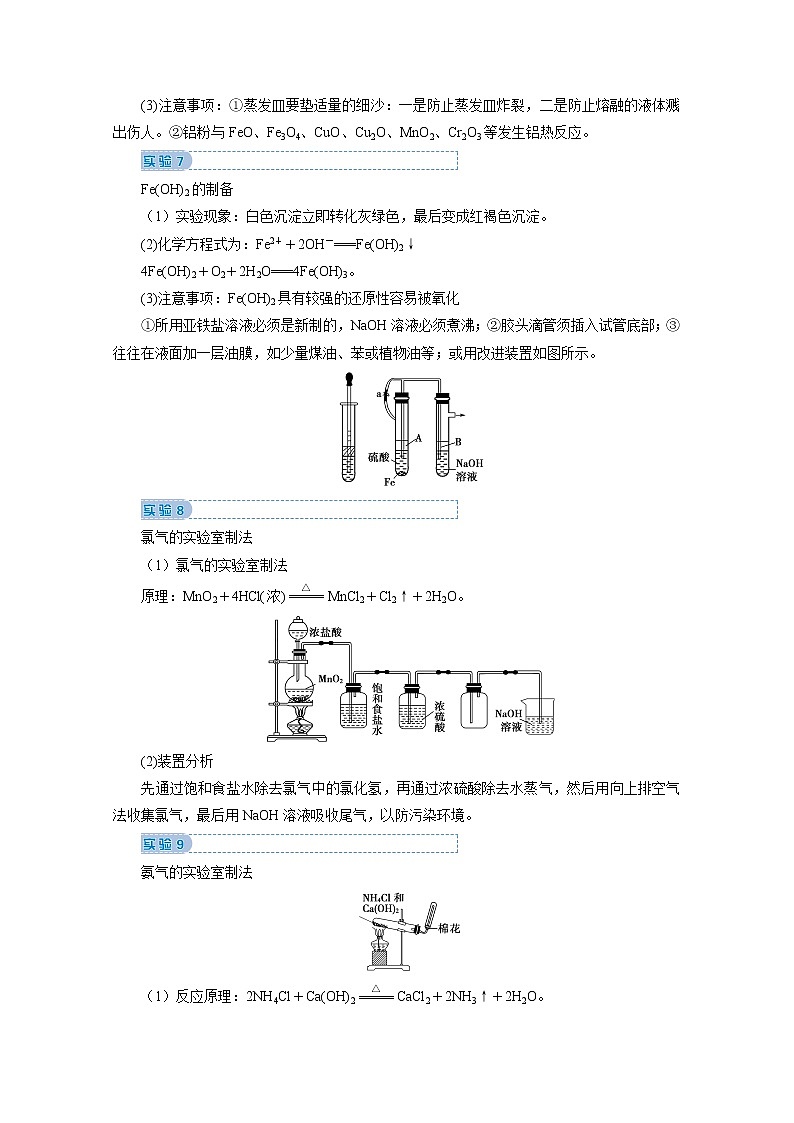
Fe(OH)2的制备
(1)实验现象:白色沉淀立即转化灰绿色,最后变成红褐色沉淀。
(2)化学方程式为:Fe2++2OH-===Fe(OH)2↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3。
(3)注意事项:Fe(OH)2具有较强的还原性容易被氧化
①所用亚铁盐溶液必须是新制的,NaOH溶液必须煮沸;②胶头滴管须插入试管底部;③往往在液面加一层油膜,如少量煤油、苯或植物油等;或用改进装置如图所示。
氯气的实验室制法
(1)氯气的实验室制法
原理:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。
(2)装置分析
先通过饱和食盐水除去氯气中的氯化氢,再通过浓硫酸除去水蒸气,然后用向上排空气法收集氯气,最后用NaOH溶液吸收尾气,以防污染环境。
氨气的实验室制法
(1)反应原理:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。
(2)气体制备流程:原理—发生装置—除杂干燥—收集—验满—尾气处理。
(3)注意事项:①制备装置中试管口要略低于试管底,收集装置中导管应插入试管底部。
②浓氨水(或浓铵盐溶液)溶液滴到生石灰或烧碱中制氨气,或浓氨水直接加热也可制氨气。
③不能使用NH4Cl和NH4HCO3制备。
喷泉实验
(1)实验原理:①氨气极易溶于水;②利用压强变化。
(2)注意事项:①氨气应充满;②烧瓶应干燥;③装置不得漏气。
(3)实验拓展:①NH3、HCl、HBr、HI、SO2等气体均能溶于水形成喷泉。②CO2、H2S、Cl2等与水不能形成喷泉,但与NaOH溶液可形成喷泉。
铜与浓硫酸反应的实验
(1)实验原理:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(2)现象:加热之后,试管中的紫色石蕊试液变红(或试管中的品红溶液褪色);将反应后的溶液倒入盛有水的烧杯中,溶液由黑色变成蓝色。
(3)原因解释:变黑的物质为被浓硫酸氧化生成CuO,CuO与稀释的硫酸反应生成了CuSO4溶液。
中和热实验
(1)原理:稀的酸与碱发生中和反应生成1 mol液态水时所释放的热量。酸、碱分别是强酸、强碱。对应的方程式:
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。
[H2SO4和Ba(OH)2反应的离子方程式不一样]
(2)注意事项:①中和热数值固定不变,它与燃烧热一样,因具有明确的含义,故文字表达时不带负号,说放出热量即可。
②为了减少误差,必须确保热量尽可能的少损失,实验重复两次,用测量数据的平均值作计算依据。
③为了保证酸碱完全中和常采用OH-稍稍过量的方法。
④实验若使用了弱酸或弱碱,因中和过程中电离吸热,会使测得的中和热数值偏小。
(1)原理:c酸V酸=c碱V碱。
(2)主要仪器:酸式或碱式滴定管、锥形瓶、烧杯、铁架台、滴定管夹。
(3)主要试剂:待测液、标准液、指示剂(酚酞、甲基橙)。
(4)关键点:①准确测量体积;②准确判断滴定终点。
(5)操作步骤:①查漏、洗涤、润洗;②装液、赶气泡、调液面、注液(放入锥形瓶中);③滴定:眼睛注视锥形瓶中溶液颜色的变化,当滴到最后一滴,溶液颜色发生明显变化且半分钟内不变色即为滴定终点。
(6)注意事项:
①0刻度在滴定管的上端,注入液体后,仰视读数数值偏大;
②使用滴定管时的第一步是查漏;
③滴定读数时,记录到小数点后两位;
④酸、碱式滴定管不能混用,如酸、具有氧化性的物质一定用酸式滴定管盛装;
⑤滴定管必须用溶液润洗,锥形瓶不能润洗;
⑥滴定时一般用酚酞、甲基橙作指示剂,不用石蕊试液,指示剂用2~3滴;
⑦数据处理:求算2~3次实验的标准液体积的平均值,然后求浓度。
氯碱工业
(1)实验原理:电解饱和的食盐水的反应为:
阳极:2Cl--2e-===Cl2↑
阴极:2H++2e-===H2↑
电解的离子方程式为:
2Cl-+2H2O2OH-+H2↑+Cl2↑。
(2)电极产物判断:阴极产物是H2和NaOH,若在阴极区附近滴几滴酚酞试液,可发现阴极区附近溶液变红;阳极产物是氯气,将湿润的KI淀粉试纸放在阳极附近,试纸变蓝。
铜的精炼
(1)电解法精炼铜的原理:
阳极(粗铜):Cu-2e-===Cu2+
阴极(纯铜):Cu2++2e-===Cu
(2)电极和电解质溶液变化:粗铜中含有Zn、Ni、Fe、Ag、Au等多种杂质,位于金属活动性顺序表铜以前的金属杂质,如Zn、Ni、Fe等也会同时失去电子,位于金属活动性顺序表铜之后的银、金等杂质形成“阳极泥”,电解质溶液中Cu2+逐渐变小。
将NO2球浸泡在冰水、热水中,观察颜色变化
将NO2球浸泡在冰水中颜色变浅,放入热水中颜色变深。
乙酸乙酯的制备
(1)原理
CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O
副反应:C2H5—OH+HO—C2H5
C2H5—O—C2H5+H2O
C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(2)注意事项:
①先加乙醇,再加浓硫酸和乙酸的混合液(浓硫酸不能最先加入);低温加热小心均匀地进行,以防乙酸、乙醇的大量挥发和液体剧烈沸腾;②导气管末端不要插入饱和Na2CO3溶液中,防液体倒吸。浓硫酸作用是催化剂、吸水剂。
(3)饱和Na2CO3溶液的作用:
①吸收乙酸,便于闻乙酸乙酯的香味;②溶解乙醇;③降低乙酸乙酯的溶解度。
.催化氧化
乙醇的氧化反应
1.催化氧化
(1)现象:铜丝在酒精灯上灼烧,铜丝由红色变为黑色。伸入乙醇中,黑色又变为红色。试管中产生刺激性气味的气体。
(2)注意事项
①铜丝下端绕成螺旋状,可以增大接触面积,加快反应速率。
②铜丝在乙醇的氧化中起催化作用(参加反应)。2Cu+O22CuO,CH3CH2OH+CuOCH3CHO+H2O+Cu。
2.强氧化剂氧化
(1)现象:溶液由橙黄色变为绿色。
(2)注意事项:
乙醇被K2Cr2O7酸性溶液氧化,其氧化过程分两步,第一步氧化成乙醛,第二步乙醛继续被氧化成乙酸。引申:乙醇可以使酸性KMnO4溶液褪色。
检验蔗糖的水解产物是否具有还原性
(1)操作
(2)注意事项:加入新制的Cu(OH)2或银氨溶液之前需先加入NaOH使溶液呈碱性,否则会导致实验失败。








