

2020届高考化学二轮复习电化学原理应用——化学电源与电解技术作业 练习
展开题型层级练7 电化学原理应用——化学电源与电解技术
授课提示:对应学生用书133页
(A级)
1.根据光合作用原理,设计如图原电池装置。下列说法正确的是( )
A.a电极为原电池的正极
B.外电路电流方向是a→b
C.b电极的电极反应式为:O2+2e-+2H+===H2O2
D.a电极上每生成1 mol O2,通过质子交换膜的H+为2 mol
解析:根据图示可知,a电极上H2O转化为H+和O2,发生氧化反应,则a电极为原电池的负极,A项错误;a电极为负极,b电极为正极,外电路电流方向应从正极到负极,即b→a,B项错误;根据图示可知,b电极上O2得电子转化为H2O2,电极反应式为:O2+2e-+2H+===H2O2,C项正确;a电极上每生成1 mol O2,转移4 mol电子,则通过质子交换膜的H+为4 mol,D项错误。
答案:C
2.甲醇燃料电池是目前应用比较广泛的一种燃料电池,其工作原理如下图所示:
下列说法正确的是( )
A.N为正极,发生氧化反应
B.a气体为氧气,b气体为甲醇
C.甲池溶液pH增大,乙池溶液pH减小
D.若有1 mol CO2生成,则有6 mol H+从甲池透过交换膜进入乙池
解析:燃料电池工作时,燃料发生氧化反应,失去电子,故M电极为负极,a气体为甲醇,电极反应式为:CH3OH+H2O-6e-===CO2↑+6H+,甲醇在负极被氧化生成CO2。有1 mol CO2生成,则有6 mol H+生成,甲池溶液pH减小。N电极为正极,在其表面发生还原反应;电池中,阳离子从负极移向正极,H+从甲池通过交换膜进入乙池。故D选项正确,A、B、C选项错误。
答案:D
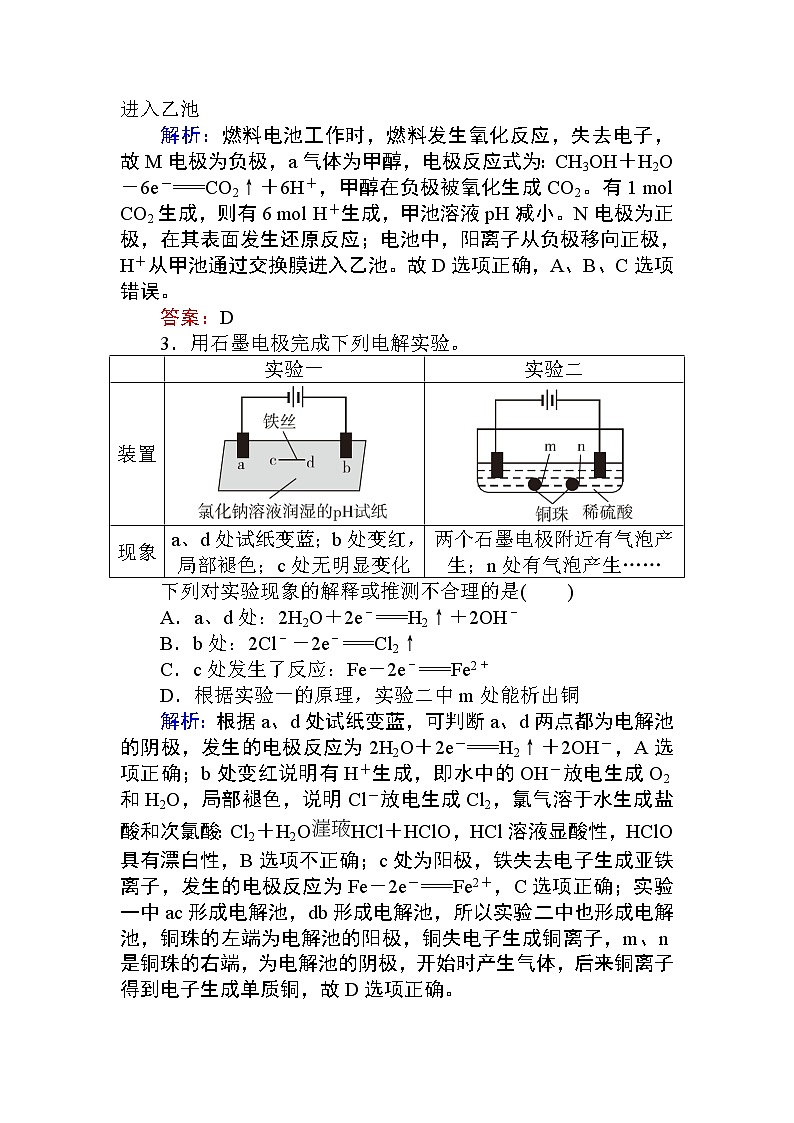
3.用石墨电极完成下列电解实验。
| 实验一 | 实验二 |
装置 | ||
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A.a、d处:2H2O+2e-===H2↑+2OH-
B.b处:2Cl--2e-===Cl2↑
C.c处发生了反应:Fe-2e-===Fe2+
D.根据实验一的原理,实验二中m处能析出铜
解析:根据a、d处试纸变蓝,可判断a、d两点都为电解池的阴极,发生的电极反应为2H2O+2e-===H2↑+2OH-,A选项正确;b处变红说明有H+生成,即水中的OH-放电生成O2和H2O,局部褪色,说明Cl-放电生成Cl2,氯气溶于水生成盐酸和次氯酸:Cl2+H2OHCl+HClO,HCl溶液显酸性,HClO具有漂白性,B选项不正确;c处为阳极,铁失去电子生成亚铁离子,发生的电极反应为Fe-2e-===Fe2+,C选项正确;实验一中ac形成电解池,db形成电解池,所以实验二中也形成电解池,铜珠的左端为电解池的阳极,铜失电子生成铜离子,m、n是铜珠的右端,为电解池的阴极,开始时产生气体,后来铜离子得到电子生成单质铜,故D选项正确。
答案:B
4.如图所示装置,开关K闭合时,电流表指针发生偏转,下列有关开关K闭合时的说法正确的是( )
A.b极是负极
B.a极电极反应式为H2-2e-===2H+
C.当装置中有1 mol电子通过时,右池产生标准状况下5.6 L气体
D.电池总反应式为2H2+O2===2H2O
解析:选项A,通入H2的一极为负极,则a极为负极,b极为正极,错误。选项B,左池的电解质为NaOH,则a极电极反应式为2OH-+H2-2e-===2H2O,错误。选项C,b极电极反应式为O2+4H++4e-===2H2O,当通过1 mol电子时,右池消耗标准状况下O2 5.6 L,错误。
答案:D
5.利用微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。电池工作时,下列说法正确的是( )
A.a极为正极,发生氧化反应
B.b极的电极反应式为:2NO+12H+-10e-===N2↑+6H2O
C.中间室的Cl-向左室移动
D.左室消耗苯酚(C6H5OH)9.4 g时,用电器流过2.4 mol电子
解析:由题图可知,在b极上NO转化为N2,发生得电子的还原反应,故b极为正极,a极为负极,A项错误;b极的电极反应式为2NO+12H++10e-===N2↑+6H2O,B项错误;原电池中阴离子向负极移动,故C项正确;左室消耗苯酚的电极反应式为C6H5OH-28e-+11H2O===6CO2↑+28H+,9.4 g苯酚的物质的量为0.1 mol,故用电器应流过2.8 mol电子,D项错误。
答案:C
6.工业上联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是( )
A.a电极的电极反应式为:2H++2e-===H2↑
B.产物丙为硫酸
C.离子交换膜d为阴离子交换膜
D.每转移0.1 mol电子,产生1.12 L的气体乙
解析:根据题图并结合题意,同温同压下,气体甲与气体乙的体积比约为1:2,知甲为O2,乙为H2,则a电极上OH-放电,产生氧气,电极反应式为:2H2O-4e-===4H++O2↑,A项错误;a电极为阳极,阳极上OH-放电,SO向阳极移动,因此产物丙为硫酸,B项正确;b电极为阴极,阴极上H+放电,Na+向阴极移动,则d为阳离子交换膜,C项错误;根据b电极的电极反应:2H2O+2e-===H2↑+2OH-,知每转移0.1 mol电子,产生标准状况下1.12 L气体乙(H2),D项错误。
答案:B
7.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是( )
A.HS-在硫氧化菌作用下转化为SO的反应为HS-+4H2O-8e-===SO+9H+
B.电子从电极b流出,经外电路流向电极a
C.如果将反应物直接燃烧,能量的利用率不会变化
D.若该电池电路中有0.4 mol电子发生转移,则有0.5 mol H+通过质子交换膜
解析:根据题图知,在硫氧化菌作用下HS-转化为SO,发生氧化反应:HS-+4H2O-8e-===SO+9H+,A项正确;电子从电极a流出,经外电路流向电极b,B项错误;如果将反应物直接燃烧,有部分化学能转化为热能和光能,能量的利用率降低,C项错误;若该电池电路中有0.4 mol电子发生转移,则有0.4 mol H+通过质子交换膜,D项错误。
答案:A
8.法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可植入人体为人造器官提供电能的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生反应:C6H12O6+6O26CO2+6H2O(酸性环境)。下列有关该电池的说法不正确的是( )
A.该生物燃料电池不可以在高温下工作
B.电池的负极反应为C6H12O6+6H2O-24e-===6CO2↑+24H+
C.消耗1 mol氧气时转移4 mol e-,H+向负极移动
D.今后的研究方向是设法提高葡萄糖生物燃料电池的效率,从而使其在将来可以为任何可植入医疗设备提供电能
解析:酶在高温下会变性,失去催化活性,所以该生物燃料电池不可以在高温下工作,A项正确;电池中C6H12O6在负极发生氧化反应,负极反应为C6H12O6+6H2O-24e-===6CO2↑+24H+,B项正确;原电池反应中,阳离子向正极移动,C项错误;提高葡萄糖生物燃料电池的效率肯定是今后的研究方向,D项正确。
答案:C
(B级)
9.我国科学家设计出的一种装置(如图所示),实现了“太阳能→电能→化学能”的转化,总反应为2CO2===2CO+O2。下列有关说法正确的是( )
A.该装置属于原电池
B.人体呼出的水蒸气参与Y极反应:
CO2+H2O+2e-===CO+2OH-
C.反应完毕,该太阳能装置中的电解质溶液碱性增强
D.X极电极反应式为O2+2H2O+4e-===4OH-
解析:该装置实现了太阳能→电能→化学能的转化,而将电能转化为化学能属于电解池,A项错误;由图可知Y极发生的是得电子的反应,人体呼出的气体中含有CO2和H2O,B项正确;由得失电子守恒原理知,X极消耗的OH-总量等于Y极生成的OH-总量,即电解质溶液的碱性没有改变,C项错误;从电子的流向看,X电极失去电子,故X电极是负极,电极反应式为4OH--4e-===2H2O+O2↑,D项错误。
答案:B
10.我国对“可呼吸”的钠二氧化碳电池的研究取得突破性进展。该电池的总反应式为:4Na+3CO22Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体储存于碳纳米管中)。下列说法不正确的是( )
A.放电时,钠金属片作负极,碳纳米管作正极
B.充电时,阳极反应为:2Na2CO3+C-4e-===3CO2↑+4Na+
C.放电时,Na+从负极区向正极区移动
D.该电池的电解质溶液也可使用NaClO4的水溶液
解析:A.放电时为原电池反应,钠金属片失去电子作负极,碳纳米管上得电子作正极,故A正确;B.充电时,阳极失去电子发生氧化反应,反应为C+2Na2CO3-4e-===3CO2↑+4Na+,故B正确;C.放电时,阳离子向正极移动,则Na+从负极区向正极区移动,故C正确;D.钠与水反应,不能用水溶液代替TEGDME作溶剂,故D错误。
答案:D
11.正、负极都是碳材料的双碳性电池,电池充、放电过程为2nC+LiACnA+LiCn,充电时Li+、A-分别吸附在两极上形成LiCn和CnA(如图所示),下列说法正确的是( )
A.a是电池的负极
B.放电时,A-向b极移动
C.放电时,负极的电极反应式是nC-e-+A-===CnA
D.充电时,电解质中的离子总数保持不变
解析:充电时A-吸附在a极形成CnA,则a极为阳极,发生氧化反应,而放电时a极发生还原反应,故a为电池的正极,A项错误;放电时a为正极,b为负极,而放电时阴离子向负极移动,B项正确;放电时负极上发生氧化反应:LiCn-e-===nC+Li+,C项错误;充电时Li+、A-分别吸附在两极上形成LiCn和CnA,故电解质中的离子总数逐渐减小,D项错误。
答案:B
12.已知某种微生物燃料电池的工作原理如图所示。下列说法正确的是( )
A.电流的流动方向:B极A极
B.溶液中的H+由B极区移向A极区
C.在高温下,该微生物燃料电池的工作效率更高
D.A极的电极反应式为CH3COOH-8e-+8OH-===2CO2+6H2O
解析:结合工作原理图示,该电池实质是酸性条件下的CH3COOH作燃料的燃料电池。A极为负极,B极为正极,电流的流动方向:B→A,H+(阳离子)移向正极区,A正确、B错误。C.该电池为微生物燃料电池,在高温条件下微生物不能存活,C错误;D.该电池为酸性环境,在电极反应中不可能出现OH-,D错误,配平A极电极反应式应为CH3COOH-8e-+2H2O===2CO2↑+8H+。
答案:A
13.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2===6CO2+6H2O
解析:由电池结构图可知,在正极上氧气得到电子发生还原反应,与移向正极的H+反应生成水,A错误;微生物在反应中促进葡萄糖的氧化,即促进了电子的转移,B正确;利用原电池工作原理知,质子可通过质子交换膜由负极区移向正极区,C正确;该电池的总反应为葡萄糖发生氧化反应生成二氧化碳和水,D正确。
答案:A
14.锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示。下列说法正确的是( )
A.该电池放电时,正极的反应式为O2+4e-+4H+===2H2O
B.该电池充电时,阴极发生了氧化反应:Li++e-===Li
C.电池中的有机电解液可以用稀盐酸代替
D.正极区产生的LiOH可回收利用
解析:正极的反应式为O2+4e-+2H2O===4OH-,A项错误;电池充电时,阴极发生还原反应,B项错误;有机电解液不能用稀盐酸代替,因为金属锂与稀盐酸能发生反应,C项错误。
答案:D
15.H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )
A.M室发生的电极反应式为2H2O-4e-===O2↑+4H+
B.N室中:a%<b%
C.b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D.理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
解析:制备原理是原料室中[B(OH)4]-通过阴膜(b膜)进入产品室,M室中石墨电极上H2O放电产生O2和H+,H+通过阳膜(a膜)进入产品室,H++[B(OH)4]-===H3BO3+H2O,A正确,C正确;原料室中的Na+通过阳膜(c膜)进入N室,N室中石墨电极上H2O放电产生H2和OH-,因而N室中NaOH溶液的浓度会增大,B正确;理论上每生成1 mol产品,M、N室电极反应式分别为2H2O-4e-===O2↑+4H+、2H2O+2e-===H2↑+2OH-,阴极室(N室)生成0.5 mol H2,标准状况下为11.2 L,D错误。
答案:D








