

【化学】安徽省涡阳县第一中学2019-2020学年高二上学期寒假作业化学试题(一)
展开安徽省涡阳县第一中学2019-2020学年高二上学期寒假作业化学试题(一)
第I卷(选择题)
一、选择题(本题共有20小题,每题3分,共60分)
1.下列有关物质分类或归类中,正确的是( )
A.混合物:盐酸、氢氧化铁胶体、氯水、玻璃B.碱性氧化物:Na2O、MgO、MnO2、K2O
C.电解质:NaHSO4、石墨、CO2、NH4ClD.酸性氧化物:CaO、CO2、SiO2、SO3
2.欲除去下列物质中的杂质(括号内物质为杂质),所用试剂不正确的是()
A.KNO3溶液(K2SO4):适量Ba(NO3)2溶液
B.CaCO3粉末(CaCl2):过量盐酸
C.Cu粉(Zn粉):过量盐酸
D.CO2(O2):灼热的铜网
3.NA代表阿伏加德罗常数,下列说法正确的是( )
A.在同温同压时,相同体积的任何气体单质所含的分子数目相同
B.2g氢气所含原子数目为NA
C.在常温常压下, 11.2L氮气所含的原子数目为NA
D.17g氨气所含氢原子数目为NA
4.离子方程式Ba2+ + OH— + H+ + SO42—→ BaSO4↓ + H2O可以表示Ba(OH)2溶液与( )
A.少量稀硫酸的反应 B.足量稀硫酸的反应
C.少量NaHSO4溶液的反应 D.足量NH4HSO4溶液的反应
5.某反应的氧化剂与还原剂及部分产物如下所示:2Mn2+ + 5IO4— + …… → 2MnO4— + ……已知该反应体系还包括H+、H2O与另一种含碘微粒。对于该氧化还原反应说法正确的是( )
A.Mn2+是氧化剂,IO4—是还原剂
B.体系中另一种含碘微粒为I—
C.随着反应进行,溶液pH不断上升
D.每有1 mol IO4—参加反应,转移2 mol电子
6.常温下,下列各组离子一定能在指定溶液中大量共存的是()
A.c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
B.滴加KSCN溶液显红色的溶液中:NH4+、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、SO42-
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
7.铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是( )
A.①、②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
8.化学在生产、生活中有着重要用途,下列对物质的用途、解释都正确的是( )
选项 | 物质 | 用途 | 解释 |
A | H2O2 | 消毒剂 | H2O2具有强氧化性,可杀菌 |
B | SiO2 | 计算机芯片 | SiO2是一种良好的半导体 |
C | Fe3O4 | 红色涂料 | Fe3O4是一种红色氧化物 |
D | 浓H2SO4 | 干燥剂 | 浓H2SO4有脱水性 |
9.下列各组物质之间的转化不是全部通过一步反应完成的是( )
A.Na→NaOH→Na2CO3→NaCl B.Al→Al2O3→Al(OH)3→AlCl3
C.Mg→MgCl2→Mg(OH)2→MgSO4 D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
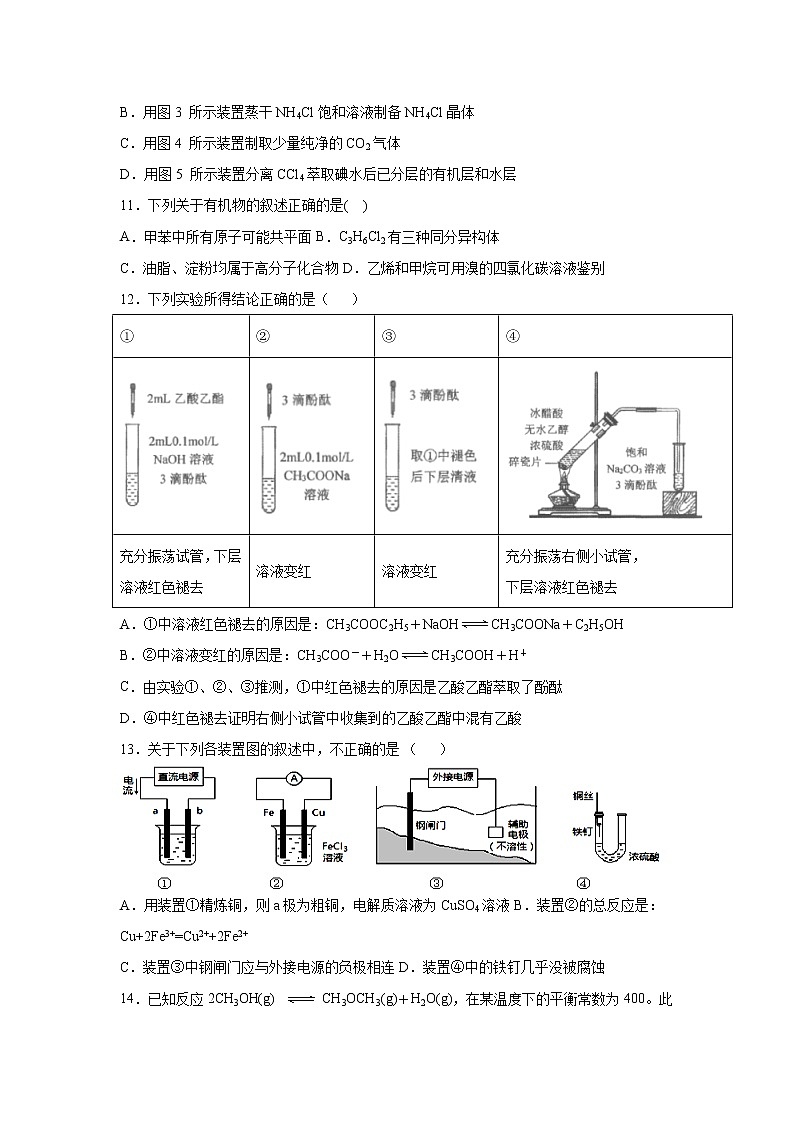
10.用下列实验装置进行相应实验,能达到实验目的的是()
A.用图2所示装置除去Cl2中含有的少量HCl
B.用图3 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图4 所示装置制取少量纯净的CO2气体
D.用图5 所示装置分离CCl4萃取碘水后已分层的有机层和水层
11.下列关于有机物的叙述正确的是( )
A.甲苯中所有原子可能共平面B.C3H6Cl2有三种同分异构体
C.油脂、淀粉均属于高分子化合物D.乙烯和甲烷可用溴的四氯化碳溶液鉴别
12.下列实验所得结论正确的是( )
① | ② | ③ | ④ |
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOHCH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2OCH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
13.关于下列各装置图的叙述中,不正确的是 ( )
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连D.装置④中的铁钉几乎没被腐蚀
14.已知反应2CH3OH(g) CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是( )
A.该反应的平衡常数表达式为K=
B.平衡时c(CH3OH)=0.04 mol·L-1
C.该时刻正、逆反应速率的大小:v正<v逆
D.若加入CH3OH后,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1
15.常温下,向的溶液中逐滴滴加的溶液。溶液随滴入溶液体积变化如图所示。下列说法正确的是( )
A.点的
B.点时,
C.点时,
D.从a→d,水的电离度先增大后减小
16.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示。下列说法正确的是( )
A.放电时,电极A为正极
B.充电时,Na+ 从电极A向电极B迁移
C.充电时,电极B反应式为S22-- 2e- === xS
D.该电池工作的适宜温度应控制在25 ℃左右
17.下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是( )
A.由水电离的c(H+):①=②>③=④
B.向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>①>②
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
18.已知某一温度下,0.1mol·L-1的NaHA强电解质溶液中,c(H+)<c(OH-)。则下列关系一定不正确的是( )
A.c(Na+)=c(HA-)+2c(A2-)+c(OH-)
B.c(H2A)+c(HA-)+c(A2-)=0.1mol·L-1
C.将上述溶液稀释至0.01mol/L,c(H+)·c(OH-)不变
D.c(A2-)+c(OH-)=c(H+)+c(H2A)
19.下列事实,不能用勒夏特列原理解释的是( )
A.合成氨控制在500℃左右的温度
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.氨水中加酸,NH4+的浓度增大
20.锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是( )
A.CaCO3的溶解度小于CaSO4
B.沉淀转化的实质是沉淀溶解平衡的移动
C.沉淀转化的难易与溶解度差别的大小无关
D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡
第II卷(非选择题)
21.(每空2分,共16分)元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4,M原子的最外层电子数与次外层电子数之比为3∶4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,Q和Y在周期表中的位置相邻。请回答下列问题。
(1)M原子的价电子排布图是__________,Q的常见氢化物的立体构型是_________________。
(2)写出X、Y、R按原子个数之比1∶1∶1形成的化合物的结构式:_______________。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:___。
(4)写出单质R的一种工业用途:_______________。
(5)图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,写出该转化过程的化学方程式:_______。
(6)由X、Y、Z、M四种元素可形成一种离子化合物A,已知A既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式:_ ____。
(7)科学家认为存在QX5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式:______________。
22.(每空2分,共12分)I.二甲醚是一种重要的清洁燃料.合成二甲醚是解决能源危机的研究方向之一.
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
已知:CO(g)+2H2(g)═CH3OH(g)△H1=﹣90.1kJ/mol
CO(g)+H2O(g)═CO2(g)+H2(g)△H2=﹣41.1kJ/mol
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H3=﹣24.5kJ/mol
则反应2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=____________.
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率.利用二甲醚酸性介质燃料电池电解200mL饱和食盐水(惰性电极),电解一段时间后,阴极收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的正极反应式为_____________________________.
②请写出电解食盐水的化学方程式____________________.
③电解后溶液的pH=_________.
II.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
(3)点③所示溶液中所有离子的浓度由大到小的顺序为:_________。点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O422-)=_____mol/L。
23.(每空2分,共12分)弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-H++A2-。
①NaHA溶液的呈___填酸性、碱性或中性),原因是(结合化学用语说明)。
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是___。
A.c(H+)·c(OH-)=1×10-14B.c(Na+)+c(K+)=c(HA-)+2c(A2-)C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有__。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
④(CaA)的饱和溶液中存在平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0,加入Na2A固体,Ksp会___(填“变大”或“变小”或“不变”)
(2)常温下,若在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
【参考答案】
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | A | B | A | C | D | A | C | A | B | D |
题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
答案 | D | D | B | B | D | C | D | A | A | C |
21. 三角锥形 H-O-Cl 2H2O22H2O+O2↑制漂白粉(或制漂白液、用于自来水消毒等合理答案均可)
2SO2+O22SO3 HSO3-+H2O+Cl2=SO42-+2Cl-+3H+
NH5+H2O=H2↑+NH3·H2O 或 NH5+H2O=H2↑+NH3↑+H2O 或 NH5=H2↑+NH3↑
22.﹣122.5 kJ·mol﹣1 O2+4e﹣+4H+=2H2O
2NaCl+2H2O2NaOH+Cl2↑+H2↑ 14
c(K+)>c(HC2O4―)>c(H+)>c(C2O42-)>c(OH―) 0.10
23.酸性,HA-H++A2- BC BD 不变 2.2×10-8








