

北京市2020届高三中学生标准学术能力诊断性测试(11月) 化学
展开中学生标准学术能力诊断性测试2019年11月测试
化学试卷(一卷)
本试卷共300分,考试时间150分钟。
可能用到的相对原子质量:H1 O16 Fe56 Cu64 S32
一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.中华文化源远流长、博大精深。下列有关蕴含的化学知识的说法中,不正确的是
A.食品包装中常见的抗氧化剂成分为:还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀不相同
B.“陶尽门前土,屋上无片瓦。十指不沾泥,鳞鳞居大厦。”黏土烧制陶瓷的过程发生了化学变化
C.“兰陵美酒郁金香,玉碗盛来琥珀光。”粮食发酵产生的酒精分散在酒糟中,可以通过蒸馏与酒糟分离
D.侯氏制碱法中的“碱”指的是纯碱
8.某有机物结构简式如图:下列关于该有机物的说法正确的是
①分子式为C16H14O5;
②能使酸性KMnO4溶液褪色;
③能发生加成反应,但不能发生取代反应;
④苯环上的一溴代物有6种;
⑤1 mol该有机物水解时最多能消耗4 mol NaOH;
⑥1 mol该有机物在一定条件下和H2反应,共消耗6 mol H2。
A.①②③⑥ B.①②⑤ C.①④⑤⑥ D.①②④⑤⑥
9.W、X、Y、Z为元素周期表中的主族元素,且原子序数均不大于20,W的原子序数最大,X位于第二周期且原子的最外层电子数是内层电子数的2倍,Y的单质在空气中易形成一层致密的氧化膜,Z与Y同周期且相邻,W、Y原子的最外层电子数之和等于Z原子的最外层电子数。下列说法正确的是
A.简单离子的半径:Y>W>X B.最高价氧化物对应水化物的碱性:Y<W
C.单质的熔点:Z>W>X D.Y、Z的氧化物均不能溶解于水中,且均为碱性氧化物
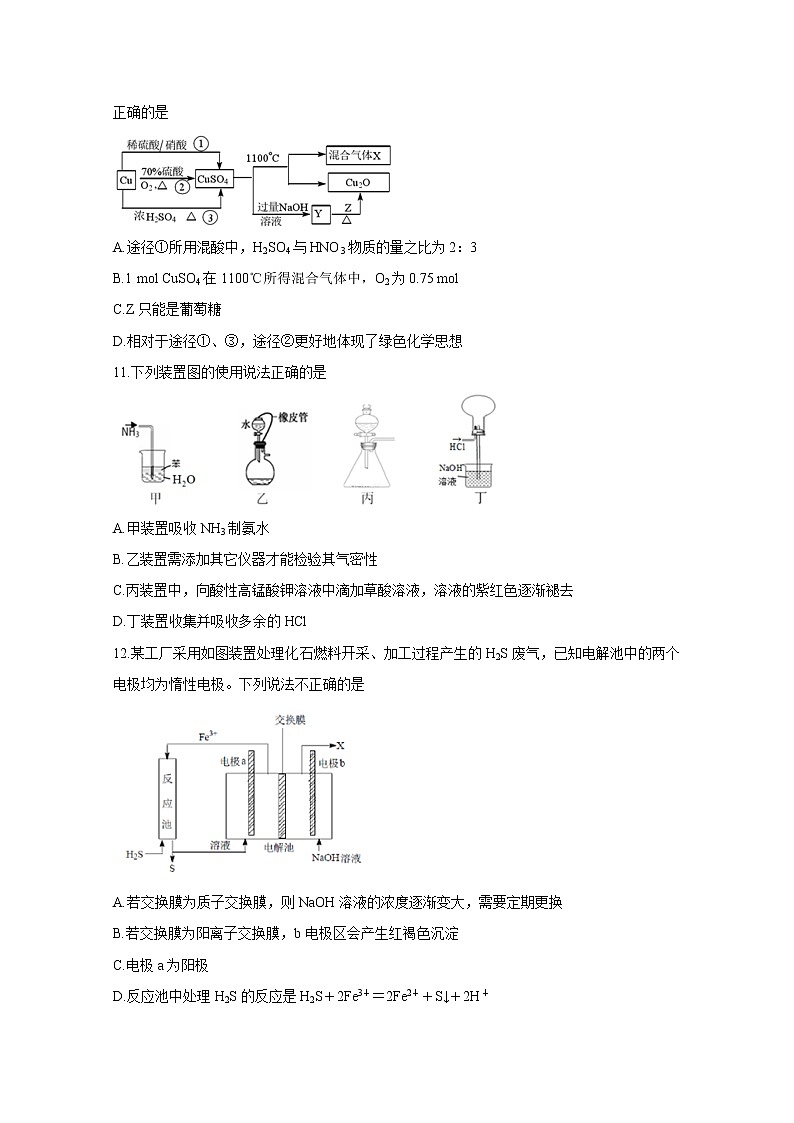
10.CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法正确的是
A.途径①所用混酸中,H2SO4与HNO3物质的量之比为2:3
B.1 mol CuSO4在1100℃所得混合气体中,O2为0.75 mol
C.Z只能是葡萄糖
D.相对于途径①、③,途径②更好地体现了绿色化学思想
11.下列装置图的使用说法正确的是
A.甲装置吸收NH3制氨水
B.乙装置需添加其它仪器才能检验其气密性
C.丙装置中,向酸性高锰酸钾溶液中滴加草酸溶液,溶液的紫红色逐渐褪去
D.丁装置收集并吸收多余的HCl
12.某工厂采用如图装置处理化石燃料开采、加工过程产生的H2S废气,已知电解池中的两个电极均为惰性电极。下列说法不正确的是
A.若交换膜为质子交换膜,则NaOH溶液的浓度逐渐变大,需要定期更换
B.若交换膜为阳离子交换膜,b电极区会产生红褐色沉淀
C.电极a为阳极
D.反应池中处理H2S的反应是H2S+2Fe3+=2Fe2++S↓+2H+
13.常温下,向浓度均为0.1 mol·L−1、体积均为100mL的两种一元酸HA、HB的溶液中,分别加入固体NaOH,溶液中的随加入NaOH的物质的量的变化如图所示。下列说法正确的是
A.由水电离出的c(H+)的顺序为:c>a>b B.b点时酸碱恰好完全中和
C.c点溶液中:c(B−)>c(HB) D.常温下电离常数:HA<HB
三、非选择题:共174分。第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。
(一)必考题:共129分。
26.(15分)氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、金属铋生产中,副产品NaBiO3可作测定锰的氧化剂。工业上常用辉铋矿(主要成分是Bi2S3,还含有少量SiO2等杂质),制备BiOCl和NaBiO3(二者都难溶于水),其流程如下:
(1)操作a使用的玻璃仪器是 ,工业上制备HCl的反应原理是: 。
(2)滤渣I中的成分为 ,分离滤渣I中的成分的物理方法是: 。
(3)请从平衡角度解释调pH产生滤渣Ⅱ的原因: 。
(4)混合液II中加入Na2CO3粉末,当混合液Ⅱ中 (填实验现象)时,说明BiOCl的生成已完成。混合液II中加入NaOH和NaClO发生的离子方程式 。
(5)加入H2O2发生反应的离子方程式 ,过滤后,如何洗涤BiOCl固体 。
27.(13分)葡萄糖酸亚铁(C6H11O7)2Fe是常用的补铁剂,易溶于水。用右下图装置制备FeCO3,提取出的FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。回答下列问题:
Ⅰ.(1)如何检验A装置的气密性?
。
(2)B中加入药品Na2CO3,要使A中制得的FeSO4溶液进入B中发生反应,实验开始时,应打开分液漏斗的活塞、 ,关闭 ,一段时间后,关闭 ,打开 (填旋塞的编号)。
(3)将制得的碳酸亚铁悬浊液过滤、洗涤。如何证明沉淀已经洗涤干净 。
(4)将葡萄糖酸与碳酸亚铁混合,反应的化学方程式为(有机物用分子式表示) 。
(5)从环境保护的角度分析,该装置存在不足之处,请写出改正措施 。
Ⅱ.某补铁剂的主要成分是硫酸亚铁,用氧化还原滴定法可测定该补铁剂中铁元素的含量,实验的主要步骤如下:
①取10片补铁剂样品,溶解除去不溶物(不损耗铁元素),并配成100mL待测溶液。
②量取20.00mL待测液于锥形瓶中。
③用c mol·L−1的酸性KMnO4溶液滴定至终点,记录消耗KMnO4溶液的体积,重复两次实验,平均消耗KMnO4溶液体积为V mL。
(6)上述实验中应该用稀硫酸酸化KMnO4溶液,如果用硝酸对KMnO4溶液进行酸化,对测定结果的影响是 (填“偏大”“偏小”或“无影响”)。滴定终点的实验现象为 。
(7)每片补铁剂含铁元素的质量为 g(用代数式表示)。
28.(15分)氮氧化物是形成光化学烟雾和酸雨的重要原因。人们研究了诸多有关氮氧化物的性质,请回答下列问题:
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) K1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) K2
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3= (用K1、K2表示)
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)N2(g)+2CO2(g),测得NO的平衡转化率与温度及压强的关系如右图所示:
①则该反应的△H 0(填“<”“>”或“=”)。
②对于气相反应,用某组分(B)的平衡分压强p(B)代替物质的量浓度c(B)也可表示平衡常数kp,则该反应的平衡常数表达式kp= ,如果p1=1.65MPa,求a点的平衡常数kp= (MPa)−1(结果保留3位有效数字,分压=总压×物质的量分数)。
③为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制了2条速率-浓度关系曲线:v正~c(NO)和v逆~c(CO2)
则:与曲线v正~c(NO)相对应的是图中曲线 (填“甲”或“乙”)。当降低反应体系的温度,反应一段时间后,重新达到平衡, 和 相应的平衡点分别为 (填字母)。
(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-的废水,如图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
①甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为 。乙池中的pH (填“变大”“变小”或“不变”)。
②工作时,在相同条件下,甲池内消耗的O2和NO2的体积比为 。
(4)己知H3PO4为三元酸,Ka1=7.0×10-3 mol·L-1,Ka2=6.2×10-8mol·L-1,Ka3=4.5×10-13mol·L-1。则Na2HPO4水溶液呈 (填“酸”、“中”、“碱”)性,用Ka与Kh的相对大小,说明判断理由 。
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每科按所做的第一题计分。
35.[化学-选修3:物质结构与性质](15分)
第VIII族元素,跟主族元素的金属相比,它们有熔、沸点高、硬度高、密度大等特点。并有良好的延展性和高导电、导热性。下列有关它们及其化合物的结构与性质,请填写:
(1)在[Ni(NH3)6]2+中,Ni2+与NH3之间形成的化学键称为 ,提供孤对电子的成键原子是 。
(2)①Co元素形成CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)各1 mol,分别与足量硝酸银溶液反应,都得到1 mol AgCl沉淀。两种配合物中配合离子的配位数都是 ,CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)的组成相同而颜色不同的原因是 。
②Co(OH)2为两性氢氧化物,在浓的强碱溶液中可以形成[Co(OH)4]2-。写出Co(OH)2酸式电离的电离方程式 。
(3)与Co属于同周期同族的过渡元素A,其基态原子排布中有四个未成对电子。
①由此元素可构成固体X,区别X为晶体或非晶体的方法为 。
②A可与Co反应生成A(CO)5,常压下熔点为-20.30°C,沸点为103.60°C,该晶体类型是 。
③A3+与SCN-不仅能以1:3的个数比配合,还可以其它个数比配合。若A3+与SCN-以1:4的个数比配合,则ACl3与KSCN在水溶液中发生反应的化学方程式可表示为 。
④A可与另两种元素B、C构成某种化合物,B、C的外围电子排布分别为3d104s1、3s23p4,其晶胞如图所示,则其化学式为 。该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数
据列式计算该晶体的密度d= g·cm-3。(保留两位小数)
36.[化学-选修5:有机化学基础](15分)
X是一种相对分子质量为92的芳香烃,以X为初始原料制备其它有机化合物的合成路线如下图所示:
已知:
请回答下列问题:
(1)X为 (填名称);己知A为一氯代物,则X与Cl2反应生成A的“一定条件”为 。
(2)反应②的化学方程式为 。
(3)反应①、⑤的反应类型依次是 、 ;反应④、⑤的次序能否颠倒? (填“能”或“不能”),试剂a的结构简式是 。
(4)写出高分子化合物Y的结构简式 。
(5)写出同时满足下列条件的(阿司匹林)的同分异构体的结构简式 。
①含有苯环且水解产物能与氯化铁溶液发生显色反应
②能发生银镜反应
③核磁共振氢谱为4组峰,且峰面积之比为1:2:2:3
(6)请以2-丙醇和苯甲醛为原料(无机试剂任选),设计制备的合成路线。








