
2020届高考化学微专题七电解质溶液图像题教案(含解析)
展开电解质溶液图像题
[知识必备]
电解质溶液图像题的分类和解题方法与技巧
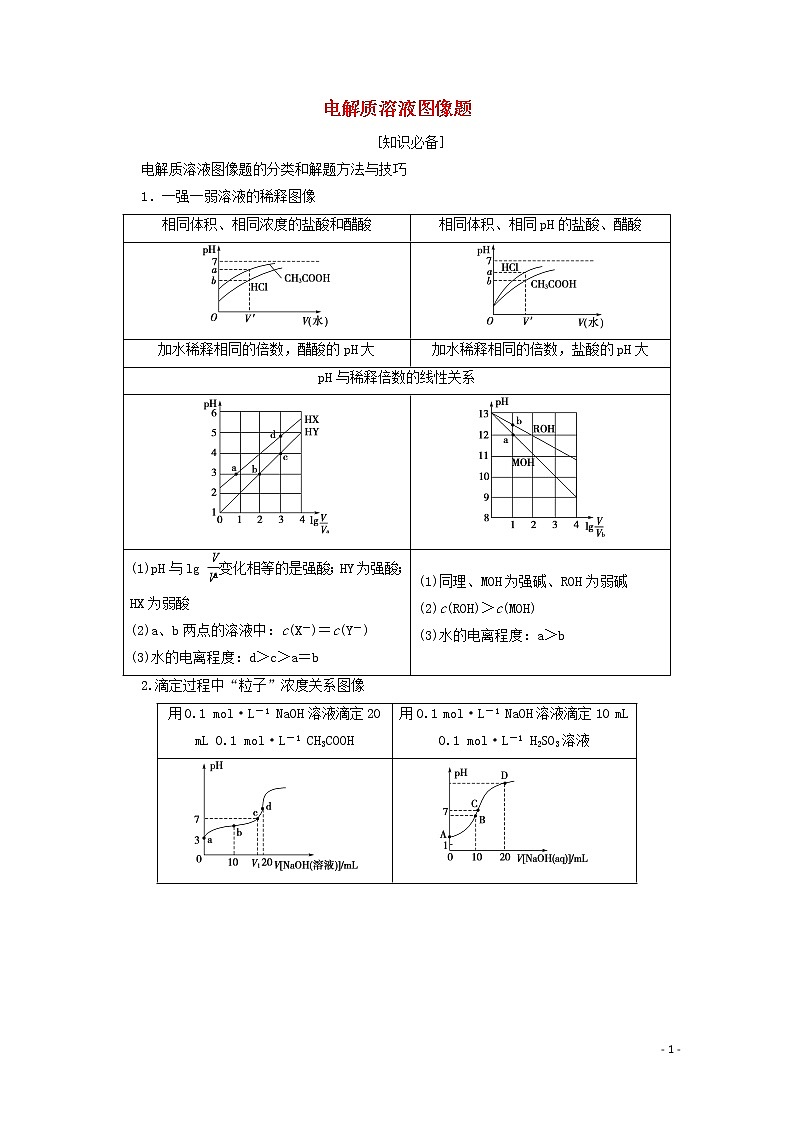
1.一强一弱溶液的稀释图像
相同体积、相同浓度的盐酸和醋酸 | 相同体积、相同pH的盐酸、醋酸 |
加水稀释相同的倍数,醋酸的pH大 | 加水稀释相同的倍数,盐酸的pH大 |
pH与稀释倍数的线性关系 | |
(1)pH与lg 变化相等的是强酸;HY为强酸;HX为弱酸 (2)a、b两点的溶液中:c(X-)=c(Y-) (3)水的电离程度:d>c>a=b | (1)同理、MOH为强碱、ROH为弱碱 (2)c(ROH)>c(MOH) (3)水的电离程度:a>b |
2.滴定过程中“粒子”浓度关系图像
用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 CH3COOH | 用0.1 mol·L-1 NaOH溶液滴定10 mL 0.1 mol·L-1 H2SO3溶液 |
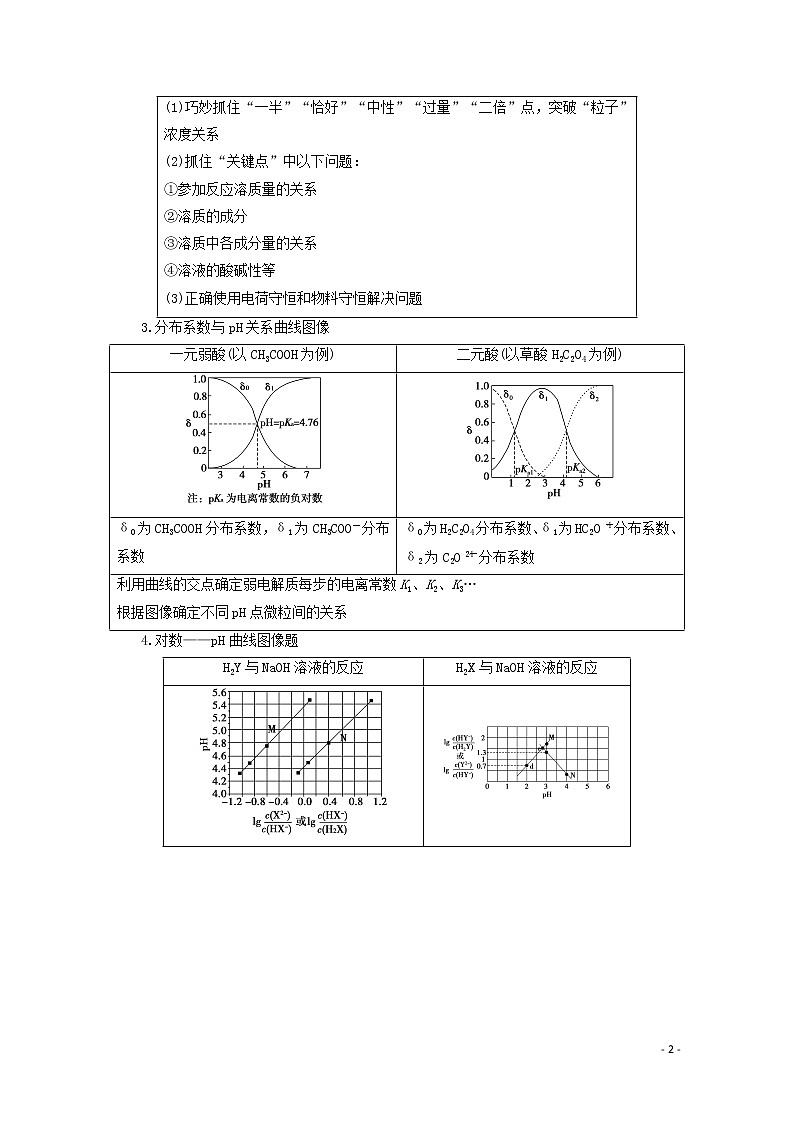
(1)巧妙抓住“一半”“恰好”“中性”“过量”“二倍”点,突破“粒子”浓度关系 (2)抓住“关键点”中以下问题: ①参加反应溶质量的关系 ②溶质的成分 ③溶质中各成分量的关系 ④溶液的酸碱性等 (3)正确使用电荷守恒和物料守恒解决问题 | |
3.分布系数与pH关系曲线图像
一元弱酸(以CH3COOH为例) | 二元酸(以草酸H2C2O4为例) |
δ0为CH3COOH分布系数,δ1为CH3COO-分布系数 | δ0为H2C2O4分布系数、δ1为HC2O分布系数、δ2为C2O分布系数 |
利用曲线的交点确定弱电解质每步的电离常数K1、K2、K3… 根据图像确定不同pH点微粒间的关系 | |
4.对数——pH曲线图像题
H2Y与NaOH溶液的反应 | H2X与NaOH溶液的反应 |
(1)识图像:观察横坐标、纵坐标含义,找到横坐标的零点,即lg=0和lg=0的点。 (2)找联系:二元弱酸H2X分步电离,H2XH++HX-,HX-H++X2-,第一步电离要远远大于第二步的电离,即K1>K2、c(H+)1>c(H+)2。 (3)思原理:涉及到电离平衡常数,写出K1(H2X)=,K2(H2X)=;横坐标在0点时,可以看出N曲线的pH小,酸性强,则曲线N表示pH与lg的关系,曲线M表示pH与lg的关系。 (4)用公式,确定平衡常数 ①lg=0即c(HX-)=c(H2X)时,pH≈4.4,K1==c(H+)≈10-4.4;lg=0即c(HX-)=c(X2-)时,pH≈5.4,K2(H2X)==c(H+)≈10-5.4=10(-6+0.6)=100.6×10-6。 同理:曲线M表示pH与lg的变化关系 K1=10-2.7 K2=10-4.3 | |
5.Ksp曲线和pM—pR曲线
常温下,CaSO4在水中的沉淀溶解平衡曲线[Ksp=9×10-6] | pM为阳离子浓度的负对数,pR为阴离子浓度的负对数 |
(1)a、c点在曲线上,a→c的变化为增大c(SO),如加入Na2SO4固体,但Ksp不变 (2)b点在曲线的上方,Qc>Ksp,将会有沉淀生成 (3)d点在曲线的下方,Qc<Ksp,则为不饱和溶液,还能继续溶解CaSO4 | (1)直线AB上的点:c(M2+)=c(R2-); (2)溶度积:CaSO4>CaCO3>MnCO3; (3)X点对CaSO4要析出沉淀,对CaCO3是不饱和溶液,能继续溶解CaCO3; (4)Y点:c(SO)>c(Ca2+),二者的浓度积等10-5;Z点:c(CO)<c(Mn2+),二者的浓度积等10-10.6。 |
[对点训练]
1.(2018·浙江自选)在常温下,向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是( )
A.在a点的溶液中c(Na+)>c(CO)>c(Cl-)>c(OH-)>c(H+)
B.在b点的溶液中2n(CO)+n(HCO)<0.001 mol
C.在c点的溶液pH<7,是因为此时HCO的电离能力大于其水解能力
D.若将0.1 mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
解析:B [该溶液中存在物料守恒,可以得出该不等式关系,故B项正确;在a点滴入5 mL盐酸中和氢氧化钠溶液,溶液中剩余离子浓度大小c(Na+)>c(CO)>c(OH-)>c(Cl-)>c(H+),故A项错误;在c点时溶液为碳酸氢钠、碳酸和氯化钠溶液,碳酸电离程度 大于碳酸氢根离子水解,溶液呈现酸性,故C项错误;当滴至溶液呈现中性时,溶液存在电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(HCO)+2c(CO),得c(Na+)=c(CH3COO-)+c(HCO)+2c(CO),故D项错误。]
2.浓度均为0.01 mol·L-1、体积均为V1 L的两种一元酸HX和HY的水溶液,加水稀释至体积为V L,测得两溶液pH随lg变化的情况如图所示,下列说法错误的是( )
A.HY为一元弱酸
B.将两种溶液无限稀释,由水电离产生的c(H+)相等
C.lg=3时,升高温度,增大
D.HX的电离程度:b>a
解析:D [lg=0,HX的pH=2,说明HX完全电离,属于一元强酸,HY的pH>3,说明HY部分电离,属于一元弱酸,A项正确;将两种溶液加水无限稀释,酸溶液无限接近中性,故由水电离产生的c(H+)相等,B项正确;lg=3时,升高温度会促进弱电解质HY的电离,即c(Y-)增大,但对强电解质HX无影响,即c(X-)不变,故增大,C项正确;HX为一元强酸,完全电离,即HX的电离程度b=a,D项错误。]
3.25 ℃时,Ka(CH3COOH)=1.8×10-5,Ka(HClO)=3.0×10-8。稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH的变化如图所示。下列有关说法正确的是( )
A.图像中,a点酸的总浓度>b点酸的总浓度
B.图像中,的值:a点>c点(HR代表CH3COOH或HClO)
C.pH相同的CH3COONa溶液和NaClO溶液的浓度关系:c(CH3COONa)<c(NaClO)
D.浓度相等的CH3COONa溶液和NaClO溶液,阴离子总数:前者>后者
解析:D [稀释前,CH3COOH、HClO的pH相同,由于HClO的酸性更弱,HClO的总浓度大于CH3COOH,则稀释相同的倍数,HClO的总浓度仍大于CH3COOH,Ⅰ表示CH3COOH溶液的稀释曲线,Ⅱ表示HClO溶液的稀释曲线,则图中a点酸的总浓度小于b点酸的总浓度,A项错误;加水稀释,氢离子浓度和酸根离子浓度均减小,由于水也能电离出氢离子,所以酸根离子减小的程度大,即浓度越小,的值越大,所以图中的值:a点<c点,B项错误;电离常数越大,酸性越强,其盐溶液的水解程度越小,溶液的碱性越弱,即pH越小,故pH相同时,酸性强的对应盐的浓度大,故pH相同的CH3COONa溶液和NaClO溶液的浓度大小关系为c(CH3COONa)>c(NaClO),C项错误;浓度相等的CH3COONa溶液和NaClO溶液,前者水解程度小,pH小,c(OH-)较小,c(H+)较大,而两溶液中钠离子浓度相等,存在电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+)、c(H+)+c(Na+)=c(OH-)+c(ClO-),故CH3COONa溶液中c(OH-)+c(CH3COO-)>NaClO溶液中c(OH-)+c(ClO-),D项正确。]
4.已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O、C2O的组成百分率与pH的关系如图所示,下列说法正确的是( )
A.pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O)
B.反应HC2O+H2OH2C2O4+OH-的平衡常数为10-4.27
C.向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D.pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O)
解析:A [由图像可知,pH=4.27时,c(HC2O)=c(C2O),根据电荷守恒得c(K+)+c(H+)=c(OH-)+c(HC2O)+2c(C2O),又c(HC2O)=c(C2O),代入可得c(K+)+c(H+)=c(OH-)+3c(C2O),A正确;根据图像可知,pH=1.3时,c(H2C2O4)=c(HC2O),草酸的一级电离常数Ka1=,则Ka1=10-1.3,反应HC2O+H2OH2C2O4+OH-是HC2O的水解反应,平衡常数Kh===10-12.7,B错误;向溶液中加入KOH溶液,pH由1.3增大至4.27的过程中,溶液始终是酸性的,水的电离受到抑制,随着pH的增大,溶液中酸电离出的H+越来越少,对水的抑制作用不断减弱,水的电离程度不断增大,C错误;由图像可知,pH=2.5时,溶液中不存在H2C2O4和C2O,D错误。]
5.20 ℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如图所示。下列叙述正确的是( )
A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.向含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)
解析:B [Ksp(PbCl2)只与温度有关,A错误;增大盐酸浓度,PbCl2(s)的溶解平衡逆向移动,PbCl2的溶解量减小,而c(HCl)大于1 mol·L-1时,增大c(HCl),PbCl2(s)的溶解量增大,说明PbCl2能与一定浓度的盐酸反应,B正确;x、y两点PbCl2的Ksp相等,c(Cl-)不同,故x、y两点对应的溶液中c(Pb2+)不相等,C错误;PbCl2(s)存在溶解平衡,且PbCl2(s)能与浓盐酸反应,向含Pb2+的溶液中加过量浓盐酸,不能将Pb2+完全转化为PbCl2(s),D错误。]
6.一定温度下,将足量的BaSO4固体溶于50 mL水中,充分搅拌,慢慢加入Na2CO3固体,随着c(CO)增大,溶液中c(Ba2+)的变化曲线如图所示。则下列说法正确的是( )
A.该温度下Ksp(BaSO4)>Ksp(BaCO3)
B.加入Na2CO3固体,立即有BaCO3固体生成
C.BaCO3的Ksp=2.5×10-10
D.曲线BC段内,c(CO)∶c(SO)=25
解析:D [A.当c(CO)=0时,c(SO)=c(Ba2+)=1.0×10-5 mol·L-1, BaSO4的溶度积Ksp=1.0×10-5×1.0×10-5=1.0×10-10。由图可知当c(CO)>2.5×10-4 mol·L-1时,开始有BaCO3生成,BaCO3的溶度积Ksp=2.5×10-4×1.0×10-5=2.5×10-9,A错误;B.根据A选项分析,当加入Na2CO3浓度为2.5×10-4 mol·L-1时,才有BaCO3沉淀,故B错误;C.根据A选项分析,故C错误;D.曲线BC段内,BaSO4(s)和BaCO3(s)在溶液中都达到了沉淀溶解平衡状态,故====25,D正确。]








