

所属成套资源:2022-2023学年北京高一下学期期末化学试题及答案
2024-2025学年北京石景山区高三上学期期末化学试题及答案
展开
这是一份2024-2025学年北京石景山区高三上学期期末化学试题及答案,共12页。试卷主要包含了下列化学用语或图示表达正确的是,下列说法错误的是,下列方程式与所给事实相符的是,已知NaHSO3溶液显酸性,对下列事实的解释不正确的是等内容,欢迎下载使用。
本试卷共10页,100分。考试时长90分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将答题卡交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Ca 40
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.明朝宋应星所著的《天工开物》是世界上第一部关于农业和手工业生产的综合性“工艺百科全书”,其中介绍了锌的冶炼方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐(如右图所示),泥封,“其底铺薪,发火煅红”,“冷定毁罐取出”。
已知:锌的熔点为419℃,沸点为907℃。
下列说法不正确的是
2.下列性质的比较,不能用元素周期律解释的是
3.下列化学用语或图示表达正确的是
4.下列说法错误的是
5.下列方程式与所给事实相符的是
6.习惯上把电解饱和食盐水的工业生产叫氯碱工业,一个单元槽的电解原理示意图如下,下列说法不正确的是
7.已知NaHSO3溶液显酸性。关于Na2SO3和NaHSO3的下列说法中,不正确的是
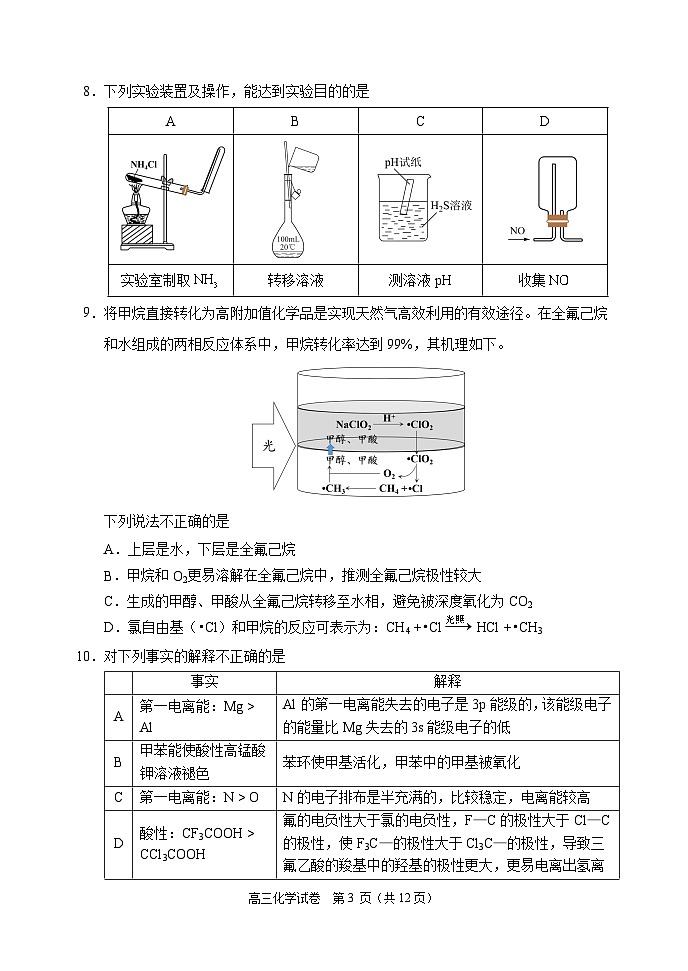
8.下列实验装置及操作,能达到实验目的的是
9.将甲烷直接转化为高附加值化学品是实现天然气高效利用的有效途径。在全氟己烷和水组成的两相反应体系中,甲烷转化率达到99%,其机理如下。
下列说法不正确的是
10.对下列事实的解释不正确的是
11.一种热响应高分子Y的合成路线如下。
引发剂
X Y
Y(物理交联)
下列说法不正确的是
12.一种全钒液流电池放电状态的工作原理示意图如下。
电
极
a
电
极
b
负载
下列说法正确的是
13.白云石的主要化学成分为CaMg(CO3)2,我国科学家以白云石为原料制备球霰石型碳酸钙,流程示意图如下。
白云石
煅烧粉碎
氯化铵溶
液浸出
固体A
滤液B
滤液D
产品
先通NH3
再通CO2
陈化
3次过滤
固体C
烘干
后续实验发现:将产品加热至740℃,固体剩余量少于56 %
已知:740℃时,碳酸钙受热分解为CaO和CO2
下列说法不正确的是
14.对于二元弱酸H2A,存在电离平衡:H2A H+ + HA−,HA− H+ + A2−,,如果Ka1≫Ka2,则以第一步电离为主,此时H2A水溶液中c(H+)≈c(HA−),则c(A2−)≈Ka2。
已知:H2SO3的Ka1=1.4×10−2,Ka2=6.0×10−8; Ksp (BaSO3)=5.0×10−10;
H2CO3的Ka1=4.5×10−7,Ka2=4.7×10−11;Ksp (CaCO3)=3.4×10−9;
CO+H2O HCO+OH− Kh1=2.1×10−4。
下列说法不正确的是
第二部分
本部分共5题,共58分。
15.(10分)
对机理的研究有利于从微观层面理解化学反应的本质。一种CeO2催化CO2加氢制CH3OH的路径如下。(表示氧空位)
CH3OH*
H2
(1)写出CeO2催化CO2加氢制CH3OH的化学方程式______。
(2)H2O分子的VSEPR模型名称是______。
(3)58Ce位于元素周期表第6周期。
将基态Ce原子的简化电子排布式补充完整:[Xe]4 f 15 d 1______。
吸附
异裂解离
H2
H
H
Hδ+
Hδ−
H
H
H
H
H2O
H2在CeO2表面异裂产生氧空位(□)和Ce3+的示意图如下。
分析异裂解离需要吸收能量且Hδ+与催化剂表面O结合的原因______。
(5)CeO2的晶胞如右图所示。
① 每个Ce原子周围与它最近且距离相等的O原子有______个。
② CeO2晶胞的边长均为a nm,已知CeO2的摩尔质量是 M g/ml,阿伏加德罗常数为NA,该晶体的密度为______g/cm3。(1 cm = 107 nm)
③ 已知CeO2的摩尔质量是 M g/ml,假设每个CeO2晶胞中有1个O变为氧空位,则b g CeO2参与反应时转移______ml电子。
16.(9分)
NH3在国民经济中占有重要地位。可采取不同的方法制备NH3。
(1)氨的发现:科学家在加热氯化铵和石灰(主要成分是CaO)混合物时发现氨,写出反应的化学方程式______。
N2
CaCN2
1000℃CaC2
NH3
200℃H2O
-3
Ⅰ
Ⅱ
(2)氰化法制氨:以N2为氮源两步合成氨。
① 第 Ⅰ 步产物还有单质C,则反应中CaC2______(填序号)。
a. 是氧化剂 b. 是还原剂 c. 既是氧化剂又是还原剂
② 第 Ⅱ 步产物还有CaCO3,反应的化学方程式为______。
(3)直接合成法制氨是人类科学技术的一项重大突破,其反应如下:
N2(g) + 3H2(g) 2NH3(g) ΔH= - 92.4 kJ/ml
若断裂1 ml H—H、1 ml N—H需要吸收的能量分别为a kJ、b kJ,则断裂1 ml N≡N需要吸收的能量为______ kJ。
N2、H2O、NH3
H2、H2O、O2
(4)电化学氮还原合成氨是未来合成氨工艺最有潜力的前沿技术。水相电解是最早实现低温合成氨的体系。
H2、H2O
N2、H2O
① 以KOH溶液为离子导体的示意图如右图所示,阴极的电极反应是______。
KOH溶液
② 以稀硫酸为离子导体,氮还原的选择性较低。在稀硫酸中添加聚乙二醇,能显著提高氮还原的选择性,其原理如下。
聚乙二醇不影响N2的扩散。聚乙二醇能______,有效抑制H2O/H3O+的扩散。
17.(13分)
从构树中分离得到的Brussnin C()具有较好的酪氨酸酶抑制活性,其人工合成路线如下。
已知: = 1 \* rman \* MERGEFORMAT i.
= 2 \* rman \* MERGEFORMAT ii.
(1)A中含氧官能团的名称是______。
(2)A→B的反应类型是______。
(3)C的结构简式是______。
(4)G的分子式是C5H10O,F→H的化学方程式是______。
(5)下列说法正确的是______(填序号)。
a. ClCH2OC2H5的作用是保护酚羟基
b. 1 ml D被还原时,转移6 ml 电子
c. I和J互为同分异构体
(6)I的结构简式是______。
(7)以上述合成路线中的E制备K,利用K和Brussnin C进行对比实验,实验确认异戊烯基()不是抑制酪氨酸酶活性的关键药效团。写出E和K的结构简式:
K
E
18.(12分)
绿柱石
煅烧粉碎
浓硫酸
浸出
硫酸铵
除铝
滤液G
固体A
滤液B
固体C
滤液D
氨水
调pH=5.1
固体E
滤液F
95℃时
加氨水
室温过滤
Be(OH)2
BeO
一种利用绿柱石(主要成分是Be3Al2Si6O18,含一定量FeO和Fe2O3等杂质)生产BeO的工艺流程如下(简称硫酸法)。
已知:固体A的主要成分是SiO2,固体C的主要成分是(NH4)Al(SO4)2·12H2O。
(1)浓硫酸浸出,利用了H2SO4的氧化性和______性。
(2)滤液D氨水调pH=5.1时,反应的离子方程式有______。
(3)25℃时,氨水的pH可达11。滤液F在95℃时加氨水沉淀Be2+,然后室温过滤,室温过滤(25℃)时,溶液pH最高为8.0,结合平衡移动原理解释原因______。
(4)由于高品质绿柱石资源短缺,需要从品质差的含氟铍矿石中提取BeO。
① 采用硫酸法时,滤液D中硫酸的浓度约为2 ml/L,滤液F中硫酸铵的浓度一般为180 g/L,此时如果溶液中不含氟,铍可以完全沉淀。氟存在时,部分Be2+会和F−生成配合物,导致BeO的产率降低,解释Be2+和F−能形成配合物的原因______。增大沉铍时的pH或较少F−浓度有利于提高BeO的产率。
② 实践表明:其他条件不变时,用NH3替代硫酸铵既可以除去Al3+,又能够将沉淀Be2+时的pH提高到8.5,结合化学用语解释原因______。
③ 预处理脱氟可减少氟对铍提取的影响。不考虑F−的影响,沉淀Be2+时,将pH从8.0提高到8.5,理论上铍的损失将降低至原来的______%。
19.(14分)
某小组探究铜和双氧水在不同条件下的反应。
资料:还原反应中,增大反应物浓度或降低生成物浓度,氧化剂的氧化性增强;氧化反应中,增大反应物浓度或降低生成物浓度,还原剂的还原性增强。
(1)实验过程
① 实验Ⅰ中的蓝色沉淀物是______。
② 实验Ⅱ中发生的反应有______。
③ 实验Ⅲ中溶液呈深蓝色,是因为含有______离子。
④ 参照实验Ⅲ的操作进行实验Ⅳ:H2O2溶液加入氨水后,加入一定量的______固体,搅拌溶解后,加入光亮的铜片,立即产生大量气泡,溶液颜色变为深蓝色,取出铜片晾干,铜片依然保持光亮。解释铜片依然保持光亮的原因______。
(2)分析解释
① 实验Ⅰ中铜和H2O2的电极反应式:
Cu电极
石墨电极
硫酸钠溶液
30%双氧水
i.还原反应:H2O2 + 2e− === 2OH−
ii.氧化反应:______。
② 实验Ⅱ比实验Ⅰ溶液更快变蓝的原因可能是:加入稀硫酸,H2O2的氧化性______,采用右图电化学装置进行验证,实验操作及现象______。
③ 实验Ⅲ比实验Ⅰ溶液更快变蓝的原因可能是______。
石景山区2024-2025学年第一学期高三期末
化学试卷答案及评分参考
第一部分共 14 题,每题 3 分,共 42 分。
第二部分共 5 题,共 58 分。
CeO2
15.(10分)(其他合理答案酌情给分)
(1)(2分)CO2 + 3H2 === CH3OH + H2O
(2)(1分)四面体
(3)(1分)6s2
(4)(2分)断开H—H键需要吸收能量,Hδ+和O电性相反(或Hδ+有空轨道,O有孤电子对,可以形成配位键)
(5)(1分)① 8 (2分)② (1分)③
∆
16.(9分)(其他合理答案酌情给分)
(1)(2分)2NH4Cl + CaO === CaCl2 + 2NH3↑ + H2O
200℃
(2)(1分)① b
(2分)② CaCN2 + 3H2O === 2NH3 + CaCO3
(3)(1分)(6b-3a-92.4)
(4)(2分)① N2 + 6e− + 6H2O === 2NH3 + 6OH−
(1分)② 与H2O/H3O+形成氢键
17.(13分)(其他合理答案酌情给分)
(1)(2分)醛基、羟基
(2)(1分)取代反应
(3)(2分)
(4)(2分)
(5)(2分)abc
(6)(2分)
(7)(2分)
18.(12分)(其他合理答案酌情给分)
(1)(1分)酸性
(2)(2分)NH3·H2O + H+ === NH+H2O,Fe3+ +3NH3·H2O === Fe(OH)3↓ + 3NH
(3)(3分)NH3·H2O NH+ OH−,滤液F中NH浓度较大,平衡逆向移动;在95℃时,氨的溶解度较低,室温过滤时溶解的氨较少,pH最高为8.0
(4)①(2分)Be2+有空轨道,F−有孤电子对,两者可以形成配位键
②(3分)通过反应NH3 + H+ === NH和NH+ Al3+ + 2SO+ 12H2O === (NH4)Al(SO4)2·12H2O ↓[或NH3 + H++ Al3+ + 2SO+ 12H2O === (NH4)Al(SO4)2·12H2O ↓]除去Al3+;用氨代替硫酸铵,可以降低NH浓度,减少对NH3·H2O NH+ OH−的抑制作用,增大OH−浓度,pH可以提高到8.5
③(1分)10%
19.(14分)(其他合理答案酌情给分)
Cu2+
(1)(1分)① Cu(OH)2
(3分)② Cu+2H++H2O2 === Cu2++2H2O 2H2O2 === O2↑+2H2O
(1分)③ [Cu(NH3)4]2+
(3分)④ (1分)(NH4)2SO4
(2分)加入(NH4)2SO4固体,NH结合OH−,使溶液碱性减弱,铜片依然保持光亮
(2)(1分)① Cu – 2e− === Cu2+
(3分)② (1分)增强
(2分)向右侧双氧水中加入一定量硫酸钠固体,待固体溶解后,闭合开关K;待灵敏电流计指针稳定后,先向Cu电极一侧滴加5ml/L稀硫酸,指针偏转幅度没有明显变化;再向石墨电极一侧滴加5ml/L稀硫酸,指针偏转幅度增大
(2分)③ 加入氨水生成[Cu(NH3)4]2+,Cu的还原性增强是主要原因
A.冷凝区中,锌由气态转化为液态,理论上该区温度控制在419~907℃
B.“冷定”后“毁罐”取锌的原因是防止Zn在较高的温度下被氧化成ZnO
C.反应区中,ZnCO3分解生成ZnO和CO2
D.反应区中,C与ZnO发生置换反应得到Zn,C被还原
A.碱性:KOH > Mg(OH)2
B.酸性:H2SO3 > H2CO3
C.金属性:Na > Li
D.电负性:F > O
A.CO2的电子式:
B.基态N原子的价层电子轨道表示式:
C.HClO的结构式:H—Cl—O
D.反-2-丁烯的分子结构模型:
A.葡萄糖氧化生成CO2和H2O的反应是吸热反应
B.核酸是一种生物大分子
C.葡萄糖和果糖互为同分异构体
D.氨基酸是组成蛋白质的基本结构单位
A.食醋去除水垢中的CaCO3:CaCO3 + 2H+ === Ca2+ + H2O + CO2↑
B.SO2的水溶液显酸性:SO2 + H2O === HSO+ H+
C.新切开的钠的光亮的表面很快变暗:2Na + O2 === Na2O2
D.氯化铁溶液作为覆铜板的“腐蚀液”:2Fe3+ + Cu === 2Fe2+ + Cu2+
A.阴极的电极反应:2H2O + 2e− === H2↑ + 2OH−
B.在阳极,Cl−比OH−容易失去电子
C.中间的离子交换膜选用阴离子交换膜
D.电解饱和食盐水可以得到三种重要的化工产品:Cl2、H2和NaOH
A.Na2SO3溶液中,c(Na+) > c(SO)
B.两种物质的溶液中,所含微粒的种类相同
C.NaHSO3溶液中,c(Na+) = 2c(SO) + c(HSO)
D.可以用Na2SO3溶液吸收SO2,生成NaHSO3
A
B
C
D
实验室制取
转移溶液
测溶液pH
收集
A.上层是水,下层是全氟己烷
B.甲烷和O2更易溶解在全氟己烷中,推测全氟己烷极性较大
光照
C.生成的甲醇、甲酸从全氟己烷转移至水相,避免被深度氧化为CO2
D.氯自由基(•Cl)和甲烷的反应可表示为:CH4 +•Cl HCl +•CH3
事实
解释
A
第一电离能:Mg > Al
Al的第一电离能失去的电子是3p能级的,该能级电子的能量比Mg失去的3s能级电子的低
B
甲苯能使酸性高锰酸钾溶液褪色
苯环使甲基活化,甲苯中的甲基被氧化
C
第一电离能:N > O
N的电子排布是半充满的,比较稳定,电离能较高
D
酸性:CF3COOH > CCl3COOH
氟的电负性大于氯的电负性,F—C的极性大于Cl—C
的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子
A.X在引发剂的作用下,发生加聚反应生成Y
B.X和Y均含有酰胺基
C.X的分子式为C5H8N2O2
D.Y水解可得到X
A.放电时,H+穿过质子交换膜进入负极室
B.放电时,正极的反应为VO + e− + 2H+ === VO2+ + H2O
C.充电时,负极室的pH升高
D.充电时,电极a应连接电源的负极
A.将白云石粉碎是为了增大接触面积,提高反应速率
B.固体A的主要成分是MgO
C.生成固体C的离子方程式是Ca2+ + 2NH3 + CO2 + H2O === CaCO3↓+ 2NH
D.740℃时产品固体剩余量少于56 %,推测是因为Ca(OH)2分解所致
A.酸性:H2SO3 > H2CO3
B.将浓度均为0.4 ml/L的BaCl2和H2SO3溶液等体积混合,会生成BaSO3沉淀
C.将碳酸钠溶液加水稀释至4.2×10−4 ml/L,CO的水解程度约为50%
D.将过量碳酸钙粉末置于水中,上层清液中含碳微粒主要以CO形式存在
实验Ⅰ
实验Ⅱ
实验Ⅲ
操作
50 mL 30 % 的H2O2溶液中,加入0.5 g光亮铜片
50 mL 30 % 的H2O2溶液中,加入0.5 g光亮铜片,滴加5 ml/L稀硫酸8 mL
50 mL 30 % 的H2O2溶液中,滴加5 ml/L的氨水8 mL,加入0.5 g光亮铜片
现象
开始无明显现象,较长时间溶液变为浅蓝色,取出铜片晾干,表面有蓝色沉淀物
铜片表面产生少量气泡,随着反应的进行,气泡越来越多,溶液很快变蓝,取出铜片晾干,铜片依然保持光亮
立即产生大量气泡,溶液颜色变为深蓝色,取出铜片晾干,表面有蓝色沉淀物
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
D
B
B
A
D
C
C
B
B
A
D
B
D
D
相关试卷
这是一份2024-2025学年北京石景山区高一上学期期末化学试题及答案,共10页。
这是一份2024-2025学年北京石景山区高二上学期期末化学试题及答案,共11页。
这是一份北京市石景山区2024-2025学年第一学期末高三化学试题及答案,共13页。








