
广西“贵百河-武鸣高中”2024-2025学年高一上学期12月月考化学试卷(含答案)
展开
这是一份广西“贵百河-武鸣高中”2024-2025学年高一上学期12月月考化学试卷(含答案),共17页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
一、单选题
1.下列有关说法错误的是( )
A.“熬胆矾铁釜,久之亦化为铜”,涉及的反应属于氧化还原反应
B.节日燃放的五彩缤纷的烟花,利用了部分金属元素的焰色反应
C.“绳锯木断,水滴石穿”,该过程中不包含化学变化
D.“细研水飞,去石澄清,慢火熬干”,涉及的操作方法是溶解、过滤、蒸发
2.下列物质分类的正确组合是( )
A.AB.BC.CD.D
3.已知下列物质:
①(标准状况下)
②个分子
③
④0.5mlHCl,则分子数的大小顺序是( )
A.①>③>②>④B.④>③>①>②C.④>③>②>①D.①>②>③>④
4.下列说法或化学用语不正确的是( )
A.原子中质子数为6、中子数为8
B.与是两种不同的核素
C.在元素周期表中的位置:第四周期第VIIA族
D.和互为同素异形体
5.下列反应的离子方程式书写正确的是( )
A.与稀硝酸反应:
B.氢氧化钡溶液与稀反应:
C.用溶液腐蚀电路板:
D.澄清石灰水跟稀硝酸反应:
6.设代表阿伏加德罗常数的值。下列说法中正确的是( )
A.中所含的中子数为
B.标准状况下,所含的分子数目为
C.的溶液中含有的数目是
D.熔融中阳离子数目为
7.下列装置能达到实验目的且操作正确的是( )
A.图甲:验证干燥的氯气没有漂白性
B.图乙:用玻璃棒搅拌加快制备胶体反应速度
C.图丙:比较和的热稳定性
D.图丁:用该装置完成和浓盐酸制备的实验
8.在下列条件下,一定能大量共存的离子组是( )
A.含有大量的溶液中:、、、
B.使酚酞溶液呈红色的溶液中:、、、
C.澄清透明的溶液中:、、、
D.含有大量的水溶液中:、、、
9.关于反应,下列说法正确的是( )
A.中H元素被氧化
B.发生氧化反应
C.氧化产物与还原产物的质量之比为4∶3
D.反应中每生成,有被还原
10.下列试剂不能使转化为的是( )
①新制氯水;②溶液;③酸性溶液;④溶液;⑤盐酸;⑥溶液
A.①②③B.①③④C.②④⑤D.②⑤⑥
11.下列选项中结论不正确的是( )
A.AB.BC.CD.D
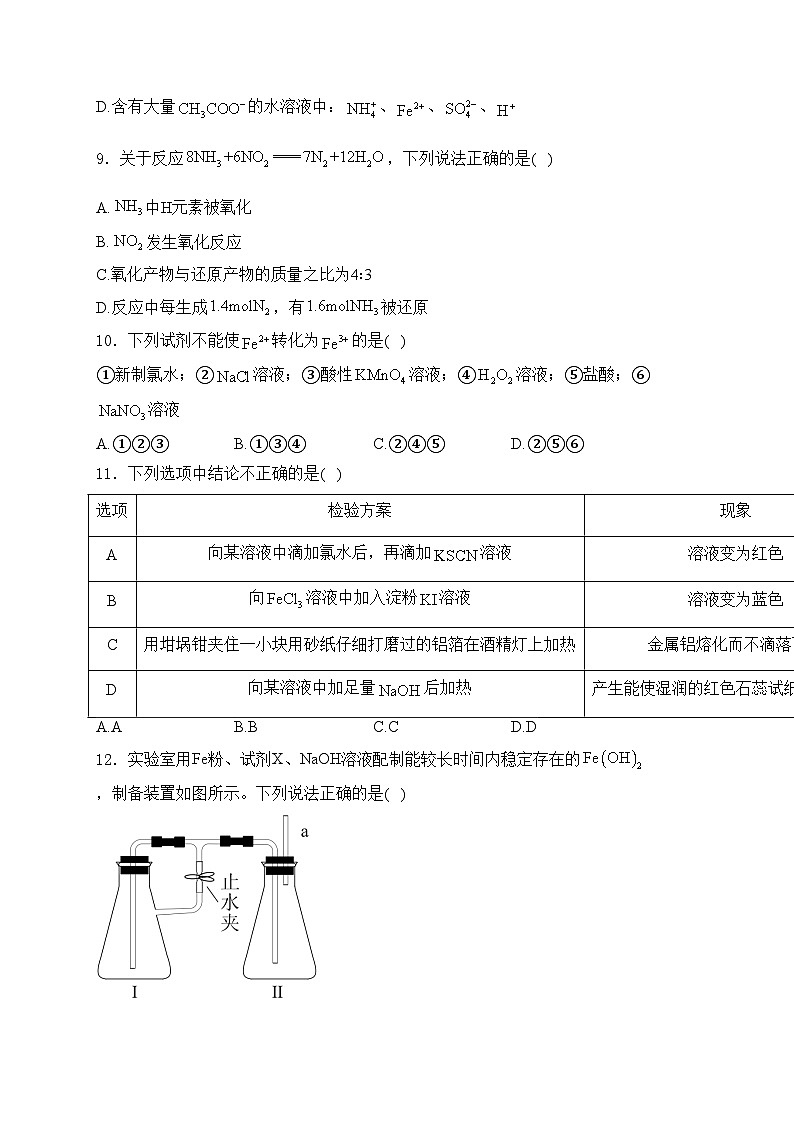
12.实验室用Fe粉、试剂X、NaOH溶液配制能较长时间内稳定存在的,制备装置如图所示。下列说法正确的是( )
A.NaOH溶液应置于装置I中
B.实验后期要打开止水夹
C.装置II中发生的反应有
D.试剂X可以是稀硫酸或溶液
13.一定条件下,将50mL的和的混合气体通过足量的过氧化钠粉末,充分反应后得到相同状况下的气体30mL,则原混合气体中的体积分数为( )
A.80%B.44%C.33.3%D.20%
14.向100mLNaOH溶液中通入一定量的气体,充分反应后,再向所得溶液中逐滴加入的盐酸,产生的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是( )
A.原NaOH溶液的浓度为
B.通入的体积为448mL
C.所得溶液的溶质成分的物质的量之比为
D.所得溶液的溶质成分的物质的量之比为
二、填空题
15.有关物质间转化关系如下图,试回答:
(1)转化②的化学方程式为___________;与足量氢氧化钠溶液反应,生成气体(标况下)的体积为___________L;转移的电子数目为___________(阿伏加德罗常数用表示)。
(2)转化③的离子方程式为___________。
(3)若转化⑤用于实验室制,则试剂A宜选择___________(填名称),离子方程式为___________。
(4)溶液中的物质的量浓度为___________,取出加水稀释到,则稀释后所得溶液中物质的量浓度为___________。
16.利用铝灰(主要成分为,含少量杂质、、)制备超细的实验流程如下:
已知:不溶于硫酸溶液。回答下列问题:
(1)铝灰中氧化铝与硫酸反应的化学方程式为___________。
(2)图中“滤渣”的主要成分为___________(填化学式)。
(3)“氧化”时,可以把氧化为,发生的离子方程式为___________。该反应需控制温度低于,其目的是___________。
(4)高铁酸钾()是一种高效、多功能绿色水处理剂。沉铁后得到的物质可以作为制备高铁酸钾的原料。
①干法制备高铁酸钾的主要反应为:。该反应中的氧化剂是___________,每生成,同时生成标准状况下的___________L,转移的电子数目为___________(阿伏加德罗常数用表示)。
②若废水中仅大量存在、、和X离子,且、、、X离子的浓度之比为1:2:2:1,则X离子可能是___________。
A.B.C.D.
三、实验题
17.下列实验装置可用于实验室制备少量无水,已知:遇水会剧烈反应。
(1)装置⑤装有浓盐酸的仪器名称为___________,装有的仪器名称为___________。
(2)为达到实验目的,各装置的正确连接顺序是:___________(填接口的字母,箭头的方向即气流的方向,部分装置可重复使用)。
(3)装置②的作用是___________。
(4)请写出④制备的化学方程式___________。
(5)用离子方程式表示③的作用是___________。
(6)本实验装置④⑤两处均有酒精灯,实验开始前应先点燃___________(填装置序号)处酒精灯。
(7)装置①前后两次使用,第1次使用时装置①的作用为___________,第2次使用时装置①的作用为___________。
(8)用下列两种方法制取氯气:①用含HCl的浓盐酸与足量的二氧化锰反应;②用二氧化锰与足量的浓盐酸反应,则所得氯气___________。(填标号)
A.②比①多B.①比②多C.一样多D.无法比较
18.人体胃酸(主要成分是盐酸)过多,会引起胃病,需服用抗酸药治疗。某种抗酸药的主要成分是氢氧化铝,某同学为测定该药中氢氧化铝的质量分数进行如下操作(设该药片中的其他成分不与盐酸或氢氧化钠溶液反应)。
步骤1:配制稀盐酸和溶液;
步骤2:取1粒药片(每粒药片的质量为)研碎,加入蒸馏水;
步骤3:加入稀盐酸;
步骤4:用溶液中和过量的稀盐酸,记录消耗溶液的体积。
请回答下列问题:
(1)测定过程中发生反应的离子方程式为___________,___________。
(2)该测定实验共进行4次。实验室现有、、、4种规格的容量瓶,用密度为、质量分数为的浓盐酸配制实验中所需的稀盐酸。
①需要选用如下图所示的部分仪器进行实验,另外还需要的玻璃仪器是___________容量瓶、___________(填仪器名称)。
②需要量取的浓盐酸的体积为___________(保留1位小数)。
(3)用固体配制实验中所需的溶液时,下列操作会使配制的溶液浓度偏低的有___________(填序号)。
A.转移溶液时,未洗涤玻璃棒和烧杯内壁
B.配制溶液前容量瓶底部有少量蒸馏水残留
C.摇匀后发现容量瓶中液面下降,再加水至刻度线
D.溶液未冷却即转移到容量瓶中定容
(4)某同学4次测定所消耗的溶液的体积如下:
根据这个同学的实验数据,计算这种药片中氢氧化铝的质量分数约为___________(保留3位有效数字)。
参考答案
1.答案:C
解析:A.“熬胆矾铁釜,久之亦化为铜”,是说Fe与在溶液中发生置换反应产生、Cu,因此涉及的反应属于氧化还原反应,A正确;
B.节日燃放的五彩缤纷的烟花,利用了部分金属元素的焰色反应所呈现出来的色彩,B正确;
C.石头主要成分是碳酸钙,水滴石穿是碳酸钙与水、二氧化碳反应生易溶于水的,该过程中有新物质产生,因此是发生的变化属于化学变化,C错误;
D.提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干”,可知洗涤后,溶解于水中,过滤后蒸发,D正确;
故选C。
2.答案:D
解析:A.电解质和非电解质是对化合物的分类,溶液属于混合物,不是电解质,A错误;
B.胶体是混合物,不是纯净物,属于电解质,B错误;
C.是纯净物,不是混合物,铜是单质,不属于电解质,属于电解质,C错误;
D.氨水为氨气和水的混合物,胆矾为纯净物,只有C元素一种元素属于单质,NaCl在水溶液中能导电属于电解质,为有机物,不能发生电离,为非电解质,D正确;
故选:D。
3.答案:B
解析:①(标准状况下)含有氨气分子为:;
②个分子,含有分子为:;
③含有分子为:;
④0.5mlHCl
分子数的大小顺序是④>③>①>②,故答案为:B
4.答案:D
解析:A.原子中质子数为6、中子数为14-6=8,A正确;
B.与中子数不同,是两种不同的核素,B正确;
C.是第35号元素,在元素周期表中的位置:第四周期第VIIA族,C正确;
D.同素异形体是每日同种元素构成的不同单质,和为质子数相同中子数不同的两种原子,互为同位素,D错误;
故选D。
5.答案:C
解析:A.与稀硝酸发生氧化还原反应:,A错误;
B.氢氧化钡溶液与稀反应生成硫酸钡沉淀和水:,B错误;
C.用溶液腐蚀电路板生成亚铁离子和铜离子:,C正确;
D.澄清的石灰水中氢氧化钙完全电离,跟稀硝酸反应生成水和硝酸钙,,D错误;
故选C。
6.答案:D
解析:A.中含有的中子数为18-8=10个,的物质的量为,其中所含的中子数为,A错误;
B.标准状况下,为非气体,不能用气体摩尔体积计算,B错误;
C.未给出溶液体积,无法计算,C错误;
D.硫酸氢钠在熔融状态下电离出钠离子和硫酸氢根离子,熔融的物质的量为0.1ml,则0.1ml熔融的中含有的阳离子数目为,D正确;
故选D。
7.答案:D
解析:A.鲜花中含有水分,并不是干燥的,A错误;
B.制备胶体时,应将饱和溶液滴入沸腾的蒸馏水中,且不能搅拌,否则会生成沉淀,B错误;
C.应将碳酸钠置于大试管中,碳酸氢钠置于小试管中,C错误;
D.二氧化锰和浓盐酸在加热条件下制取氯气,烧瓶与分液漏斗上口连接的导气管可以平衡压强,盐酸在重力作用下流下,装置正确,D正确;
故选D。
8.答案:C
解析:A.与会发生氧化还原反应,不能大量共存,A错误;
B.使酚酞溶液呈红色的溶液呈碱性,在碱性溶液中能与发生反应,不能大量共存,B错误;
C.各离子之间不发生反应,可以共存,C正确;
D.含有大量的水溶液中,能与发生反应形成弱电解质,不能大量共存,D错误;
故选C。
9.答案:C
解析:A.氨气中氮元素化合价为-3价,化合价升高,被氧化,氢元素化合价不变,A错误;
B.二氧化氮中氮元素化合价降低,被还原,发生还原反应,B错误;
C.氧化产物和还原产物都为氮气,其中氧化产物为,还原产物为,则二者质量比为4:3,C正确;
D.每生成1.4ml氮气,则消耗1.6ml氨气,被氧化,D错误;
故选C。
10.答案:D
解析:要使转化为,需加入强氧化性物质,②溶液、⑤盐酸、⑥溶液均没有强氧化性。故选:D。
11.答案:A
解析:A.向某溶液中滴加氯水后,再滴加KSCN溶液,溶液变为红色,不能说明原溶液中是否含有,原溶液中可能含有,A错误;
B.淀粉遇碘单质变蓝,则溶液中加入溶液生成碘,可知氧化性:,B正确;
C.反应生成的氧化铝熔点较高,包裹在Al的外面,则金属铝熔化而不滴落下来,C正确;
D.向某溶液中加足量NaOH后,加热产生能使湿润的红色石蕊试纸变蓝的气体,该气体为,说明原溶液中含有,D正确;
故选A。
12.答案:C
解析:A.NaOH溶液应置于Ⅱ中,铁粉和稀置于Ⅰ中,A错误;
B.实验开始要先打开止水夹,用Fe与生成的氢气排装置中的空气,后关闭止水夹,继续生成的使Ⅰ中压强增大,将压入Ⅱ中,B错误;
C.由B知,Ⅱ中发生反应,C正确;
D.可以是稀,不能是,因为,,无法生成还原性气体,不能排除装置内的空气,D错误;
故选C。
13.答案:A
解析:根据可知生成的氧气体积是二氧化碳体积的一半,设二氧化碳体积为xmL,氮气的体积为(50-x)mL,则生成氧气的体积为0.5xmL,列出等式:,解得40,则原混合气体中二氧化碳体积分数:,答案选A;
14.答案:D
解析:加入盐酸体积为25mL-100mL时有气体产生,发生的离子反应为,加入盐酸体积为0-25mL时,发生的离子方程式为:,溶液中溶质的成分为和,物质的量之比为1:2。
A.加入盐酸体积100mL时,溶质的成分为NaCl,根据元素守恒,,氢氧化钠溶液的浓度为,A错误;
B.没有指明标准状况,无法计算的体积,B错误;
C.溶液中溶质的成分为和,C错误;
D.根据分析,溶液中溶质的成分为和,物质的量之比为2:1,D正确;
故选D。
15.答案:(1)(或);33.6;
(2)
(3)氨水;
(4);
解析:氧化铝电解得到单质铝,铝与碱反应生成氢气与四氧基合铝酸钠;二氧化锰与浓盐酸反应生成氯气,氯气与四氧基合铝酸钠反应可得氯化铝,加入氨水可制得氢氧化铝,据此分析;
(1)铝与碱反应生成氢气与四氧基合铝酸钠的化学方程式:或);根据关系式法:,的物质的量为1ml,与足量氢氧化钠溶液反应,生成气体(标况下)的体积为;转移的电子数目;
(2)二氧化锰与浓盐酸反应生成氯气、氯化锰和水,离子方程式为:;
(3)实验室制,因溶解于强碱,故试剂A宜选择氨水,离子方程式为;
(4)1个含有3个,溶液中的物质的量浓度为;取出加水稀释到,根据稀释定律,后所得溶液中物质的量浓度为;
16.答案:(1)
(2)
(3);防止过氧化氢分解
(4);;;B
解析:铝灰的主要成分为(含少量杂质),加稀硫酸,转化为离子,不溶于硫酸,过滤,滤液中含有,加双氧水被氧化为,加入试剂将转化为沉淀过滤,在滤液中加入硫酸铵,生成,结晶、干燥、煅烧得到。
(1)铝灰中氧化铝与硫酸反应的化学方程式为。
(2)铝灰的主要成分为(含少量杂质),其中不溶于硫酸溶液,所以图中“滤渣”的主要成分为。
(3)“氧化”时,可以把氧化为,中的氧元素化合价降低,结合电荷守恒、得失电子相等、元素守恒补差项,发生的离子方程式为,升高温度,过氧化氢易分解,所以该反应需控制温度低于,防止过氧化氢分解。
(4)①,硫酸亚铁中铁元素化合价由+2价升高到+6价,所以硫酸亚铁作还原剂,过氧化钠中的氧元素化合价部分由-1价升高到0价,一部分由-1价降低到-2价,所以过氧化钠既是氧化剂又是还原剂,根据比例关系,每生成,同时生成标准状况下的11.2L,转移的电子数目为。
②若废水中仅大量存在、、和离子,且、、、X离子的浓度之比为1:2:2:1,由于硫酸根与钡离子生成沉淀,X离子不可能为钡离子,结合溶液呈电中性及各离子浓度、所带电荷情况,推出该离子为镁离子。
17.答案:(1)分液漏斗;圆底烧瓶
(2)
(3)除氯气中的氯化氢
(4)
(5)
(6)⑤
(7)干燥氯气(或除氯气中的水蒸气);防止③装置中的水蒸气进入④装置
(8)A
解析:遇水强烈反应,要制备,则装置④前后都需要干燥装置,依次用⑤制备氯气,装置①干燥氯气,④中氯气与铁反应生成氯化铁,装置①防止氢氧化钠溶液中的水蒸气进入④,装置③吸收尾气,防止污染环境。
(1)装置⑤装有浓盐酸的仪器名称为:分液漏斗;
装有的仪器名称为:圆底烧瓶;
(2)根据分析和实验要求,装置接口的连接顺序为:,答案为:;
(3)装置②的作用是:除氯气中的氯化氢;
(4)制备的化学方程式:;
(5)装置③是用氢氧化钠溶液吸收多余的氯气,离子方程式为:;
(6)装置④⑤两处均有酒精灯,实验开始前应先点燃⑤,生成氯气排尽装置中的空气,答案:⑤;
(7)遇水强烈反应,要制备,则装置④前后都需要干燥装置,依次用⑤制备氯气,装置①干燥氯气,④中氯气与铁反应生成氯化铁,装置①防止氢氧化钠溶液中的水蒸气进入④;答案:干燥氯气;防止氢氧化钠溶液中的水蒸气进入④;
(8)在含的浓盐酸中,二氧化锰的物质的量,二者反应的关系式:,随着反应的进行,盐酸浓度降低,稀盐酸不与二氧化锰反应,所以反应①生成的氯气的物质的量不足1ml;而二氧化锰与足量浓盐酸反应可以生成1ml氯气,故所得氯气②比①多,答案选A。
18.答案:(1);
(2)250;玻璃棒;8.5
(3)AC
(4)49.9%(或0.499)
解析:(1)测定过程中盐酸与氢氧化铝均与盐酸发生反应,反应的离子方程式为、;
(2)①该测定实验共进行了4次,共需要160mL稀盐酸,则应选用250mL容量瓶、图中还缺少的玻璃仪器是玻璃棒;使用容量瓶前需要检漏。
②密度为、质量分数为的浓盐酸的物质的量浓度为,实验室用该浓盐酸配制的稀盐酸,需要用到此浓盐酸的体积为
;
(3)A.转移溶液时,未洗涤玻璃棒和烧杯内壁,溶质物质的量偏少,配制的溶液浓度偏低,故选A;
B.配制溶液前容量瓶底部有少量蒸馏水残留,不影响溶液的物质的量和溶液体积,配制的溶液浓度无影响,故不选B;
C.摇匀后发现液面下降,再加水至刻度线,溶液体积偏大,配制的溶液浓度偏低,故选C;
D.溶液未冷却即转移到容量瓶中,溶液体积偏小,配制的溶液浓度偏高,故不选D;
选AC;
(4)根据实验数据计算平均消耗NaOH溶液的体积为,共消耗40.00mL稀盐酸,则与反应的HCl的物质的量,根据反应可知,这种药片中的物质的量为,则的质量分数为;
选项
混合物
纯净物
单质
电解质
非电解质
A
盐酸
石墨
溶液
(蔗糖)
B
空气
胶体
铁
C
水银
铜
D
氨水
胆矾
选项
检验方案
现象
结论
A
向某溶液中滴加氯水后,再滴加溶液
溶液变为红色
原溶液中含有
B
向溶液中加入淀粉溶液
溶液变为蓝色
氧化性:
C
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
金属铝熔化而不滴落下来
金属铝的熔点比氧化铝低
D
向某溶液中加足量后加热
产生能使湿润的红色石蕊试纸变蓝的气体
原溶液中含有
测定次数
第1次
第2次
第3次
第4次
(溶液)
16.04
15.96
16.02
15.98
相关试卷
这是一份广西“贵百河—武鸣高中”2024-2025学年高一上学期12月新高考月考 化学试题,共6页。
这是一份广西壮族自治区“贵百河-武鸣高中”2024-2025学年高一上学期12月月考化学试题,文件包含化学2024级“贵百河武鸣高中”12月高一月考参考答案及详解+评分细则docx、广西“贵百河武鸣高中”2024-2025学年高一上学期12月新高考月考化学试题pdf等2份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。
这是一份广西“贵百河—武鸣高中”2024-2025学年高二上学期11月新高考月考化学试题,共18页。试卷主要包含了本试卷分选择题和非选择题两部分,5 Ca—40等内容,欢迎下载使用。









