






2025版高考化学全程一轮复习第29讲分子的空间结构课件
展开
这是一份2025版高考化学全程一轮复习第29讲分子的空间结构课件,共46页。PPT课件主要包含了考点一,考点二,平面三角形,°28′,四面体形,孤电子对,中心原子的孤电子对数,中心原子的σ键个数,sp2,sp3等内容,欢迎下载使用。
1.掌握价层电子对互斥模型和杂化轨道理论的内容并能用其推测简单分子或离子的空间结构。2.掌握键角大小原因并能作出规范描述。
1.价层电子对互斥模型(1)理论要点①价层电子对在空间上彼此相距最远时,排斥力最小,体系的能量最低。②孤电子对排斥力较大,孤电子对越多,排斥力越强,键角越小。(2)价层电子对数的计算价层电子对数=σ键电子对数+中心原子的孤电子对数
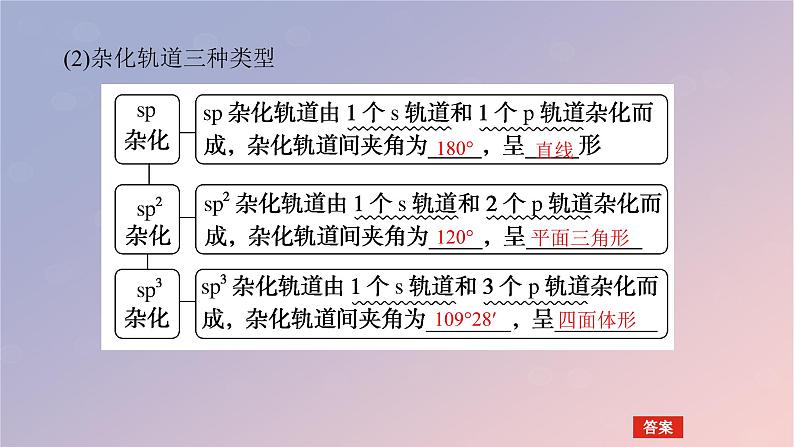
2.杂化轨道理论(1)杂化轨道理论概述中心原子上若干不同类型(主要是s、p轨道)、能量相近的原子轨道混合起来,重新组合成同等数目、能量完全相同的新轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同。
(2)杂化轨道三种类型
(3)由杂化轨道数判断中心原子的杂化类型①杂化轨道用来形成________键和容纳________。②杂化轨道数=________________________+________________=中心原子的价层电子对数。
错误。价层电子对数=σ键电子对数+中心原子的孤电子对数。
【教考衔接】典例 (1)[2022·全国甲卷]CF2===CF2和ETFE分子[乙烯(CH2===CH2)与四氟乙烯(CF2===CF2)的共聚物]中C的杂化轨道类型分别为________和________。
解析:CF2===CF2中C原子形成3个σ键,其C原子的杂化方式为sp2杂化,但其共聚物ETFE中C原子存在4对共用电子对,其C原子为sp3杂化。
(2)[2021·全国甲卷]SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为________。SiCl4可发生水解反应,机理如下:含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为________。
解析:(2)根据SiCl4的结构式可知,Si的价层电子对数为4,故Si采取sp3杂化;根据SiCl4(H2O)的结构式可知Si的价层电子对数为5,采取sp3d杂化。
解析:三氧化硒分子中硒原子的价层电子对数为3,孤对电子对数为0,分子的空间结构为平面三角形,键角为120°,亚硒酸根离子中硒原子的价层电子对数为4,孤电子对数为1,离子的空间结构为三角锥形,键角小于120°。
考向二 杂化方式的判断3.判断下列物质中心原子的杂化方式。(1)PCl3分子中,P的杂化方式为________。(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是________、________。(3)HOCH2CN分子中碳原子的杂化轨道类型是________。(4)丙烯腈分子(H2C===CH—C≡N)中碳原子杂化轨道类型为________。
【易错诊断】 判断正误,错误的说明理由。1.分子中中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体结构:____________________________________________________________。2.NH3分子为三角锥形,N原子发生sp2杂化:___________________________________________________________。3.只要分子构型为平面三角形,中心原子均为sp2杂化:___________________________________________________________。4.中心原子是sp杂化的,其分子构型不一定为直线形:___________________________________________________________。
错误。中心原子若通过sp3杂化轨道成键,且无孤电子对时该分子一定为正四面体结构,否则,分子一定不是正四面体结构。
错误。N原子发生sp3杂化。
错误。中心原子是sp杂化的,其分子构型一定为直线形。
2.已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间结构为( )A.直线形 B.平面正方形C.正四面体形 D.正八面体形
解析:根据杂化轨道理论知,Zn2+的4s轨道和4p轨道形成的sp3杂化轨道为正四面体形,Zn2+再结合4个Cl-形成[ZnCl4]2-,其中Zn2+的孤电子对数为0,所以[ZnCl4]2-的空间结构为正四面体形。
3.大π键中共用电子数的确定方法(1)大π键中共用电子的数目等于垂直于分子或离子平面的p轨道中的电子数目总和。(2)判断出中心原子的杂化方式,并画出价层电子轨道表示式。未参与成键的杂化轨道,优先填充两个电子,形成孤电子对,杂化轨道中的电子不参与形成大π键。(3)根据配位原子的价层电子轨道表示式,判断配位原子中未参与成键且垂直该分子或离子平面的p轨道中电子数目(单电子优先形成π键)。
【典题示例】典例1 确定SO2分子中的大π键,用大π键的符号表示为________。
键长:ClO2sp2>sp3【模型构建】答题模板:×××中心原子采取×××杂化,键角为×××,而×××中心原子采取×××杂化,键角为×××。【模型认知】典例1 Si与C元素位于同一主族,SiO2键角小于CO2的原因是____________________________________________________________。
SiO2中中心Si原子采取sp3杂化,键角为109°28′;CO2中中心C原子采取sp杂化,键角为180°
H2O中中心O原子采取sp3杂化,键角约为105°;CS2中中心C原子采取sp杂化,键角为180°
角度2 价层电子对构型(或中心原子杂化方式)相同,看电子对间的斥力【模型构建】(1)电子对排斥力大小顺序:孤电子对与孤电子对之间>孤电子对与成键电子对之间>成键电子对与成键电子对之间。(2)三键、双键、单键之间的排斥力大小顺序:三键—三键>三键—双键>双键—双键>双键—单键>单键—单键,举例:
答题模板:×××分子中无孤电子对,×××分子中含有n个孤电子对,孤电子对对成键电子对的排斥作用较大,因而键角较小。【模型认知】典例2 已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是_____________,原因为______________________________________________________。
CH4>NH3>H2O
CH4分子中无孤电子对,NH3分子中含有1个孤电子对,H2O分子中含有2个孤电子对,孤电子对对成键电子对的排斥作用依次增大,故键角逐渐减小
角度3 空间结构相同,中心原子相同或配位原子相同,看中心原子或配位原子的电负性【模型认知】典例3 (中心原子不同,配位原子相同)AC3与BC3,若电负性:A>B,则键角:AC3________BC3。原因:______________________________________________________。典例4 (中心原子相同,配位原子不同)AB3与AC3,若电负性:B>A>C,则键角:AB3________AC3。原因为______________________________________________________。
中心原子的电负性A强于B,中心原子的电负性越大,成键电子对离中心原子越近,斥力越大,键角也越大
电负性:B>A>C,在AB3中成键电子对离中心原子较远,斥力较小,因而键角较小
相关课件
这是一份2025版高考化学全程一轮复习第63讲合成高分子有机合成路线设计课件,共42页。PPT课件主要包含了考点一,考点二,聚合反应形成高分子,加成聚合,高分子,缩聚反应,双键或三键,两个或两个以上,答案B,答案D等内容,欢迎下载使用。
这是一份2025版高考化学全程一轮复习第30讲配合物与超分子分子的性质课件,共57页。PPT课件主要包含了考点一,考点二,考点三,空轨道,孤电子对,配位原子,配位体,配位数,配合物的制备,蓝色沉淀等内容,欢迎下载使用。
这是一份2025版高考化学全程一轮复习第28讲化学键课件,共25页。PPT课件主要包含了考点一,考点二,阳离子,非金属之间,不同种,最外层电子,⑥⑦⑧,⑤⑥⑦⑧,答案A,极性键等内容,欢迎下载使用。









