




2025版高考化学全程一轮复习第11讲碳酸钠和碳酸氢钠碱金属课件
展开
这是一份2025版高考化学全程一轮复习第11讲碳酸钠和碳酸氢钠碱金属课件,共53页。PPT课件主要包含了考点一,考点二,化学性质,通入足量CO2,滴加适量NaOH溶液,立即产生气泡,NaHCO3,均产生白色沉淀,NaCl,Na2CO3等内容,欢迎下载使用。
1. 了解碳酸钠、碳酸氢钠的性质,知道碱金属及其化合物的通性,并能用物质分类的思想预测陌生碱金属及其化合物的性质。2.掌握碳酸钠、碳酸氢钠的转化关系。3.了解焰色试验的操作并熟记几种常见金属的焰色。
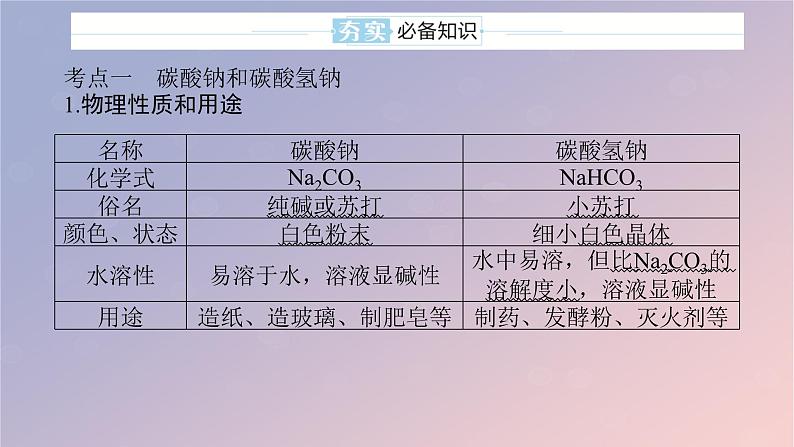
考点一 碳酸钠和碳酸氢钠1.物理性质和用途
【师说·助学】 利用溶液的碱性区别碳酸钠和碳酸氢钠
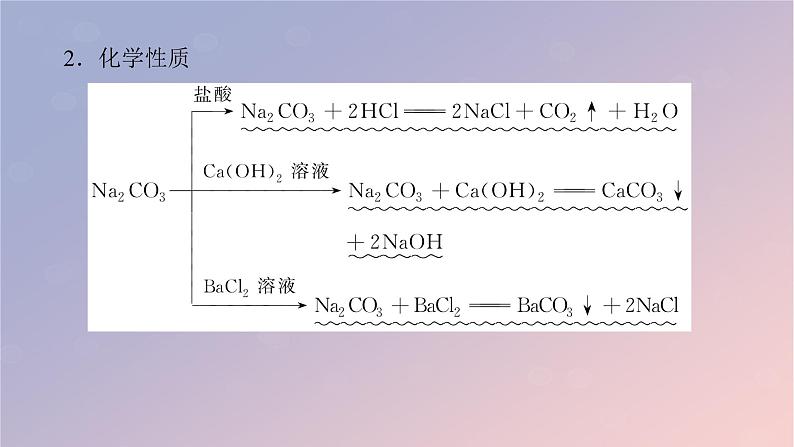
3.相互转化(1)转化关系(2)应用——除杂(括号内物质为杂质)
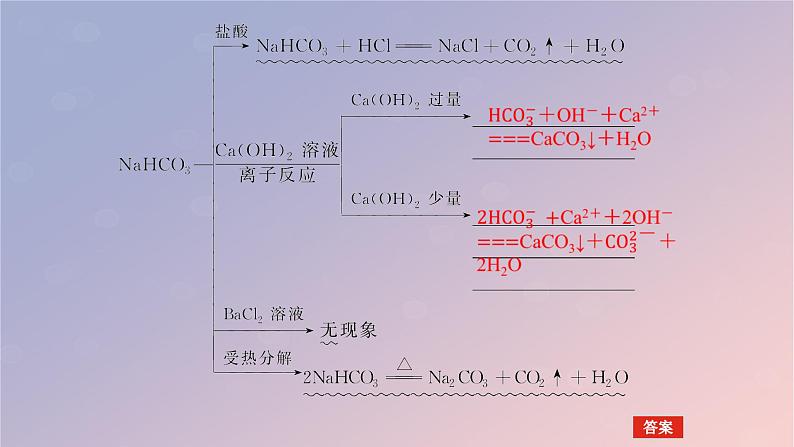
4.向碳酸钠、碳酸氢钠溶液中分别滴加酸的反应特点(1)向碳酸氢钠溶液中逐滴滴入盐酸①现象:________________。②离子方程式:________________________。③画出产生CO2的物质的量随n(HCl)的变化图像________________。
(2)向Na2CO3溶液中逐滴滴入盐酸①写出反应的离子方程式:__________________________________________________。②画出产生CO2的物质的量随n(HCl)的变化图像________________。
【师说·助学】 利用滴加盐酸的方法区别碳酸钠、碳酸氢钠溶液
【易错诊断】 判断正误,错误的说明理由。1.向Na2CO3饱和溶液中通入CO2,会有NaHCO3晶体析出:_______________________________________________________。2.用酚酞溶液可鉴别饱和食盐水和饱和碳酸钠溶液:_______________________________________________________。3.可用Ca(OH)2鉴别Na2CO3和NaHCO3两种溶液:_______________________________________________________。4.用热的纯碱溶液清洗炊具上的油污时,不涉及化学变化:_______________________________________________________。
错误。Ca(OH)2分别遇Na2CO3、NaHCO3溶液现象相同。
【教考衔接】典例1 判断正误。正确的打“√”,错误的打“×”。(1)小苏打的主要成分是Na2CO3[2022·海南卷,1B]( )(2)面包师用小苏打作发泡剂烘焙面包,涉及到的化学知识为Na2CO3可与酸反应[2022·广东卷,6A]( )(3)用石灰水鉴别Na2CO3与NaHCO3[2023·辽宁卷,4A]( )(4)滴入酚酞溶液,现象如下图。[2022·湖北卷,6A]( )
典例2 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________(填装置序号)。(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为____________________________________________________________;与实验Ⅲ相比,实验Ⅳ的优点是________(填字母)。A.Ⅳ比Ⅲ复杂B.Ⅳ比Ⅲ安全C.Ⅳ比Ⅲ操作简便D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________(填化学式)。
解析:(1)图Ⅰ不能达到实验目的,因为碳酸钠和碳酸氢钠均可以与盐酸反应产生二氧化碳,二氧化碳气体使澄清石灰水变浑浊;图Ⅱ可以鉴别,因为等质量的碳酸钠和碳酸氢钠与足量的稀盐酸反应,生成的二氧化碳气体的量不同,可根据气球膨胀程度来判断。(3)试管B装入碳酸氢钠,试管A装入碳酸钠,这样直接加热的碳酸钠,温度高,不分解,澄清石灰水不变浑浊,而间接加热的碳酸氢钠分解,澄清石灰水变浑浊,表明了碳酸氢钠不稳定。
【对点演练】考向一 NaHCO3与碱、盐反应的应用1.分别向Na2CO3、NaHCO3溶液中滴加澄清石灰水,现象为________________,写出NaHCO3与①过量澄清石灰水;②少量澄清石灰水反应的离子方程式。①_____________________________________________________②_____________________________________________________
2.若向NaHCO3溶液中滴加BaCl2溶液,既有沉淀生成又有气泡冒出,试写出反应的离子方程式:___________________________________。
考向二 Na2CO3、NaHCO3与酸反应的定量关系3.将一定物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1 L溶液,取出50 mL溶液,然后滴加一定物质的量浓度的盐酸,得到的图像如图所示。
按要求回答问题:(1)写出依次发生反应的化学方程式:_________________________________________________________。 (2)①代表________的变化曲线;②代表________的变化曲线;③代表________的变化曲线。(3)盐酸的物质的量浓度为____________。(4)加入盐酸为150 mL时,放出的CO2在标准状况下的体积为________。
Na2CO3+HCl===NaCl+NaHCO3、NaHCO3+HCl===NaCl+H2O+CO2↑
0.05 ml·L-1
4.向NaOH和Na2CO3混合溶液中滴加0.1 ml·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。(1)ab斜段发生反应的离子方程式为__________________________。(2)a=________。(3)原混合溶液中NaOH与Na2CO3的物质的量之比为_______。
微专题6 侯氏制碱法与碳酸钠含量的测定专题一 侯氏制碱法【要点归纳】1.制备原料食盐、氨气、二氧化碳——合成氨厂用水煤气制取氢气时的废气;其反应为C+H2O(g)高温CO+H2,CO+H2O(g)高温CO2+H2。
3.反应原理(1)产生NaHCO3的反应:____________________________________。(2)产生Na2CO3的反应:2NaHCO3 Na2CO3+CO2↑+H2O。4.绿色思想:循环使用的物质为_______________。
NH3+NaCl+CO2+H2O===NaHCO3↓+NH4Cl
【典题示例】典例 以下是在实验室模拟“侯氏制碱法”生产流程的示意图:则下列叙述错误的是( )A.A气体是NH3,B气体是CO2B.侯氏制碱法的工艺过程中应用了物质溶解度的差异C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
【对点演练】1.侯氏制碱法的反应之一是:NaCl+H2O+NH3+CO2===NaHCO3↓+NH4Cl,某学习小组先制取NH3和CO2,再模拟侯氏制碱法制碱原理制备Na2CO3,实验过程不需要的实验装置是( )
解析:装置A是制备氨气或二氧化碳气体的反应装置,选项A不选;产生NaHCO3发生的反应为NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,需要过滤得到NaHCO3晶体,用到装置B,选项B不选;制取Na2CO3时,过滤得到NaHCO3晶体洗涤后在装置C中加热灼烧得到碳酸钠,选项C不选;实验过程中不需要蒸发结晶,不需要装置D,故答案选D。
2.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )A.a通入CO2,然后b通入NH3,c中放碱石灰B.b通入NH3,然后a通入CO2,c中放碱石灰C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
解析:由于CO2在水中的溶解度比较小,而NH3极易溶于水,所以在实验中要先通入溶解度较大的NH3,再通入CO2,由于NH3极易溶于水,在溶于水时极易发生倒吸现象,所以通入NH3的导气管的末端不能伸入到溶液中,即a先通入NH3,然后b通入CO2,A、B、D均错误;因为NH3是碱性气体,所以过量的NH3要用稀硫酸来吸收,故答案选C。
【典题示例】典例 为了测定NaCl、Na2CO3·10H2O和NaHCO3的混合物中各组分的含量,某同学设计如下实验:取一定质量的混合物,通过测量反应前后②和③装置质量的变化,测定该混合物中各组分的质量分数。
下列说法中错误的是( )A.①②③中可以依次盛装碱石灰、无水CaCl2、碱石灰B.硬质玻璃管加热前,应关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止C.若将①装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量偏大D.实验过程中一直通入空气,停止加热后再停止通入空气
解析:根据实验目的和装置的连接顺序可知:装置①用于吸收空气中的CO2和水蒸气,可以使用碱石灰;装置②吸收Na2CO3·10H2O和NaHCO3分解生成的水蒸气,可以使用无水CaCl2;装置③吸收碳酸氢钠分解生成的CO2,使用碱石灰,A项正确;实验前必须将装置中的水蒸气和CO2赶净,避免影响测定结果,硬质玻璃管加热前,应关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止,B项正确;若将①装置换成盛放NaOH溶液的洗气瓶,则会增加水的质量,使测得Na2CO3·10H2O和NaHCO3的含量偏高,NaCl的含量偏低,C项错误;实验过程中一直通入空气,停止加热后继续通入空气使存留在装置中的CO2和水蒸气完全被吸收,D项正确。
【对点演练】小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:Ⅰ.加热分解法利用下图甲装置,充分加热小苏打样品。(1)仪器a的名称为________。(2)在实验过程中,需要测量的实验数据有:①仪器a的质量;②__________________________;③___________________________________。
加热前,仪器a和样品的总质量
加热冷却后,仪器a和残留物的总质量
Ⅱ.测量气体体积法利用图乙装置,测定反应生成气体的体积。(3)组装好仪器后,首先进行的操作为_______________。(4)导管g的作用为_____________________________________________________________________________________________________________________________。
平衡分液漏斗与锥形瓶内的气压,使液体顺利流下;滴入锥形瓶的稀硫酸的体积等于进入分液漏斗的气体体积,从而消除因加入稀硫酸而引起的气体体积误差
(5)为了减小实验误差,B、C中最好用___________溶液代替水。(6)待反应结束,气体冷却至室温后,利用图示装置读取气体体积时,应注意的事项有:①______________________________________;②______________________________________。(7)若所取样品的质量为m g,反应前量气管C的读数为V1 mL,反应结束后量气管C的读数为V2 mL,则样品中NaHCO3和Na2CO3的物质的量之和为________(气体体积均已换算为标准状况下的体积)。
读数时应上下移动C管,使B、C两管液面相平
考点二 碱金属 焰色试验1.相似性和递变性
2.特殊性(1)碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠的小。(2)碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。(3)碱金属跟氢气反应生成的碱金属氢化物都是离子化合物,其中氢以H-形式存在,显-1价,碱金属氢化物是强还原剂。(4)一般情况下,碱金属所形成的盐均溶于水,并且在一定温度下,酸式盐比正盐的溶解度大(但NaHCO3的溶解度比Na2CO3的小)。(5)试剂瓶中的药品取出后,一般不能放回原瓶,但金属Na、K等需立即放回原瓶。(6)锂与O2反应与钠不同,只生成Li2O,而不生成Li2O2。
【师说·助学】 碱金属氢化物——强还原剂碱金属跟氢气反应生成的碱金属氢化物(RH)····都是离子化合物,其中氢以H-形式存在,显-1价,碱金属氢化物是强还原剂。
3.焰色反应(1)焰色反应:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊颜色的现象。属于________变化。(2)操作步骤清洗铂丝:将铂丝用盐酸洗净,在外焰上灼烧至与原来的火焰颜色相同。灼烧试样:蘸取试样在外焰上灼烧,观察火焰的颜色。清洗铂丝:将铂丝再用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同。【师说·助学】 铂丝用盐酸洗净,而不用稀硫酸洗涤,其原因是金属氯化物在灼烧时易挥发,而硫酸盐难以挥发,会对后续实验造成干扰。
(3)常见金属元素的焰色钠元素:黄色;钾元素:____色(透过___________观察);钡元素:黄绿色;钙元素:砖红色;铜元素:蓝绿色。
【易错诊断】 判断正误,错误的说明理由。1.ⅠA族元素又称碱金属元素:________________________________________________________。2.碱金属元素Li、Na、K都可保存在煤油中:________________________________________________________。3.焰色反应是一种复杂的化学变化:________________________________________________________。4.钠、氧化钠、碳酸钠的焰色反应均显黄色:________________________________________________________。
错误。ⅠA族除H以外的元素称碱金属元素。
错误。Li保存在石蜡中,Na、K可保存在煤油中。
错误。焰色反应属于物理变化。
【教考衔接】典例1 用“>”或“
相关课件
这是一份新高考化学一轮复习课件第4章 第13讲 碳酸钠和碳酸氢钠 碱金属(含解析),共60页。PPT课件主要包含了碳酸钠和碳酸氢钠,必备知识,应用举例,关键能力,碱金属焰色试验,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份2025届高中化学全程复习构想课件全套11碳酸钠和碳酸氢钠 碱金属,共54页。PPT课件主要包含了考点一,考点二,化学性质,通入足量CO2,滴加适量NaOH溶液,立即产生气泡,NaHCO3,均产生白色沉淀,NaCl,Na2CO3等内容,欢迎下载使用。
这是一份高考化学一轮复习第4章金属及其化合物第13讲碳酸钠和碳酸氢钠碱金属课件,共46页。PPT课件主要包含了Na2CO3,NaHCO3,纯碱或苏打,小苏打,2NaHCO3,3相互转化,2图像分析,强还原等内容,欢迎下载使用。









