

所属成套资源:十年高考化学真题(2014-2023)分项汇编专题(Word版附解析)
十年高考化学真题(2014-2023)分项汇编专题17氧化还原反应相关计算(Word版附解析)
展开
这是一份十年高考化学真题(2014-2023)分项汇编专题17氧化还原反应相关计算(Word版附解析),共11页。
下列说法正确的是
A.和的空间结构都是正四面体形
B.反应Ⅰ和Ⅱ中,元素和S都被氧化
C.反应Ⅰ和Ⅱ中,参加反应的:ⅠⅡ,C错误;D.中As为+3价,S为-2价,在经过反应Ⅰ后,As的化合价没有变,S变为+2价,则1ml失电子3×4ml=12ml;在经过反应Ⅱ后,As变为+5价,S变为+6价,则1ml失电子2×2ml+3×8ml=28ml,则反应Ⅰ和Ⅱ中,氧化转移的电子数之比为3∶7,D正确;故选D。
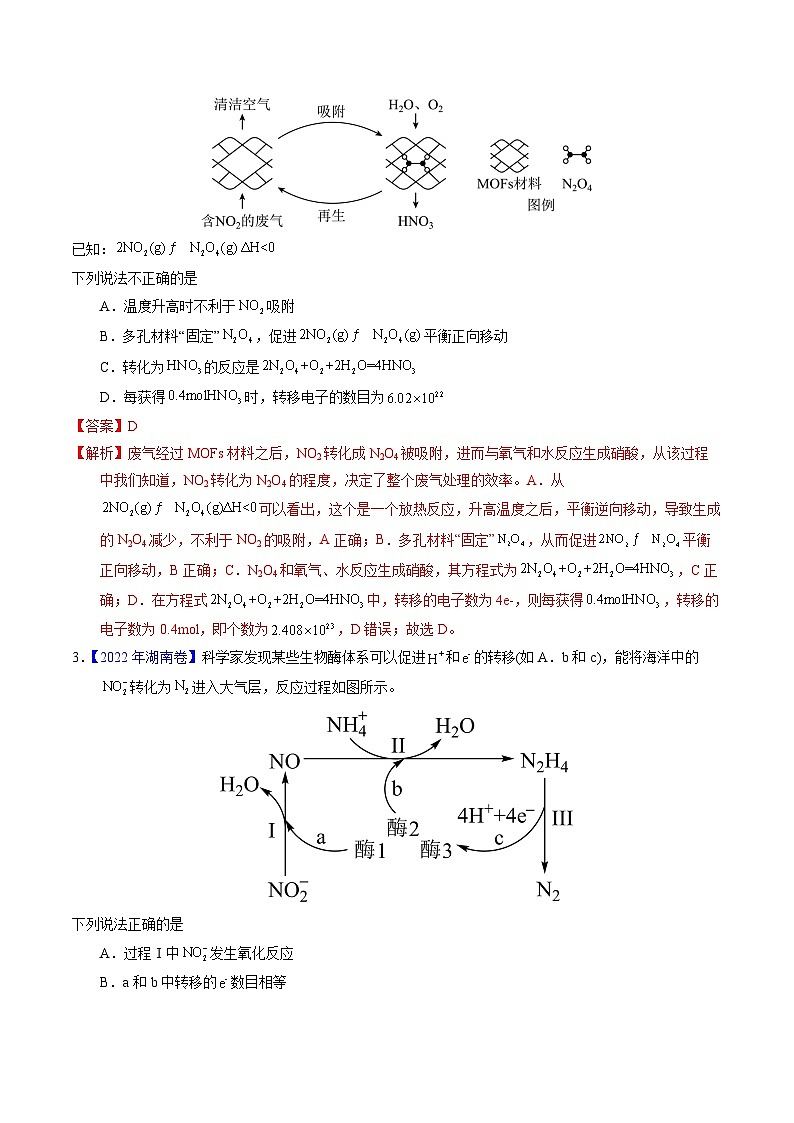
2.【2022年北京卷】某多孔材料孔径大小和形状恰好将“固定”,能高选择性吸附。废气中的被吸附后,经处理能全部转化为。原理示意图如下。
已知:
下列说法不正确的是
A.温度升高时不利于吸附
B.多孔材料“固定”,促进平衡正向移动
C.转化为的反应是
D.每获得时,转移电子的数目为
【答案】D
【解析】废气经过MOFs材料之后,NO2转化成N2O4被吸附,进而与氧气和水反应生成硝酸,从该过程中我们知道,NO2转化为N2O4的程度,决定了整个废气处理的效率。A.从可以看出,这个是一个放热反应,升高温度之后,平衡逆向移动,导致生成的N2O4减少,不利于NO2的吸附,A正确;B.多孔材料“固定”,从而促进平衡正向移动,B正确;C.N2O4和氧气、水反应生成硝酸,其方程式为,C正确;D.在方程式中,转移的电子数为4e-,则每获得,转移的电子数为0.4ml,即个数为,D错误;故选D。
3.【2022年湖南卷】科学家发现某些生物酶体系可以促进和的转移(如A.b和c),能将海洋中的转化为进入大气层,反应过程如图所示。
下列说法正确的是
A.过程Ⅰ中发生氧化反应
B.a和b中转移的数目相等
C.过程Ⅱ中参与反应的
D.过程Ⅰ→Ⅲ的总反应为
【答案】D
【解析】A.由图示可知,过程I中NO转化为NO,氮元素化合价由+3价降低到+2价,NO作氧化剂,被还原,发生还原反应,A错误;B.由图示可知,过程I为NO在酶1的作用下转化为NO和H2O,依据得失电子守恒、电荷守恒和原子守恒可知,反应的离子方程式为:NO+2H++e-NO+H2O,生成1mlNO,a过程转移1mle-,过程II为NO和NH在酶2的作用下发生氧化还原反应生成H2O和N2H4,依据得失电子守恒、电荷守恒和原子守恒可知,反应的离子方程式为:NO+NH+3e-+2H+H2O+N2H4,消耗1mlNO,b过程转移4ml e-,转移电子数目不相等,B错误;C.由图示可知,过程II发生反应的参与反应的离子方程式为:NO+NH+3e-+2H+H2O+N2H4,n(NO):n(NH)=1:1,C错误;D.由图示可知,过程I的离子方程式为NO+2H++e-NO+H2O,过程II的离子方程式为NO+NH+3e-+2H+H2O+N2H4,过程III的离子方程式为N2H4N2↑+4H++4e-,则过程Ⅰ→Ⅲ的总反应为NO+ NH= N2↑+2H2O,D正确;答案选D。
4.(2016·浙江高考真题)已知氧化性,向含溶质的溶液中通入,充分反应.下列说法不正确的是
A.离子的还原性强弱:
B.当时,发生的离子反应:
C.当时,反应后的离子浓度:∶∶∶2∶2
D.当时,发生的离子反应:
【答案】C
【解析】氧化性,则还原性,首先发生反应:,反应完毕,再发生反应:,aml的溶液中含有、,据此分析解答。A.氧化性越强,相应离子的还原性越弱,故离子的还原性强弱:,正确; B.消耗,当时,只有被氯气氧化,反应离子方程式为:,正确; C.当时,由可知,消耗,生成、,由可知,,消耗,又生成,溶液中剩余为aml,反应后的离子浓度:∶∶∶a∶∶1∶2,错误;D.消耗,消耗,当时,、完全被氧化,发生的离子反应:,正确; 故选C。
5.(2017·海南高考真题)在酸性条件下,可发生如下反应: +2M3++4H2O=+Cl-+8H+, 中M的化合价是 ( )
A.+4B.+5C.+6D.+7
【答案】C
【解析】根据离子反应方程式中,反应前后所带电荷数相等,即6-1=8-n-1,解得n=2,从而得出M2O7n-中M的化合价为+6价,故C正确。
6.(2016·上海高考真题)某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好将Fe2+完全氧化。x值为( )
A.0.80B.0.85C.0.90D.0.93
【答案】A
【解析】FexO中Fe的平均化合价为+,被氧化为Fe3+,根据电子守恒可知,转移的电子数和Cl2转移的电子数相等.标准状况下112mL Cl2转移电子数为×2=0.01ml.则有:×(3-)×x=0.01ml,解得x=0.8,故选A。
7.(2014·山东高考真题)等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
A.FeOB.Fe2O3C.FeSO4D.Fe3O4
【答案】A
【解析】假设质量都为mg:A.FeO与硝酸反应被氧化生成Fe3+,则失电子物质的量为ml;B.Fe2O3与硝酸不发生氧化还原反应,失电子为0;C.FeSO4与硝酸反应被氧化生成Fe3+,则失电子物质的量为ml;D.Fe3O4中Fe元素的化合价有+2、+3价,与硝酸反应被氧化生成Fe3+,则失电子物质的量为ml,由以上分析可知,失电子最多的是FeO,则放出NO物质的量最多的是FeO;故选A。
8、【2015上海化学】工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中( )
A.硫元素既被氧化又被还原
B.氧化剂与还原剂的物质的量之比为1:2
C.每生成1mlNa2S2O3,转移4ml电子
D.相同条件下,每吸收10m3SO2就会放出2.5m3CO2
【答案】A、D
【解析】在反应物Na2S中S元素的化合价为-2价,在SO2中S元素的化合价为+4价,反应后产生的物质Na2S2O3中,S元素的化合价为+2价,介于-2价与+4价之间,因此硫元素既被氧化又被还原,正确。B.根据题意可得在溶液中发生反应的方程式是:Na2CO3+2Na2S+ 4SO2= 3Na2S2O3+CO2,在反应中氧化剂SO2与还原剂Na2S的物质的量之比为4:2=2:1,错误。C.根据B选项的河西方程式可知,每生成3mlNa2S2O3,转移8ml电子,则产生1ml Na2S2O3,转移8/3ml电子,错误。D.根据反应方程式可知消耗的SO2与产生的CO2的物质的量的比是4:1,由于在相同条件下,气体的物质的量的比等于气体的体积比,所以在相同条件下,每吸收10m3SO2放出CO2的体积5m3,正确。
9.【2014年高考山东卷第9题】等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是( )
A.FeO B. Fe2O3 C. FeSO4 D、Fe3O4
【答案】A
【解析】比较化学反应生成物的量的判断,根据氧化还原反应原理,比较各选项物质中+2价Fe的含量,然后可得出NO的生成量的大小。根据化学式可算出四种物质中+2价Fe含量最大的是FeO,所以等质量的四种物质与足量稀硝酸反应,放出NO物质的量最多的是FeO,故A项正确。正确的标出各物质中Fe元素的化合价,如Fe3O4中,两个Fe为+3价,一个Fe化合价为+2价,通过比较可知FeO中+2价Fe的含量最高,根据氧化还原反应原理可推出正确答案。
10.【2012年高考海南卷第6题】将0.195g锌粉加入到20.0mL的0.100 ml·L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
A.M B.M2+ C.M3+ D.MO2+
【答案】B
【解析】根据我们所学的氧化还原反应,在反应中一定存在得失电子守恒。设反应后X元素的化合价为x,参加反应的MO2+的物质的量为0.002ml,参加反应的锌的物质的量为0.003ml,故存在:(5-x)×0.002=0.003×2,解得x=2,故选B。
11.【2014年高考全国大纲卷第13题】已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且的值与温度高低有关。当n(KOH)=aml时,下列有关说法错误的是( )
A.若某温度下,反应后=11,则溶液中=
B.参加反应的氯气的物质的量等于aml
C.改变温度,反应中转移电子的物质的量ne的范围:aml≤ne≤aml
D.改变温度,产物中KC1O3的最大理论产量为aml
【答案】D
【解析】A项若反应后=11,令KC1、KClO分别为11 ml、1 ml,据得失电子守恒可得KC1O3为2 ml,则溶液中=,正确;B项据原子守恒n(KOH)=aml=n(K) =n(Cl) =2n(Cl2),则n(Cl2) =aml,正确;C项采用极限法分析,当全部生成KC1、KClO时发生的反应为Cl2+2KOH=KCl+KClO+H2O,则ne=aml,同理,当全部生成KC1、KClO3时发生的反应为3Cl2+6KOH=5KCl+KClO3+3H2O,则ne=aml,综上可得改变温度,反应中转移电子的物质的量ne的范围:aml≤ne≤aml,该项正确;D项改变温度,产物中KC1O3的最大理论产量即无KClO生成,发生如下反应:3Cl2+6KOH=5KCl+KClO3+3H2O,则KC1O3的物质的量为aml,故该项错误。
12.【2014年高考上海卷第16题】含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50mg,则( )
A.被氧化的砒霜为1.98mg B.分解产生的氢气为0.672ml
C.和砒霜反应的锌为3.90mg D.转移的电子总数为6×10―5NA
【答案】C
【解析】根据题意可知,有关反应的化学方程式为As2O3+6Zn+12HCl→6ZnCl2+3H2O+2AsH3↑、2AsH3→2As+3H2↑,则A、砒霜中砷的化合价是+3价,而砷化氢中砷的化合价是-3价,化合价降低得到电子,砒霜被还原,A不正确;B、不能确定砷化氢的状态,因此不能确定砷化氢的体积,B不正确;C、1.50mg砷的物质的量=1.50×10-3g÷75g/ml=2×10-5ml,则砒霜转化为砷化氢得到电子的物质的量是2×10-5ml ×6=1.2×10-4ml。锌失去2个电子,则根据电子得失守恒可知,和砒霜反应的锌的质量= EQ \f(1.2×10-4ml,2)×65g/ml=3.9×10-3g=3.9mg, C正确;D、两次反应中转移的电子总数为(2×10-5×6+2×10-5×3)NA=1.8×10―4NA,D不正确,答案选C。
13.(2013·四川高考真题)1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL (换算为标准状况),向反应后的溶液中加入1.0ml/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2 ︰1
B.该浓硝酸中HNO3的物质的量浓度是14.0ml/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54沉淀时,加入NaOH溶液的体积是600mL
【答案】D
【解析】设铜、镁的物质的量分别为x、y,则①64x+24y=1.52②64x+24y+34x+34y=2.54,解得x=0.02ml,y=0.01 ml,设N2O4、NO2的物质的量分别为a、b,则根据得失电子数相等:2x+2y=2a+b,a+b=0.05,则a=0.01ml,b=0.04ml。A、有上述分析可知,Cu和Mg的物质的量分别为0.02ml、0.01ml,二者物质的量之比为2 ︰1,A正确;B、c(HNO3)=ml/L=14.0ml·L-1,B正确;C、由上述分析可知,N2O4、NO2的物质的量分别为0.01ml、0.04ml,则NO2的体积分数是×100%=80%,C正确;D、沉淀达最大时,溶液中只有硝酸钠,根据原子守恒:n(NaOH)=n(HNO3)-(2a+b)=0.7ml-0.06ml=0.64ml,氢氧化钠溶液体积为640mL,D错误;答案选D。
14.(2012·四川高考真题)向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0ml/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O的物质的量之比为2∶1B.硝酸的物质的量浓度为2.6ml/L
C.产生的NO在标准状况下的体积为4.48LD.Cu、Cu2O与硝酸反应后剩余HNO3为0.2ml
【答案】B
【解析】设Cu和Cu2O的物质的量分别为xml、yml,根据题意,则有
64x+144y=27.2……①
由Cu→Cu(OH)2、Cu2O→2Cu(OH)2可得34x+68y-16y=39.2-27.2……②
解得x=0.2、y=0.1
A、Cu与Cu2O的物质的量之比为0.2∶0.1=2∶1,A正确;B、根据氮原子守恒可知硝酸的物质的量为1.0ml+(0.2 ml×2+0.1 ml×2)/3=1.2 ml,硝酸的物质的量浓度为1.2 ml /0.5L =2.4 ml/L,B不正确;C、根据电子得失守恒可知产生的NO在标准状况下的体积为22.4L/ ml×(0.2 ml×2+0.1 ml×2)/3=4.48L,C正确;D、根据氮原子守恒可知Cu、Cu2O与硝酸反应后剩余HNO3为1.0ml-0.2 ml×2-0.1 ml×2×2=0.2ml,D正确。答案选B。
15.(2020·江苏高考真题)次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂。 NaClO可用于制备二氯异氰尿酸钠.
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备 NaClO的离子方程式为__________;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是__________________。
(2)二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为
准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①通过计算判断该样品是否为优质品_______。(写出计算过程, )
②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值____________(填“偏高”或“偏低”)。
【答案】(1) NaClO溶液吸收空气中的CO2后产生HClO,HClO见光分解 (2)
根据物质转换和电子得失守恒关系:
得
氯元素的质量:
该样品的有效氯为:
该样品的有效氯大于60%,故该样品为优质品 偏低
【解析】
(1) 由题意可知,氯气通入氢氧化钠中产生次氯酸钠,同时产生氯化钠,反应的离子方程式为:;次氯酸钠溶液长期暴露在空气中会吸收空气中的二氧化碳气体,因次氯酸酸性比碳酸弱,因此次氯酸钠可以与二氧化碳在水中反应产生HClO,HClO具有不稳定性,在受热或见光条件下会发生分解反应,产生HCl和O2,从而是次氯酸钠失效,故答案为:;NaClO溶液吸收空气中的CO2后产生HClO,HClO见光分解;
(2) ①由题中反应可知,在酸性条件产生HClO,HClO氧化碘离子产生碘单质,碘单质再用硫代硫酸钠滴定,结合反应转化确定物质之间的关系为:, ,根据物质转换和电子得失守恒关系:得n(Cl)=0.5=,
氯元素的质量:m(Cl)= =0.03550g,该样品中的有效氯为: =63.39%,
该样品中的有效氯大于60%,故该样品为优质品
故答案为:n(S2O)=,根据物质转换和电子得失守恒关系:,得n(Cl)=0.5=,
氯元素的质量:m(Cl)= =0.03550g,该样品中的有效氯为: =63.39%,
该样品中的有效氯大于60%,故该样品为优质品
②如果硫酸的用量过少,则导致反应不能充分进行,产生的HClO的量偏低,最终导致实验测得的有效氯含量会偏低,
故答案为:偏低;
16.(2016·全国高考真题)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
【答案】(1)+3价 (2)2NaClO3+SO2+H2SO4=2NaHSO4+ClO2↑ (3)NaOH Na2CO3 O2 (4)2:1 氧化产物为NaClO3 (5)1.57g
【解析】
(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3价;
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,回收产物为NaHSO4,说明生成硫酸氢钠,且产生ClO2,根据电子守恒可知,此反应的化学方程式为:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2;
(3)食盐溶液中混有Mg2+ 和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+,ClO2氧化能力强,根据结晶干燥后的产物可知ClO2的还原产物为NaClO2,因此电解装置中阴极ClO2得电子生成ClO2-,阳极Cl-失电子生成Cl2;
(4)依据图示可知,利用含过氧化氢的氢氧化钠溶液吸收ClO2,产物为ClO2-,则此反应中ClO2为氧化剂,还原产物为ClO2-,化合价从+4价降为+3价,H2O2为还原剂,氧化产物为O2,每摩尔H2O2得到2ml电子,依据电子守恒可知氧化剂和还原剂的物质的量之比为2∶1;(5)1gNaClO2的物质的量=ml,依据电子转移数目相等,NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,可知氯气的物质的量为ml×4×=ml,则氯气的质量为ml×71g/ml=1.57g。
相关试卷
这是一份十年高考化学真题(2014-2023)分项汇编专题02化学与材料(Word版附解析),共7页。
这是一份十年高考化学真题(2014-2023)分项汇编专题06化学用语(Word版附解析),共11页。试卷主要包含了下列表示不正确的是,下列表示正确的是等内容,欢迎下载使用。
这是一份十年高考化学真题(2014-2023)分项汇编专题10化学计算(Word版附解析),共14页。试卷主要包含了【2016年高考新课标Ⅰ卷】,【2016年高考上海卷】,【2014年高考上海卷第十等内容,欢迎下载使用。








