



所属成套资源:2025随州部分高中联考协作体高一上学期12月联考及答案(九科)
2025随州部分高中联考协作体高一上学期12月联考化学试题含答案
展开
这是一份2025随州部分高中联考协作体高一上学期12月联考化学试题含答案,文件包含湖北省随州市部分高中联考协作体2024-2025学年高一上学期12月月考化学试题docx、湖北省随州市部分高中联考协作体2024-2025学年高一上学期12月月考化学试题答案docx等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
本试卷共6页,全卷满分100分,考试用时75分钟。
考试时间:2024年12月24日下午
★祝考试顺利★
注意事项:
1、答题前,请将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准考证号条形码粘贴在答题卡上的制定位置。
2、选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试卷、草稿纸和答题卡上的非答题区域均无效。
3、非选择题作答:用黑色签字笔直接答在答题卡对应的答题区域内,写在试卷、草稿纸和答题卡上的非答题区域均无效。
4、考试结束后,请将答题卡上交。
一、选择题:本题共15小题,每题3分,共45分,每小题仅有一项是符合题意。
1、材料是人类赖以生存和发展的物质基础,下列材料主要成分属于有机物的是( )
A.石墨烯B.不锈钢
C.石英光导纤维D.聚酯纤维
2、下列反应的离子方程式不正确的是( )
A.Cl2通入氢氧化钠溶液:Cl2+2OH-===Cl-+ClO-+H2O
B.氧化铝溶于氢氧化钠溶液:Al2O3+2OH-===2AlOeq \\al(-,2)+H2O
C.过量CO2通入饱和碳酸钠溶液:2Na++COeq \\al(2-,3)+CO2+H2O===2NaHCO3↓
D.H2SO3溶液中滴入氯化钙溶液:SOeq \\al(2-,3)+Ca2+===CaSO3↓
3、向某可能含有H+、NHeq \\al(+,4)、Mg2+、Al3+、NOeq \\al(-,3)的溶液中逐滴加入NaOH溶液,产生沉淀的物质的量随所加NaOH溶液的体积的变化图像如图所示。图中各点对应的溶液中离子可以大量共存的是( )
A.a点:COeq \\al(2-,3)、Cl-、K+ B.b点:SOeq \\al(2-,4)、NOeq \\al(-,3)、Fe3+
C.c点:I-、Br-、Ba2+ D.d点:HCOeq \\al(-,3)、CH3COO-、Na+
4、关于反应4CO2+SiH4eq \(=====,\s\up7(高温))4CO+2H2O+SiO2,下列说法正确的是( )
A.CO是氧化产物 B.SiH4发生还原反应
C.氧化剂与还原剂的物质的量之比为1∶4
D.生成1 ml SiO2时,转移8 ml电子
5、在硫酸溶液中NaClO3和Na2SO3按2∶1的物质的量之比完全反应,生成一种棕黄色气体X。则X为( )
A.Cl2 B.ClO2
C.Cl2O D.Cl2O5
6、倒置的坩埚盖子上放硫粉,在硫粉中央放一小块钠,按图示搭建装置,用胶头滴管向金属钠滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是( )
A.水是钠与硫反应的催化剂 B.酚酞的水溶液可能变为红色
C.钠与硫的反应是放热反应 D.滤纸逐渐变黑
7、焰色试验过程中铂丝的清洗和灼烧与钾焰色的观察两项操作如图所示。下列叙述中不正确的是( )
铂丝的清洗和灼烧 观察钾的焰色
A.每次实验中都要先将铂丝灼烧到火焰无色,再蘸取被检验物质
B.钾的焰色要透过蓝色钴玻璃观察
C.实验时最好选择本身颜色较深的火焰
D.可用焰色试验鉴别NaCl与KCl溶液
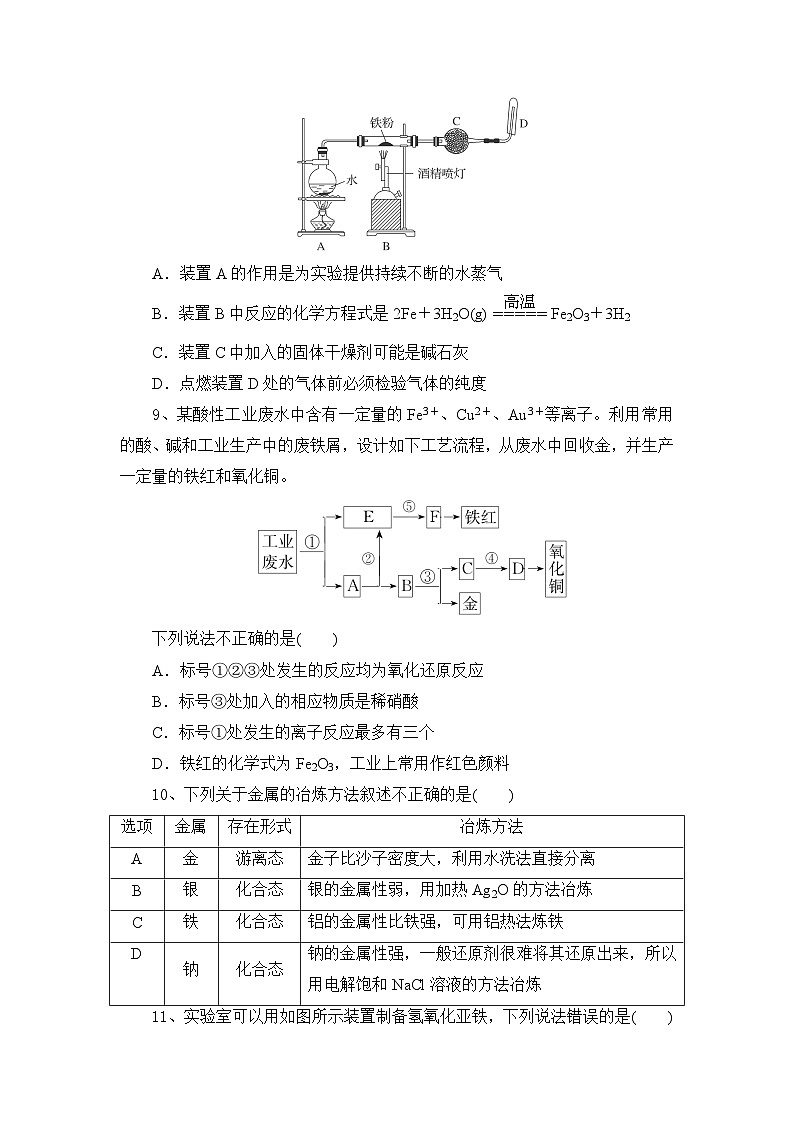
8、用如图所示装置进行Fe与水蒸气反应的实验(部分夹持装置已略去),下列有关说法不正确的是( )
A.装置A的作用是为实验提供持续不断的水蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g)eq \(=====,\s\up7(高温))Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
9、某酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。利用常用的酸、碱和工业生产中的废铁屑,设计如下工艺流程,从废水中回收金,并生产一定量的铁红和氧化铜。
下列说法不正确的是( )
A.标号①②③处发生的反应均为氧化还原反应
B.标号③处加入的相应物质是稀硝酸
C.标号①处发生的离子反应最多有三个
D.铁红的化学式为Fe2O3,工业上常用作红色颜料
10、下列关于金属的冶炼方法叙述不正确的是( )
11、实验室可以用如图所示装置制备氢氧化亚铁,下列说法错误的是( )
A.实验前应把稀硫酸和氢氧化钠溶液均煮沸处理
B.实验开始阶段,应把弹簧夹C和D都打开
C.一段时间后,关闭弹簧夹C和D,在B中生成白色絮状沉淀
D.实验结束后关闭弹簧夹D,可以长时间保存氢氧化亚铁
12、用铬铁合金(含少量Ni、C单质)生产硫酸铬的工艺流程如下:
已知浸出液中主要金属阳离子为Ni2+、C2+、Cr3+、Fe2+,下列说法正确的是( )
A.“浸出”产生的气体主要为SO2
B.“滤渣1”的主要成分为NiS、CS
C.“沉铁”步骤主要反应的离子方程式为:Fe2++C2Oeq \\al(2-,4)===FeC2O4↓
D.整个流程中铬元素先被氧化为+6价,后被还原为+3价
13、下列关于原子结构、原子轨道的说法正确的是( )
A.N能层中有4s、4p、4d、4f四个能级,共16个轨道,可容纳32种运动状态的电子
B.在K能层中,有自旋相反的两条轨道
C.s电子绕核运动,其轨道为球面,而p电子在哑铃形曲面上运动
D.电子云通常是用小黑点来表示电子的多少
14、反应Na2HPO4+NH3·H2O+MgCl2===NH4MgPO4↓+2NaCl+H2O可用于处理含磷废水,下列说法正确的是( )
A.半径大小:r(Na+)>r(Mg2+) B.酸性强弱:H3PO4>HClO4
C.电离能大小:I1(O)>I1(N) D.电负性大小:χ(H)>χ(N)
15、下列常见分子中σ键、π键判断正确的是( )
A.Ceq \\al(2-,2)与Oeq \\al(2+,2)互为等电子体,1 ml Oeq \\al(2+,2)中含有的π键数目为2NA
B.CO与N2结构相似,CO分子中σ键与π键数目之比为2∶1
C.CN-与N2结构相似,CH2===CHCN分子中σ键与π键数目之比为1∶1
D.已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 ml N—H键断裂,则形成的π键数目为6NA
二、非选择题:本题共4小题,共55分。
16、(13分)
经检测,某化工厂排出的废水呈酸性,且其中含有大量 Na+、Cu2+、SOeq \\al(2-,4)、Cl-、NOeq \\al(-,3)。回答下列问题:
(1)下列离子中,能大量存在于该废水中的是________(填字母)。
A.Ag+B.Mg2+
C.OH-D.HCOeq \\al(-,3)
(2)取100 mL该废水于烧杯中,逐滴加入NaOH溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是Na+、__________(用离子符号表示)。
(3)某化学社团小组成员欲除去废水样品中的Cu2+和SOeq \\al(2-,4),最终得到中性溶液,设计的方案流程如图:
①试剂c为________(填化学式);溶液3所含溶质离子有Cl-、________。
②“分离操作”的名称是________,需用到的玻璃仪器主要有________________。
③向“白色沉淀2”中加入足量盐酸,发生反应的离子方程式为________________________________。
17、(14分)
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法:
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。确定CaCl2溶液是否过量的方法是_________________________ _______________________________________________,洗涤沉淀并判断沉淀是否洗净的操作是______________________________________________________
________________________________________________________________________________________________________________________________________________。
(2)乙组:气体分析法:
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是____________________,选用该溶液后实验结果还是不准确,原因是___________________________________________
____________________________________________________________________ __________________________________________________________________________________________________。
(3)请你设计一个与甲、乙两组操作不同的实验方案,测定混合物中Na2CO3的含量。
方法:_________________________________________________;
试剂:_________________________________________________。
用到的玻璃仪器:_________________________________(至少2件)。
18、(14分)
高铁酸钠(Na2FeO4)为紫色固体,易溶于水,微溶于NaOH溶液,具有强氧化性,可以杀菌消毒,是一种新型、高效、多功能的水处理剂。某化学实验小组利用NaClO在碱性介质中与FeCl3溶液的反应制备Na2FeO4并探究其性质,实验装置如图所示。
甲 乙 丙 丁
请回答下列问题:
(1)橡胶管a的作用是_________________________________________,装置甲中反应的化学方程式为______________________________________________
__________________________________________________________________________________________________________。
(2)若去掉装置乙,其不足之处为____________________________________。
(3)当装置丁中出现________________________________________现象时,关闭K1;此时向装置丙中加入FeCl3溶液。
(4)装置丙中生成Na2FeO4的离子方程式为___________________________ _____________________________________________。
(5)反应后,向装置丙中加入饱和的______________(填化学式)溶液,析出紫色晶体,过滤、洗涤、干燥。
(6)取少量Na2FeO4晶体加入浑浊的泥浆水中,泥浆水很快澄清,同时产生气体。请结合化学方程式分析Na2FeO4的净水原理:____________________ ____________________________________________________________________________________________________________________________。
19、(14分)
(1)请用以下物质的序号填空:①NaCl ②Na2O2 ③NaOH ④AlCl3 ⑤H2O2 ⑥N2 ⑦NH4Cl ⑧CO2 ⑨He ⑩P4
其中只含有共价键的化合物有________,含有非极性共价键的离子化合物有________,含有极性共价键的离子化合物有________,不含共价键的化合物有________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为________________;若XY2为共价化合物,其结构式为__________。
(3)现有a~g 7种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:
①元素的原子间反应最容易形成离子键的是________(填字母,下同),容易形成共价键的是________。
A.c和f B.b和g
C.d和g D.b和e
②写出由a~g 7种元素形成的,所有原子都满足最外层为8电子结构的任意一种分子的分子式:______________________。
(4)氯化铝的物理性质非常特殊性,如:氯化铝的熔点为190 ℃(2.02×103 Pa),但在180 ℃就开始升华。据此判断,氯化铝是____________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是_______________
_______________________。
选项
金属
存在形式
冶炼方法
A
金
游离态
金子比沙子密度大,利用水洗法直接分离
B
银
化合态
银的金属性弱,用加热Ag2O的方法冶炼
C
铁
化合态
铝的金属性比铁强,可用铝热法炼铁
D
钠
化合态
钠的金属性强,一般还原剂很难将其还原出来,所以用电解饱和NaCl溶液的方法冶炼
相关试卷
这是一份湖北省随州市部分高中联考协作体2025届高三上学期12月联考-化学试题+答案,共14页。
这是一份2024~2025学年湖北省随州市高中联考(月考)协作体高三(上)12月联考(月考)化学试卷(含答案),共10页。
这是一份2025随州部分高中联考协作体高二上学期12月联考化学试题含答案,文件包含湖北省随州市部分高中联考协作体2024-2025学年高二上学期12月联考化学试题docx、湖北省随州市部分高中联考协作体2024-2025学年高二上学期12月联考化学试题答案docx等2份试卷配套教学资源,其中试卷共15页, 欢迎下载使用。









