

江苏省无锡市江阴市六校大联考2024-2025学年高二上学期11月期中考试化学试卷(含答案)
展开
这是一份江苏省无锡市江阴市六校大联考2024-2025学年高二上学期11月期中考试化学试卷(含答案),共16页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
一、单选题
1.常用于微电子工业,可由反应制备。下列说法正确的是( )
A.中子数为36的铜原子为B.的电子式为
C.中含有离子键和共价键D.是非极性分子
2.一种钠硫电池以钠和硫为电极反应物,为正极材料,陶瓷为电解质隔膜。下列说法正确的是( )
A.电离能大小:B.半径大小:
C.电负性大小:D.酸性强弱:
3.我国科研团队对嫦娥五号月壤的研究发现,月壤中存在一种含“水”矿物下列化学用语或图示表达不正确的是( )
A.的电子式:
B.基态的价电子排布式:3d54s1
C.的球棍模型:
D.基态S原子的价层电子的轨道表示式:
4.第三周期,基态原子的第一电离能处于Al、P之间的元素有( )
A.1种B.2种C.3种D.4种
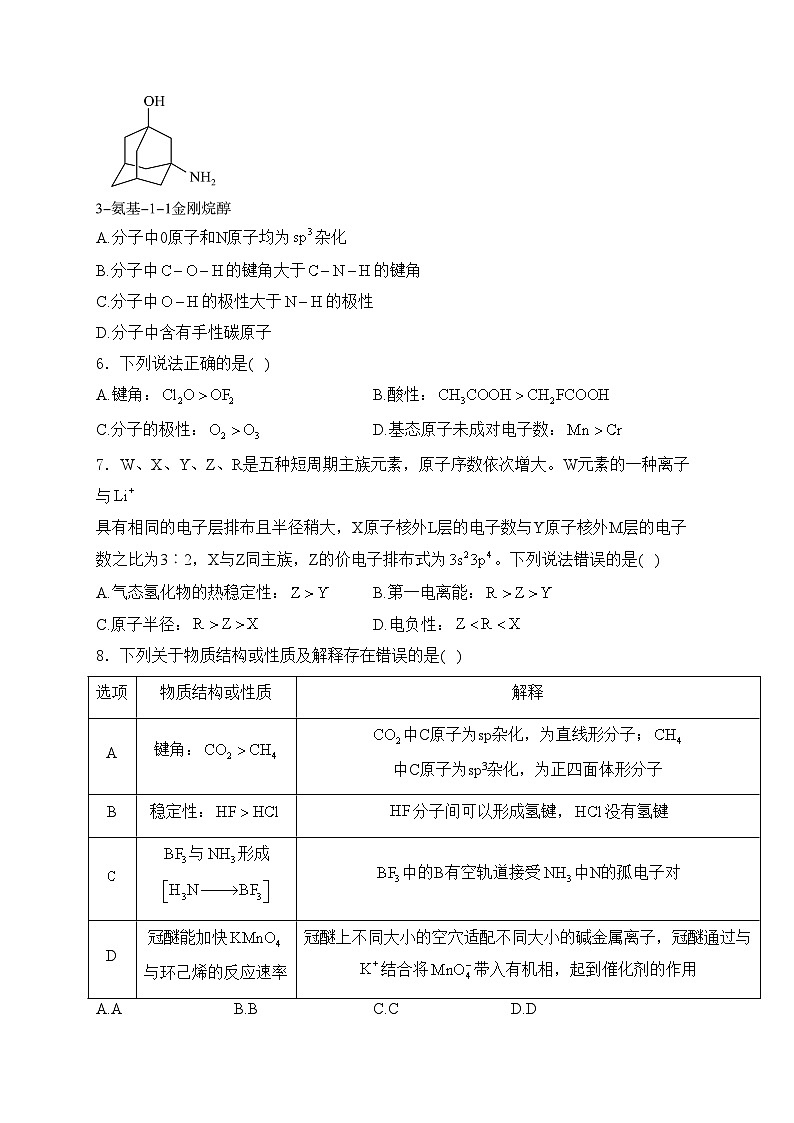
5.3-氨基-1-金刚烷醇可用于合成药物维格列汀(治疗2型糖尿病),其分子结构如图所示。下列说法不正确的是( )
A.分子中0原子和N原子均为杂化
B.分子中的键角大于的键角
C.分子中的极性大于的极性
D.分子中含有手性碳原子
6.下列说法正确的是( )
A.键角:B.酸性:
C.分子的极性:D.基态原子未成对电子数:
7.W、X、Y、Z、R是五种短周期主族元素,原子序数依次增大。W元素的一种离子与具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3︰2,X与Z同主族,Z的价电子排布式为。下列说法错误的是( )
A.气态氢化物的热稳定性:B.第一电离能:
C.原子半径:D.电负性:
8.下列关于物质结构或性质及解释存在错误的是( )
A.AB.BC.CD.D
9.芳樟醇结构如下图所示,在一定条件下发生消去反应生成芳樟烯。下列说法正确的是( )
A.芳樟醇存在顺反异构体
B.芳樟醇中含有1个手性碳原子
C.芳樟醇在水中溶解度小于芳樟烯
D.芳樟醇不能发生消去反应
10.下列说法正确的是( )
①Na核外电子存在6种空间运动状态
②在金属活动性顺序表中,金属镁比铝活泼,因此镁的第一电离能小于铝的第一电离能
③杂化轨道用于形成键或用来容纳孤电子对
④熔、沸点由高到低:氯化钠>金刚石>二氧化碳
⑤键角:
A.①③⑤B.②③⑤C.③④⑤D.①②④
11.硫及其化合物有着广泛的作用。硫元素具有多种化合价,在一定条件下能发生相互转化。不同温度下硫单质的状态和分子结构不同,环状分子的结构为。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关说法正确的是( )
A.的空间构型为正四面体B.是共价晶体
C.和中的键角相等D.的沸点高于
12.硅材料在生活中占有重要地位。(结构如图所示)受热分解可生成和。是一种优良的耐高温结构陶瓷。下列有关说法错误的是( )
A.电负性
B.属于分子晶体
C.基态Si和N原子的未成对电子数之比为2:3
D.中的Si、N原子轨道的杂化类型相同
13.下列有关晶体结构说法正确的是( )
A.在NaCl晶胞中,与最邻近且等距离的有6个
B.在干冰晶体中,每个晶胞拥有6个分子
C.晶胞中的配位数为4
D.该气态团簇分子的化学式为
14.下列关于化学式为的配合物的说法正确的是( )
A.配体是,配位数是4
B.配合物中C元素的化合价是+2价
C.配合物中的的H—N—H键角大于游离的键角
D.在1ml该配合物中加入足量溶液,可以得到3mlAgCl沉淀
15.氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在原子立方晶格的八面体空隙中,晶胞结构如图所示,其中相邻两个最近的N原子的距离为。设为阿伏加德罗常数的值,下列说法正确的是( )
A.氨化钼的化学式为
B.每个原子周围与其距离最近的N原子有12个
C.晶体的密度
D.若N换为P,则晶胞棱长将改变
二、填空题
16.碳、氮、氧、氯等元素形成的一系列化合物广泛应用于科研、医疗、工农业生产等领域。钴单质及其化合物在生产、生活中有广泛应用。回答下列问题:
(1)写出基态C原子核外电子排布的轨道表示式_______。
(2)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是_______(填编号)。
A.B.C.D.苯
(3)与光气反应可用于制取四氯化钛。中σ键和π键的数目比为_______,其空间构型为_______。
(4)基态C原子的价层电子排布式为_______。
(5)用甲醇作为溶剂,可以与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如上图所示),色胺酮分子中所含的四种元素(H、C、N、O)的电负性由大到小的顺序为_______(填元素符号),色胺酮分子中N原子的杂化类型有_______。
(6)乙二胺()能与、等金属离子形成稳定环状离子,其原因是_______。
17.根据短周期元素的性质回答下列问题。
I.有较强的配位能力,许多金属离子都可以与形成稳定的配合物。下面的反应用于制备。
(1)写出的结构式_______,1ml分子中键为_______ml。
(2)固态的晶体类型为_______。
Ⅱ.氟化镁()晶胞是长方体,其结构如图所示:
(3)晶胞示意图中“○”表示_______(填离子符号)。一个晶胞中有_______个。
(4)结合离子结构示意图,解释离子半径的原因_______。
18.根据物质的结构特点,回答以下问题。
I.磷酸亚铁锂()可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可用、、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是_______,该元素基态原子核外M层电子的自旋状态_______(填“相同”或“相反”)。
(2)中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,双聚分子中存在四元环结构。画出双聚分子的结构式_______。
(3)苯胺()的晶体类型是_______。苯胺与甲苯()的相对分子质量相近,但苯胺的沸点(184.4℃)高于甲苯的沸点(110.6℃),主要原因是_______。相同条件下,苯胺()在水中的溶解能力_______(填“大于”、“小于”或“等于”)甲苯()的在水中的溶解能力。
II.有机物的结构与性质息息相关,官能团决定了有机物的主要化学性质。
(4)具有α-H的醛或酮,在酸或碱的催化作用下,与另一分子醛或酮发生缩合,生成β-羟基醛或β-羟基酮。以乙醛为例,其过程可表示如下:
请从元素电负性的角度解释第一步加成反应发生的原理_______。
(5)已知醛基()能够和银氨溶液发生银镜反应,如乙醛()发生的银镜反应:。请根据甲醛(HCHO)的结构,推测并写出甲醛和银氨溶液发生的化学反应方程式:_______。
19.我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、P、Al、Ni、Fe等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______(填标号)。
A.
B.
C.
(2)镍能形成多种配合物,其中Ni(CO)4是无色挥发性液体,是红黄色单斜晶体。的熔点高于Ni(CO)4的原因是_______。
(3)的熔点(2054℃)很高,工业冶炼铝时要加入冰晶石(化学式为)来降低生产成本,如下图所示为冰晶石的晶胞。用“”和“”代表”或“”。图中“”位于大立方体顶点和面心,“”位于大立方体的12条棱的中点和8个小立方体的体心。则大立方体的体心处△代表的微粒是_______(填“”或“”);与距离相等且最近的有_______个。
参考答案
1.答案:C
解析:A.Cu是第29号元素,质子数为29,中子数为36的铜原子为,选项A不正确;
B.的电子式为,选项B不正确;
C.中铵根中N原子和H原子之间通过共价键结合,铵根离子和F-通过离子键结合,选项C正确;
D.的分子构型是三角锥形,有一对孤电子对,正电中心与负电中心不重合,是极性分子,选项D不正确;答案选C。
2.答案:A
解析:A.同一周期主族元素从左向右第一电离能呈增大的趋势,但第ⅡA族、第ⅤA族比相邻元素的大,第一电离能:,故A正确;
B.电子层数相同的,核电荷数越大的离子半径越小,则半径大小:,故B错误;
C.元素非金属性越强,其电负性越大,非金属性:O>Fe,电负性:,故C错误;
D.元素非金属性越强,其最高价氧化物对应的水化物的酸性越强,非金属性:,酸性:,故D错误;故选:A。
3.答案:B
解析:
A.是离子化合物,电子式为:,A正确;
B.Fe是26号元素,核外含有24个电子,基态的价电子排布式:3d6,B错误;
C.中心原子价层电子对数为2+=4,含有2个孤电子对,空间构型为V形,球棍模型为:,C正确;
D.基态S原子的价层电子排布式为3s23p4,基态S原子的价层电子的轨道表示式为:,D正确;故选B。
4.答案:C
解析:同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但同一周期中第ⅡA族元素比第ⅢA族元素的第一电离能大,第ⅤA族比第ⅥA族第一电离能大;Mg、Al、Si、P、S、Cl属于同一周期且其原子序数依次增大,但Mg属于第ⅡA元素,Al属于第ⅢA族,P属于第VA元素,S属于第ⅥA族,所Mg、Al、Si、P、S、Cl几种元素的第一电离能从大到小排序是P、S、Si、Mg、Al,所以第一电离能处于Al、P之间的元素有3种,C项正确;答案选C。
5.答案:B
解析:A.分子中O原子和N原子的价层电子对数均为4,故均为杂化,A正确;
B.N有一对孤对电子,O有两对孤对电子,孤对电子对成键电子排斥,键角变小,O的孤对电子多,排斥作用大,分子中的键角小于的键角,B不正确;
C.电负性,分子中的极性大于的极性,C正确;
D.手性碳原子一定是饱和碳原子,手性碳原子所连接的四个基团要是不同的。则分子中含有手性碳原子、例如,D正确;答案选B。
6.答案:A
解析:A.氧的电负性大于氯,中键合电子对偏向氧;氟电负性强于氧,中键合电子对偏向氟,两对键合电子对排斥小,键角就小键角,所以键角,故A正确;
B.F原子电负性大,吸电子能力强,所以极性,更能电离出氢离子,所以酸性:,故B错误;
C.是非极性分子,是极性分子,分子的极性:,故C错误;
D.基态原子Mn原子价电子排布式为3d84s2,未成对电子数为2;基态原子Cr原子价电子排布式为3d54s1,未成对电子数为6,基态原子未成对电子数,故D错误。答案选A。
7.答案:C
解析:A.元素非金属性越强,其气态氢化物越稳定,非金属性:,气态氢化物的热稳定性:,A正确;
B.同周期从左到右第一电离能呈增大趋势,因此第一电离能:,B正确;
C.根据层多径大,同电子层结构核多径小原则,则原子半径:,C错误;
D.根据同周期从左到右元素电负性逐渐增大,同主族元素从上到下电负性逐渐减小,因此电负性:,D正确;答案选C。
8.答案:B
解析:A.中C原子为sp杂化,为直线形分子,键角为180°,中C原子为sp3杂化,为正四面体形分子,键角为109°28’,因此键角:,A正确;
B.非金属性越强,气态氢化物越稳定,非金属性:,因此稳定性:,气态氢化物的稳定性与氢键无关,B错误;
C.中的B有空轨道,中N有孤电子对,因此中的B与中N可形成配位键,与形成,C正确;
D.冠醚上不同大小的空穴适配不同大小的碱金属离子,冠醚通过与K结合将带入有机相,起到催化剂的作用,因此冠醚能加快与环己烯的反应速率,D正确;故选B。
9.答案:B
解析:A.碳碳双键的碳原子上连接不同基团时,存在顺反异构,可知芳樟醇不存在顺反异构体,选项A错误;
B.连接4个不同基团的碳原子为手性碳原子,则芳樟醇中与羟基相连的碳原子为手性碳原子,选项B正确;
C.醇与水形成氢键,则芳樟醇在水中溶解度大于芳樟烯,选项C错误;
D.与羟基相连碳原子的邻位碳原子有2个,则芳樟醇能发生消去反应生成两种有机产物,选项D错误;答案选B。
10.答案:A
解析:①Na的电子排布式为1s22s22p63s1,ns轨道个数是1,np轨道个数是3,电子在6个轨道中运动,故有6种空间运动状态,①正确;
②Mg的价电子排布式为3s2,第一电离能失去的是3s上电子,Al的价电子排布式为3s23p1,第一电离能失去的是3p上电子,3p能级上的一个电子容易失去,第一电离能小,第一电离能镁大于铝,②错误;
③杂化轨道用于形成σ键或用来容纳孤电子对,未杂化的p轨道可以形成π键,③正确;
④金刚石是共价晶体,熔沸点高于离子晶体NaCl,分子晶体熔沸点低,熔沸点高到低的顺序为:金刚石>氯化钠>二氧化碳,④错误;
⑤水分子、氨分子的中心原子杂化方式相同,中O上有2个孤电子对,中N上有1个孤电子对,键角:,⑤正确;综上所述,正确的为①③⑤;故选A。
11.答案:A
解析:A.中硫原子形成4个共价键,空间构型为正四面体,A正确;
B.是由分子构成的分子晶体,B错误;
C.和中硫原子均为sp2杂化,但是二氧化硫中存在一对孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,故两者的键角不相等,C错误;
D.水分子间能形成氢键导致沸点升高,故的沸点低于,D错误;故选A。
12.答案:B
解析:A.C与N同周期,同周期从左到右电负性依次增大,则电负性:N>C;C与Si同主族,同主族从上到下电负性依次减小,则电负性:C>Si,所以电负性:N>Si,A不符合题意;
B.由是一种优良的耐高温结构陶瓷可知,Si3N4属于共价晶体,B符合题意;
C.基态Si原子的未成对电子数为2,基态N原子的未成对电子数为3,C不符合题意;
D.中的Si、N原子轨道的杂化类型均为sp3杂化,相同,D不符合题意;故选B。
13.答案:D
解析:A.根据NaCl晶胞可知,与最邻近且等距离的位于各棱心,共计12个,A错误;
B.根据干冰晶胞可知,位于顶点和面心,利用均摊法,每个晶胞拥有的个数:,B错误;
C.取任意面心为中心,与其距离最近且相等的由8个,配位数为8,C错误;
D.气态团簇分子不用于晶胞,气态团簇分子中含有4个E原子和4个F原子,则分子式,D正确;答案选D。
14.答案:C
解析:A.该配合物中配体是四个分子和两个,故配体数是6,A错误;
B.配合物中呈电中性,为负一价,则元素的化合价为+3价,B错误;
C.配合物中的上的孤对电子形成了配位键,氮原子上不存在孤电子对,所以配合物中的的H—N—H键角大于游离的键角,C正确;
D.加入足量溶液,外界离子离子与反应,内界配位离子不与反应,只能生成1mlAgCl沉淀,D错误;故选C。
15.答案:D
解析:A.氮化钼晶胞中含有4个原子和2个N原子,氮化钼的化学式为,故A错误;
B.由晶胞结构可知,N的配位数为6,则的配位数为3,每个原子周围与其距离最近的N原子有3个,故B错误;
C.该晶胞的质量为,晶胞的体积为,则晶胞的密度为,故C错误;
D.N与P半径不同,替换后晶胞棱长将改变,故D正确;故答案选D。
16.答案:(1)
(2)C
(3)3:1;平面三角形
(4)3d74s2
(5)O>N>C>H;sp3、sp2
(6)乙二胺的两个N原子提供孤对电子给金属离子形成配位键生成配离子,配离子空间呈较稳定的五元环状结构
解析:(1)C是6号元素,基态C原子核外电子排布的轨道表示式:;
(2)甲烷中碳原子是sp3杂化,乙烯中碳原子是sp2杂化,乙炔中碳原子是sp杂化,苯中碳原子是sp2杂化,故乙炔中C杂化轨道中s轨道成最多,C元素的电负性最强,连接在该C原子上的H原子最容易电离形成阴离子,综上所述C正确;故答案为:C;
(3)中单键都是σ键,C=O中一个σ键,一个π键,σ键和π键的数目分别为3个和1个,故为3:1;碳原子价层电子对数目为3+=3,C原子为sp2杂化,空间构型为平面三角形;故答案为:3:1;平面三角形;
(4)基态C原子的电子排布式为;价层电子排布式为3d74s2;故答案为3d74s2;
(5)同周期元素电负性随核电荷数增大而增大,H、C、N、O四种元素中,氢原子容易失去电子,故电负性最小,故电负性由大到小的顺序为O>N>C>H;色胺酮分子中有2个N原子,其中一个N价层电子对为3+,杂化方式为sp3,另一个N价层电子对为2+,杂化方式为sp2,故N原子的杂化类型有sp3、sp2;
(6)乙二胺中的两个N原子有孤电子对,提供孤对电子给金属离子形成配位键生成配离子,配离子空间呈较稳定的五元环状结构,因此乙二胺()能与、等金属离子形成稳定环状离子。
17.答案:(1)N≡C-C≡N;3
(2)分子晶体
(3);4
(4)核外电子数相同都是8个电子,镁的核电荷数是12,大于氟的核电荷数9,镁的原子核对核外电子的吸引力大,因此半径小
解析:(1)根据价键理论,C原子形成四个键满足8电子,N原子形成三个键满足8电子,的结构简式N≡C-C≡N;共价单键都是键,一个共价叁键中有一个是键,故1ml分子中键为3ml;
(2)常温下为气体,熔沸点比较低,属于分子晶体;
(3)根据均摊法,图中白球个数为1+8×,黑球个数为2+=4,根据氟化镁的化学式可知图中白球为;一个晶胞中F-离子的个数为:2+=4个;
(4)核外电子数相同都是8个电子,镁的核电荷数是12,大于氟的核电荷数9,镁的原子核对核外电子的吸引力大,离子半径小于离子。
18.答案:(1)Mg相反
(2)
(3)分子晶体苯胺分子之间存在氢键大于
(4)由于电负性C>H,α-H原子带部分正电荷,α-C带部分负电荷,电负性O>C,羰基中碳原子带部分正电荷,加成时碳氧双键打开,带部分正电荷的α-H原子和羰基中带部分负电荷的氧原子结合,带部分负电荷的α-C原子和羰基中带部分正电荷的碳原子结合
(5)
解析:(1)元素周期表对角线规则,处于对角位置的元素性质相似,Li与Mg元素在周期表中处于对角位置,二者性质相似;Mg的M层电子排布式为3s2,根据泡利原理,电子的自旋状态相反;
(2)双聚分子中存在四元环结构,则结构中存在配位键,双聚分子的结构式:;
(3)苯胺属于有机物,沸点较低,属于分子晶体;苯胺分子间存在氢键,甲苯分子间没有氢键,故苯胺的熔沸点高于甲苯;苯胺分子与水分子之间可以形成氢键,苯胺在水中溶解度大于甲苯在水中的溶解度;
(4)在中,醛基连接的碳原子上的H原子为α-H原子,由于电负性C>H,α-H原子带部分正电荷,α-C带部分负电荷,电负性O>C,羰基中碳原子带部分正电荷,加成时碳氧双键打开,带部分正电荷的α-H原子和羰基中带部分负电荷的氧原子结合,带部分负电荷的α-C原子和羰基中带部分正电荷的碳原子结合;
(5)甲醛中有醛基,1ml醛基可以与2ml、发生银镜反应,甲醛先与银氨溶液发生银镜反应得到甲酸盐,甲酸盐中仍有醛基,还能发生银镜反应,最终1ml甲醛与4ml发生银镜反应生成碳酸盐,反应的化学方程式为:。
19.答案:(1)A
(2)为离子晶体,熔化破坏离子键,离子键键能大,故熔沸点高,为分子晶体,熔化破坏分子间作用力,分子间作用力小,故熔沸点小
(3);8
解析:(1)A选项为s轨道全满的较稳定结构,故其失去一个电子需要吸收能量最多;B选项中为基态硼原子电子排布式,电子排布式为,C选项电子处于激发态,比A选项具有更高的能量,失去1个电子时,需要吸收能量较少,故选A;
(2)为离子晶体,为分子晶体,离子晶体熔化时破坏离子键,分子晶体熔化时破坏分子间作用力,离子键键能大,故熔沸点更高;
(3)由冰晶石化学式可知,和的个数比为3:1,由冰晶石的晶胞结构可知,一个晶胞中含有●的个数为,的个数为,△代表时,●与的个数比为1:3,则●为,为;以体心的钠离子为中心,其距离最近的8个钠离子分别位于8个小立方体的体心,因此与距离相等且最近的有8个。
选项
物质结构或性质
解释
A
键角:
中C原子为sp杂化,为直线形分子;中C原子为sp3杂化,为正四面体形分子
B
稳定性:
分子间可以形成氢键,没有氢键
与形成
中的B有空轨道接受中N的孤电子对
D
冠醚能加快与环己烯的反应速率
冠醚上不同大小的空穴适配不同大小的碱金属离子,冠醚通过与结合将带入有机相,起到催化剂的作用
相关试卷
这是一份江苏省无锡市澄宜六校2024-2025学年高三上学期12月联考化学试题(含答案),文件包含江苏省无锡市澄宜六校2024-2025学年高三上学期12月联考化学试题docx、江苏省无锡市澄宜六校2024-2025学年高三上学期12月联考化学试题答案及评分标准docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
这是一份2024-2025学年江苏省无锡市江阴市六校大联考高一(上)11月期中化学试卷(解析版),共17页。试卷主要包含了可能用到的相对原子质量, 下列有关说法正确的是,1ml/LMgCl2溶液中含有, 下列离子方程式正确的是等内容,欢迎下载使用。
这是一份江苏省无锡市江阴市六校2024~2025学年高二(上)期中联考试卷化学(含答案),共7页。









