

黑龙江省牡丹江市第一高级中学2024-2025学年高二上学期11月期中考试化学试卷(Word版附答案)
展开
这是一份黑龙江省牡丹江市第一高级中学2024-2025学年高二上学期11月期中考试化学试卷(Word版附答案),共9页。试卷主要包含了 下图为工业合成氨的流程图, 下列方程式正确的是, 下列有关说法中错误的是等内容,欢迎下载使用。
考试时间: 75 分钟 分值: 100分
命题人:辛爽 审题人:于艳丽
可能用到的相对原子质量 H1 O16 Na 23 K39 Cl35.5 Cr52 Cu 64 Ag 108
一、选择题(每道题只有一个正确选项,每题3分,共45分)
1. 化学与生产、生活、科技等密切相关。下列说法错误的是
A. 生活中常用明矾净水,可加速水中的悬浮物沉降
B. 加热蒸干 CuCl₂溶液得到 Cu(OH)₂固体
C. 处理锅炉水垢中的CaSO₄,可以先用饱和碳酸钠溶液浸泡,再用酸除去
D. 草木灰与 NH₄H₂PO₄混合施用,可更好为植物全面提供N、P、K三种营养元素
2. 下列事实能用勒夏特列原理解释的是
A. 加入催化剂有利于SO₂生成SO₃
B. 黄绿色的氯水光照后颜色变浅
C. 500℃比常温更有利于合成氨的反应
D. 由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
3. 下图为工业合成氨的流程图。下列说法正确的是
A. 步骤①中“净化”可以防止催化剂中毒
B. 步骤②中“加压”不能提高原料的转化率,但可以加快反应速率
C. 步骤③中反应温度越高催化剂活性越大
D. 步骤③、④均有利于提高原料的平衡转化率
4. 下列有关滴定操作的说法正确的是
A. 酸碱中和滴定实验时,滴定管和锥形瓶水洗后都需要用待装液润洗
B. 用标准KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有 NaOH杂质,则测定结果偏低
C. 可用量筒量取25.00mLNaOH 待测液置于锥形瓶中
D. 如果操作规范,通过一次实验就可以测得醋酸的准确浓度
5. 证明甲酸为弱酸,下列实验设计不合理的是
①将5 滴0.1ml/L的甲酸溶液滴入1mL 0.1ml/L 的1 Na₂CO₃溶液中,观察现象
②分别将 1LcH⁺相同的盐酸和甲酸溶液加水稀释至2L,比较二者稀释后的pH
③向甲酸溶液中加入少量甲酸钠固体,测定溶液的pH变化
④将足量 Zn分别加入到浓度和体积均相等的盐酸和甲酸溶液中,测定反应完成时 Zn质量变化量
A. ①② B. ②③ C. ①③ D. ①④
6. 科学家们发现水竟然有18种存在形态。下列有关水的说法正确的是
A. 温度升高,水的电离平衡正向移动, cH⁺增大,酸性增强
B. 当 cH2OH+=cH2OOH−时,溶液一定呈中性
C. 室温下,pH=4的亚硫酸溶液中, cH2OH+=2×10−10ml⋅L−1
D. 向水中加入 NaHSO₄晶体,溶解后水的电离程度减小
7. 常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 澄清透明溶液中: Na+、Cu2+、Cl−、SO42−
B. 滴加KSCN 显红色的溶液中: NH4+、Na+、Cl−、HCO3−
C. 常温下,由水电离出的 cH⁺=10⁻¹²ml/L的溶液: Na+、NO3−、SO42−、Fe2+
D. 中性溶液中: Fe3+、NH4+、SO42−、NO3−
8. 下列方程式正确的是
A.NH₄Cl溶于 D₂O中: NH4++D2O⇌NH3⋅D2O+H+
B. 利用 TiCl₄制备TiO2: TiCl4+(x+2)H2O TiO2⋅xH2O↓+4HCl
C. 用惰性电极电解氯化镁溶液: 2Cl-+2H2O 2OH-+H2↑+Cl2↑
D. 明矾净水的反应原理: Al³⁺+3H₂O⇌Al(OH)₃↓+3H⁺
9. 下列有关说法中错误的是
A. 某温度时的混合溶液中 Kw=c2H+,说明该溶液呈中性
B. 室温下向10mLpH=3的醋酸溶液中加入水稀释后,溶液中 cCH3COO−cCH3COOH⋅cOH−不变
C. 已知电离常数: KaHCN=5×10−10,H2CO3:Ka1=10−6.4、Ka2=10−10.4
向 KSCN 溶液中通入少量的 CO₂气体: CO2+H2O+2CN−=2HCN+CO32−
D.已知 KₛₚAgCl=1.56×10⁻¹⁰,KₛₚAg₂CrO₄=9.0×10⁻¹²,向含有 Cl−、CrO42−且浓度均为0.010ml/L溶液中逐滴加入0.010ml/L的 AgNO₃溶液时,Cl⁻先产生沉淀
10. 工业上用甲烷催化法可以制取乙烯,发生反应为 2CH₄g⇌C₂H₄g+2H₂g△H>0。T°C,向体积为2L 的密闭容器中充入 1mlCH₄,测得反应过程中部分物质的物质的量随时间的变化如图所示。下列说法正确的是
A. 0~20min内, vH₂=0.04ml/L⋅min
B. 反应在14min时达到平衡
C. 该反应的化学平衡常数. K=6.4
D. 该反应可以在高温下自发进行
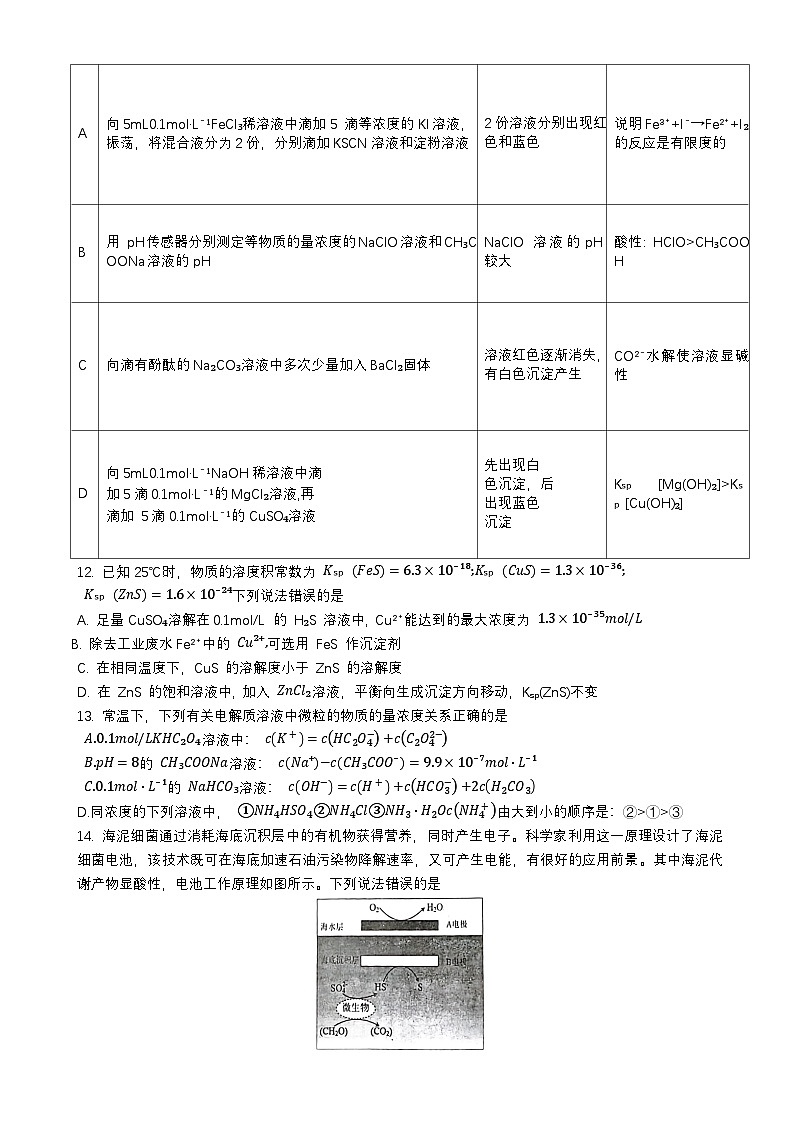
11. 下列实验操作得到的现象和结论均正确的是
12. 已知25℃时,物质的溶度积常数为 KₛₚFeS=6.3×10⁻¹⁸;KₛₚCuS=1.3×10⁻³⁶;
KₛₚZnS=1.6×10⁻²⁴下列说法错误的是
A. 足量CuSO₄溶解在0.1ml/L 的 H₂S 溶液中, Cu²⁺能达到的最大浓度为 1.3×10⁻³⁵ml/L
B. 除去工业废水Fe²⁺中的 Cu²⁺,可选用 FeS 作沉淀剂
C. 在相同温度下,CuS 的溶解度小于 ZnS 的溶解度
D. 在 ZnS 的饱和溶液中, 加入 ZnCl₂溶液,平衡向生成沉淀方向移动,Ksp(ZnS)不变
13. 常温下,下列有关电解质溶液中微粒的物质的量浓度关系正确的是
₂O₄溶液中: cK+=cHC2O4−+cC2O42−
B.pH=8的 CH₃COONa溶液: cNa⁺−cCH₃COO⁻=9.9×10⁻⁷ml⋅L⁻¹
⋅L⁻¹的 NaHCO₃溶液: cOH−=cH++cHCO3−+2cH2CO3
D.同浓度的下列溶液中, ①NH4HSO4②NH4Cl③NH3⋅H2OcNH4+由大到小的顺序是:②>①>③
14. 海泥细菌通过消耗海底沉积层中的有机物获得营养,同时产生电子。科学家利用这一原理设计了海泥细菌电池,该技术既可在海底加速石油污染物降解速率,又可产生电能,有很好的应用前景。其中海泥代谢产物显酸性,电池工作原理如图所示。下列说法错误的是
A. A电极的电势高于 B电极
B. 1ml质子通过海底沉积层和海水层交接面,A 电极消耗氧气5.6L(标准状况)
C. 负极的电极反应式为: CH₂O−4e⁻+H₂O=CO₂+4H⁺
D. 海水和海泥作为电解质的一部分,富含盐分,导电性高,有利于输出电能
15. 电位滴定法是根据滴定过程中被测离子浓度发生突跃,指示电极电位也产生突跃,从而确定滴定终点的一种滴定分析方法。常温下,利用盐酸滴定一定物质的量浓度的碳酸钠溶液,其电位滴定曲线与 pH曲线如图所示(已知:碳酸的电离常数 Kₐ₁=10⁻⁶⁴、Kₐ₂=10⁻¹⁰⁴)。下列说法错误的是
A. 该实验中,需先后用酚酞和甲基橙作指示剂
B. a点: cNa+>cCl−>cHCO3−+cCO32−
C. 水的电离程度:a点>b点
D. b点: cCO32−cH2CO3比值为 10⁻⁸
二、填空题(共55分)
16.(14分)甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与 H₂的混合气体) 转化成甲醇,反应为( COg+2H₂g⇌CH₃OHg。
(1)CO的平衡转化率与温度、压强的关系如图所示。
①p₁、p₂的大小关系是 P1¯p2 (填“>”“CH₃COOH
C
向滴有酚酞的Na₂CO₃溶液中多次少量加入BaCl₂固体
溶液红色逐渐消失,有白色沉淀产生
CO²⁻水解使溶液显碱性
D
向5mL0.1ml·L⁻¹NaOH稀溶液中滴
加5滴0.1ml·L⁻¹的MgCl₂溶液,再
滴加 5滴0.1ml·L⁻¹的CuSO₄溶液
先出现白
色沉淀,后
出现蓝色
沉淀
Kₛₚ [Mg(OH)₂]>Kₛₚ[Cu(OH)₂]
(2)在 T₂°C、p₂压强时,往一容积为2L的密闭容器内,充入0.3ml CO与( 0.4mlH₂发生反应。
①平衡时 H₂的体积分数是 ;平衡后再加入1.0mlCO后重新到达平衡,则CO的转化率 (填“增大”“不变”或“减小”)。
②若以不同比例投料,测得某时刻各物质的物质的量如下,( CO:0.1ml、H₂:0.2ml、CH₃OH;0.2ml, 此时 v(正) v(逆)(填“>”“”、 “KₛₚCuOH₂(不考虑二价铁的氧化)。下列说法正确的是 。
化学式
HNO₂
H₂N₂O₂
电离常数
Kₐ=5.1×10⁻⁴
Ka₁=6.17×10⁻⁸、Ka₂=2.88×10⁻¹²
a. 曲线②表示滴定 FeSO₄溶液的pM变化关系
b. HX的电离常数 Ka=1.0×10−6.5
c. a点对应的 pH=8
d.CuOH₂不易溶于 HX 溶液中,而 FeOH₂易溶于 HX 溶液中
18(14分).某化学兴趣小组同学用如图所示装置研究有关电化学的问题,甲池、乙池、丙池中电解质溶液均足量。当闭合该装置的开关时,观察到电流表的指针发生了偏转。
请回答下列问题:
(1) 甲池为 (填“原电池”或“电解池”),通甲醇一极的电极反应为 。
(2) 乙池中A (石墨) 电极为 (填“正极”、“负极”、“阴极”或“阳极”),乙池的总反应的离子方程式为 。
(3)乙池中 B极质量增加10.8g时,甲池中理论上消耗( O₂的体积为 L(标准状况),丙池中 (填“C”或“D”) 极析出 g铜。
19. (13分) 无水 CrCl₃可用于制铬酸盐、催化剂等。实验室制备无水 CrCl₃的反应原理为:
Cr2O3+3CCl4 2CrCl3+3COCl2 。相关实验装置如图(夹持装置略)。
实验的主要步骤为:
I. 加热并维持A 的温度在 60~65℃;
Ⅱ. 打开K,通入 N₂并保证锥形瓶中每分钟有250个左右的气泡逸出;
Ⅲ. 点燃B 处酒精喷灯,使瓷舟温度升至 720°C左右,恒温反应2h;
Ⅳ. 先后停止加热A、B;
V. 冷却,并继续通入一段时间的 N₂.
已知:①CCl₄的沸点是76.8℃。②COCl₂(俗称光气)有剧毒,遇水发生反应:( COCl₂+H₂O=CO₂+2HCl。回答下列问题:
(1)装置A 的锥形瓶中盛放的物质是 (填化学式);
(2)装置A 采用水浴加热,该加热方式的优点为 。
(3)仪器C的名称为 。
(4)步骤 V 中“继续通入一段时间 N₂”的主要目的是 。
(5)D中发生反应的化学方程式为 。
6CrCl₃纯度的测定:称取 ag瓷舟中制得的样品,配制成100mL 溶液,移取20.00mL溶液于锥形瓶中,加入 Na₂O₂,充分反应,然后加入过量的稀 H₂SO₄至溶液呈强酸性,此时铬以( Cr2O72−存在,充分加热煮沸后,冷却至室温,加入KI溶液,塞紧塞子,摇匀,静置,加入2滴淀粉溶液,用碱式滴定管盛装 cml⋅L⁻¹硫代硫酸钠( Na₂S₂O₃标准溶液,滴定至终点。重复滴定多次,平均消耗标准溶液体积为 VmL。
已知: Cr2O72−+6I−+14H+=3I2+2Cr3++7H2O;I2+2S2O32−=S4O62−+2I−。
①充分加热煮沸的目的是 ,
②判断滴定终点的依据是 。
③样品中 CrCl₃的纯度为 (用含a、V和c的计算式表示)。
相关试卷
这是一份河南省信阳高级中学北湖校区2024-2025学年高二上学期期中考试化学试卷(Word版附答案),共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份黑龙江省牡丹江市第一高级中学2024-2025学年高一上学期11月期中考试化学试卷(Word版附答案),共4页。试卷主要包含了5 Ca等内容,欢迎下载使用。
这是一份黑龙江省牡丹江市省级示范高中2024-2025学年高三上学期期中考试化学试卷(Word版附答案),共12页。试卷主要包含了文物见证历史,化学创造文明,下列有关化学用语表述正确的是,有关化学实验的说法错误的是,劳动创造幸福未来,下列反应的离子方程式正确的是,下列说法正确的是等内容,欢迎下载使用。









