

广东省部分学校2024-2025学年高二上学期期中联考 化学试题
展开
这是一份广东省部分学校2024-2025学年高二上学期期中联考 化学试题,共16页。试卷主要包含了选择题的作答,非选择题的作答,化学之美无处不在,已知,室温下,向20,设为阿伏加德罗常数的值等内容,欢迎下载使用。
注意事项:
1.答题前,先将自己的姓名、准考证号填写在答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接写在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H 1 N 14 O 16
一、选择题:本题共16小题,共44分。第小题,每小题2分;第小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.绘画艺术在文化传承中具有举足轻重的作用。下列中国古名画中,不是绘在有机高分子材料上的是
2.中国科技发展日新月异,中国产品随中国运动健儿一起征战巴黎奥运会。下列说法正确的是
A.奥运硅胶手环:原子核内有28个质子
B.运动垫上涂有纳米抗菌涂层:该涂层属于胶体,能发生丁达尔效应
C.LED显示屏用铝合金封装:和纯铝相比,铝合金熔点更高,密度更大
D.乒乓球使用ABS树脂作为塑料原料:ABS树脂是一种强度高、韧性好、易加工成型的塑料
3.“光荣属于劳动者,幸福属于劳动者”。下列劳动过程中没有运用相应化学原理的是
4.中和反应反应热测定的实验装置如图所示。下列说法正确的是
A.每次必须在温度计示数稳定后再读数
B.向内筒倒入盐酸和NaOH溶液时应缓慢注入
C.内筒、外壳、杯盖、隔热层和玻璃搅拌器等设计均有利于减少体系向环境释放热量
D.重复三次实验,若温度差分别为,放出的热量应以平均值计算
5.化学之美无处不在。下列说法不正确的是
A.铁桥刷油漆既美观又能防腐
B.苯分子结构呈现为美丽的单双键交替六边形结构
C.向溶液中交替加入浓NaOH溶液和浓硫酸,溶液呈现美妙的变化:加碱变黄,加酸变橙
D.生产洁美无暇的玻璃时发生反应,该反应为高温下的自发进行的熵增反应
6.含氰废水中氰化物的主要形态是HCN和。氰化物浓度较低时,可在碱性条件下用将其转化为;浓度较高时,用溶液与HCN反应生成、和。已知酸性:,下列反应方程式书写不正确的是
A.碱性条件下与反应:
B.向NaCN溶液中通入少量
C.溶液与足量HCN溶液反应:
D.Fe、少量溶液与HCN溶液反应:
7.已知:①、(aq)。下列说法正确的是
A.
B.已知常温下,若适当升温,则大于
C.加适量水稀释溶液,则增大
D.断开和(g)中化学键吸收的能量比形成中化学键放出的能量高
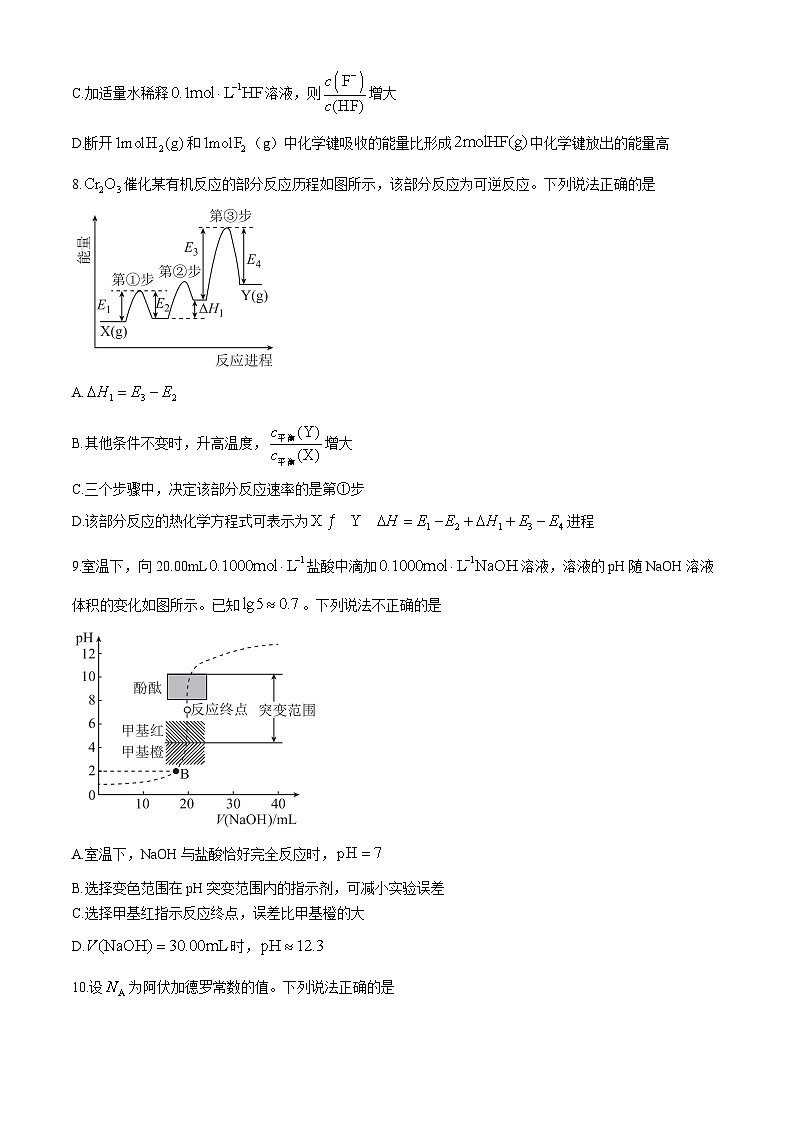
8.催化某有机反应的部分反应历程如图所示,该部分反应为可逆反应。下列说法正确的是
A.
B.其他条件不变时,升高温度,增大
C.三个步骤中,决定该部分反应速率的是第①步
D.该部分反应的热化学方程式可表示为进程
9.室温下,向20.00mL盐酸中滴加溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知。下列说法不正确的是
A.室温下,NaOH与盐酸恰好完全反应时,
B.选择变色范围在pH突变范围内的指示剂,可减小实验误差
C.选择甲基红指示反应终点,误差比甲基橙的大
D.时,
10.设为阿伏加德罗常数的值。下列说法正确的是
A.分子反应中,若10s内,则10s时生成的分子数为
B.和反应生成标准状况下,转移的电子数为
C.的稀盐酸中含HCl的分子数为
D.常温下,充入密闭容器中,容器内的分子数为
11.下列陈述I和陈述II均正确且具有因果关系的是
12.已知,常温下,。下列说法不正确的是
A.常温下,溶液的
B.常温下,反应的平衡常数
C.若适当升温溶液,则均增大
D.溶液中:
13.恒温密闭容器中发生反应,平衡时测得,压缩容器体积至原体积的一半,达到新平衡时,测得。下列说法正确的是
A.时,该反应达到平衡状态
B.时,该反应达到平衡状态
C.新平衡时,N的转化率增大D.
14.如图所示为某同学探究金属与浓硝酸反应设计的原电池实验装置,该实验在常温下进行,实验时先放入铁片,直到无气泡后再放入铜片并连接好装置。下列说法不正确的是
A.铜电极上发生氧化反应B.铁比铜活泼,铁作负极
C.溶液中阴离子移向铜片,阳离子移向铁片
D.铁片附近产生红棕色气体,电极反应式为
15.短周期元素甲庚在元素周期表中的相对位置如图所示,丙与己的原子序数相差4。下列说法正确的是
A.原子半径:庚>戊>己B.氧化物对应水化物的酸性:戊>己
C.甲与庚形成的化合物一定比甲与戊形成的化合物稳定
D.乙、丙、丁三种元素最高价氧化物对应水化物碱性最强的是丙
16.向1L恒容密闭容器中通入,容器内发生的反应有;②。不同温度下,平衡时分解产物的物质的量如图所示,下列说法不正确的是
A.曲线a代表B.
C.400K时,主要由反应②生成D.M点的分解率为
二、非选择题:本题共4小题,共56分。
17.(14分)是绿色氧化剂和还原剂,在化学研究中应用广泛。某学习小组配制溶液并进行相关实验探究。
回答下列问题:
(1)配制的溶液:
①纯的密度为,需用量筒量取___________mL纯。
②配制过程中下列不需要用到的仪器有___________(填选项字母)。
(2)现使用蒸馏水、溶液和溶液等试剂探究影响分解速率的因素:
①测定分解速率的装置如图所示,若所测得的数据能直接体现反应速率大小,可测定(其中一种):i.相同时间产生的体积;ii.___________。
②将锥形瓶置于水中恒温水浴,加入,用①中方案i进行实验,设计实验表格如表所示:
a.写出分解的化学方程式:___________。
b.实验I和II的目的是探究反应物浓度对反应速率的影响,___________,若,结论是___________。
c.已知是分解的催化剂,___________(填“>”、“<”或“=”)。
d.实验I和IV的目的是探究___________对化学反应速率的影响,若,结论是___________。
(3)写出在生产生活中的一种用途:___________(不能填氧化剂、还原剂)。
18.(14分)铬钒矿渣含等元素的氧化物,还有少量,从铬钒矿渣中回收V和Cr可实现废物利用,一种回收工艺流程如图所示:
已知:“萃取”的目的是分离和。
回答下列问题:
(1)“浸取”后所得滤液在“沉硅”时,加入调节pH约为9,所得“滤渣”中仅有一种主要成分,其化学式为___________。
(2)“酸浸”时铁化合价无变化,钒由转化为,写出该反应的离子方程式:____________________________________________。
(3)向“滤液1”中加入足量铁充分反应后,溶液中的阳离子有___________和少量。
(4)“萃取”时发生吸热反应,加热能提高钒的产率和生产效率,原因是_________________________________。
(5)“操作a”需加入___________(填“氧化剂”或“还原剂”)。
(6)常温下,“滤液2”中存在多个平衡,本题仅考虑如下平衡:
反应I:
反应II:
①仅升高温度,___________(填“变大”、“变小”或“不变”,下同),___________。
②利用平衡常数推算,仅加水稀释,“滤液2”中离子总数__________(填“增大”、“减小”或“不变”)。
③常温下,配制的溶液,时,设、的平衡浓度分别为,则x、y、z之间的关系式为___________。
19.(14分)工业合成氨提高了粮食产量,促进了化工发展,是人类科学技术的一项重大突破。回答下列问题:
(1)已知断裂1ml共价键吸收的能量如表所示:
①反应I:___________。
②合成氨工业中采用循环操作,主要目的是___________(填选项字母)。
A.增大化学反应速率B.提高和的利用率
C.提高平衡混合物中氨的含量D.降低氨的沸点,促进平衡正向移动
(2)工业合成氨时合成塔内发生反应I的示意图如图所示:
①原料气(及少量的混合气体)进入合成塔前需经过铜氨溶液处理,目的是除去其中的CO,防止___________,除去CO的方程式为,吸收CO后的铜氨溶液经过适当处理可再生,恢复其吸收CO的能力,铜氨溶液再生的适宜生产条件是___________。
②合成塔有热交换器,其作用是加热___________(填“a”、“b”、“c”或“d”中的一项,下同)处气体,冷却___________处气体。
(3)实际工业合成氨过程中采取了以下条件,试分析其原因:
①压强为:________________________________________________________________。
②使用了铁触媒作催化剂,并控制温度为:______________________________________。
(4)向体积为2.5L的恒温恒容密闭容器中充入和后反应I达到平衡状态,混合气体中的体积分数为,计算3min内的平均反应速率___________(写出完整计算过程)。
20.(14分)乙烯是重要的化工原料,可合成多种物质,由乙烯生产乙二酸乙二酯的合成路线如图所示:
回答下列问题:
(1)衡量一个国家石油化工发展水平的标志是___________。
(2)化合物II的反应类型是___________;写出化合物II同分异构体的结构简式:___________。
(3)化合物III的官能团名称是___________。
(4)化合物是酯化反应,将化合物III中的O用标记,充分反应并除去催化剂后,检测发现剩余液体中有化合物III、IV、V和,其中化合物III和V有,其它物质没有。
①反应时化合物III分子中断裂的化学键是___________(填选项字母)。
A.B.C.D.
②写出该反应的化学方程式:_________________________________(经标记的O用表示)。
③查阅资料可知该反应生成1ml化合物V吸收的热量,向量热计中加入化合物III和IV各1ml,在催化剂作用下充分反应,吸收的热量小于,原因是_______________________________。
(5)乙酸和化合物IV都是弱酸,乙酸在水溶液中部分电离:。
①乙酸___________(填“是”或“不是”)化合物IV的同系物。
②常温下探究外界条件对平衡的影响,设计如下实验:
实验仪器和药品:烧杯、玻璃棒、量筒、浓度传感器(含配套设备)、、蒸馏水。
表格中___________,___________填“>”、“<”或“=”)。
2024-2025学年度高二年级11月联考
化学参考答案及解析
—、选择题
1.A 【解析】青花瓷是硅酸盐材质,不是有机高分子材料,A项符合题意;锦画的材质是丝绸,蛋白质是有机高分子材料,B项不符合题意;宣纸的主要成分是纤维素,是有机高分子材料,C项不符合题意;折扇的材质是纸和竹,同样是纤维素,是有机高分子材料,D项不符合题意。
2.D 【解析】原子核内质子数与中子数之和为28,A项错误;胶体是分散系,该涂层不是胶体,也不能发生丁达尔效应,B项错误;和纯金属相比,合金一般熔点低,密度小,C项错误;要生产乒乓球,需强度高、韧性好、易加工成型的塑料,D项正确。
3.D 【解析】天然气燃烧放热,可用于生火做饭,A项不符合题意;NaClO溶液具有强氧化性,可用于杀菌消毒,B项不符合题意;冰柜冷藏是利用低温下腐蚀速率慢来保存食品的,C项不符合题意;葡萄糖与新制共热会产生砖红色沉淀,是醛基的特征反应,与淀粉水解得到葡萄糖无关,D项符合题意。
4.C 【解析】测量反应前盐酸和NaOH溶液的温度时应在温度计示数稳定后再读数,但测量反应后温度时应读最高温度,A项错误;为了减少热量散失,需迅速注入盐酸和NaOH溶液,B项错误;内筒、外壳、杯盖、隔热层和玻璃搅拌棒的设计均是为了减少体系向环境释放热量,C项正确;为明显偏差,应舍弃不要,只取和的平均值计算,D项错误。
5.B 【解析】铁桥刷油漆能减小与空气的接触面,达到减慢腐蚀的目的,A项正确;苯分子6个碳原子之间的键完全相同,不存在单双键交替,B项错误;反应加碱平衡正向移动,加酸平衡逆向移动,为橙色,为黄色,C项正确;反应生成气体,为吸热熵增反应,高温下自发,D项正确。
6.A 【解析】已知能与反应,故碱性条件下与反应的离子方程式为,A项错误;由题干信息可知,酸性:,则向NaCN溶液中通入少量的离子方程式为,B项正确;由题干信息可知,酸性:,则溶液与足量HCN溶液反应的离子方程式为,C项正确;根据题干信息并结合氧化还原反应配平可得,Fe、少量溶液与HCN溶液反应的化学方程式为,D项正确。
7.C 【解析】因,故(1),A项错误;因,故适当升温,小于,B项错误;溶液中存在电离平衡,加水稀释,电离平衡正向移动,减小,增大,C项正确;反应物的总键能—生成物的总键能,即断开和中化学键吸收的能量比形成中化学键放出的能量低270kJ,D项错误。
8.B 【解析】是第①步反应的,是第③步反应的,与没有任何关联,A项错误;由图可知为吸热反应,升高温度平衡正向移动,增大,B项正确;第③步反应能垒最大,决速步骤是第③步,C项错误;热化学方程式需标明物质聚集状态,D项错误。
9.C 【解析】NaOH溶液与盐酸恰好完全反应时溶液中的溶质为NaCl,溶液呈中性,室温下,A项正确;为了减小实验误差,应选择变色范围在pH突变范围内的指示剂,B项正确;甲基橙的变色范围在pH突变范围外,误差更大,C项错误;时,溶液中的溶质为氯化钠和氢氧化钠,且,即溶液中,则12.3,D项正确。
10.A 【解析】由可知10s时生成1mlN分子,故生成3mlP分子,A项正确;标准状况下水不是气态,B项错误;HCl是强电解质,稀盐酸中HCl已完全电离,无HCl分子,C项错误;在容器中存在反应,部分转化为,D项错误。
11.D 【解析】水和冰之间的转化是物理变化,陈述II错误,A项不符合题意;Na常温下与反应表面变暗生成,加热时燃烧生成,B项不符合题意;升高温度,正逆反应速率均加快,C项不符合题意;因为反应有一定限度,高炉炼铁时炉高增加到一定程度,尾气中CO含量不再降低,D项符合题意。
12.A 【解析】溶液的pH,A项错误;反应的平衡常数10,B项正确;溶液中存在电离平衡,适当升温,电离平衡正向移动,增大,也增大,C项正确;在溶液中,根据电荷守恒可知,D项正确。
13.C 【解析】时,各物质浓度之比等于系数比时,反应不一定达到平衡状态,A项错误;时,该反应才达到平衡状态,B项错误;压缩容器体积为原体积的一半平衡未移动时,,达到新平衡时,测得,说明增大压强平衡正向移动,N的转化率增大,,C项正确,D项错误。
14.B 【解析】常温下,先放入铁片后铁片钝化,连接好装置后,总反应为Cu与浓硝酸的反应,铜为负极发生氧化反应,A项正确;钝化的铁片作正极,B项错误;阴离子移向负极,阳离子移向正极,C项正确;铁片为正极,在作用下被还原为红棕色气体,电极反应式为,D项正确。
15.D 【解析】短周期元素即前三周期元素,故甲是H,丙是Na,己原子序数比Na大4,己是P,根据元素周期表相对位置可推断乙是Li、丁是Mg、戊是N、庚是O。己的电子层数比戊和庚多,原子半径最大,戊的核电荷数小,原子半径大于庚,A项错误;非金属性的强弱只能用来判断最高价氧化物对应水化物的酸性强弱,B项错误;通过非金属性的强弱只能判断出最简单氢化物比稳定,但不稳定,C项错误;Li、三种元素中,Na的金属性最强,最高价氧化物对应水化物的碱性最强,D项正确。
16.C 【解析】完全分解最多得到3ml,曲线a部分数值大于3ml,故曲线a代表,曲线b代表,A项正确;随着温度的升高,明显减少,增加很小,根据N元素守恒可知反应②逆向移动,即,B项正确;P点时,反应①生成,反应②生成,C项错误;M点,1.6ml,根据三段式或元素质量守恒可计算平衡时反应②中分解了1.2ml,反应①中分解了1.2ml,共2.4ml,故的分解率为,D项正确。
二、非选择题
17.(14分)(1)①17.0(2分)
②B(2分)
(2)①产生相同体积所需的时间(1分,答案合理即可)
②(1分)
b.7.0(1分)其他条件相同时,增大反应物浓度,化学反应速率加快(2分)
c.
相关试卷
这是一份广东省部分学校2024-2025学年高一上学期期中联考 化学试题,共8页。试卷主要包含了本试卷主要考试内容,可能用到的相对原子质量,下列说法错误的是等内容,欢迎下载使用。
这是一份广东省部分学校2024-2025学年高一上学期11月期中联考 化学试题,共11页。试卷主要包含了选择题的作答,非选择题的作答等内容,欢迎下载使用。
这是一份江西省部分学校2024-2025学年高二上学期10月联考化学试题,共5页。









