
山东省枣庄市2023_2024学年高二化学上学期10月月考试题含解析
展开
这是一份山东省枣庄市2023_2024学年高二化学上学期10月月考试题含解析,共32页。试卷主要包含了单选题,不定项选择题,原理综合题等内容,欢迎下载使用。
1. 下列有关金属腐蚀与防护的说法正确的是
A. 铁锅中残留的水滴内部比边缘更容易生锈
B. 海船只的船底镶嵌锌块,利用了牺牲阳极保护法保护金属船体
C. 航纯银器长时间暴露在空气中变黑,是因为发生了吸氧腐蚀
D. 保暖贴发热过程中主要发生了化学腐蚀
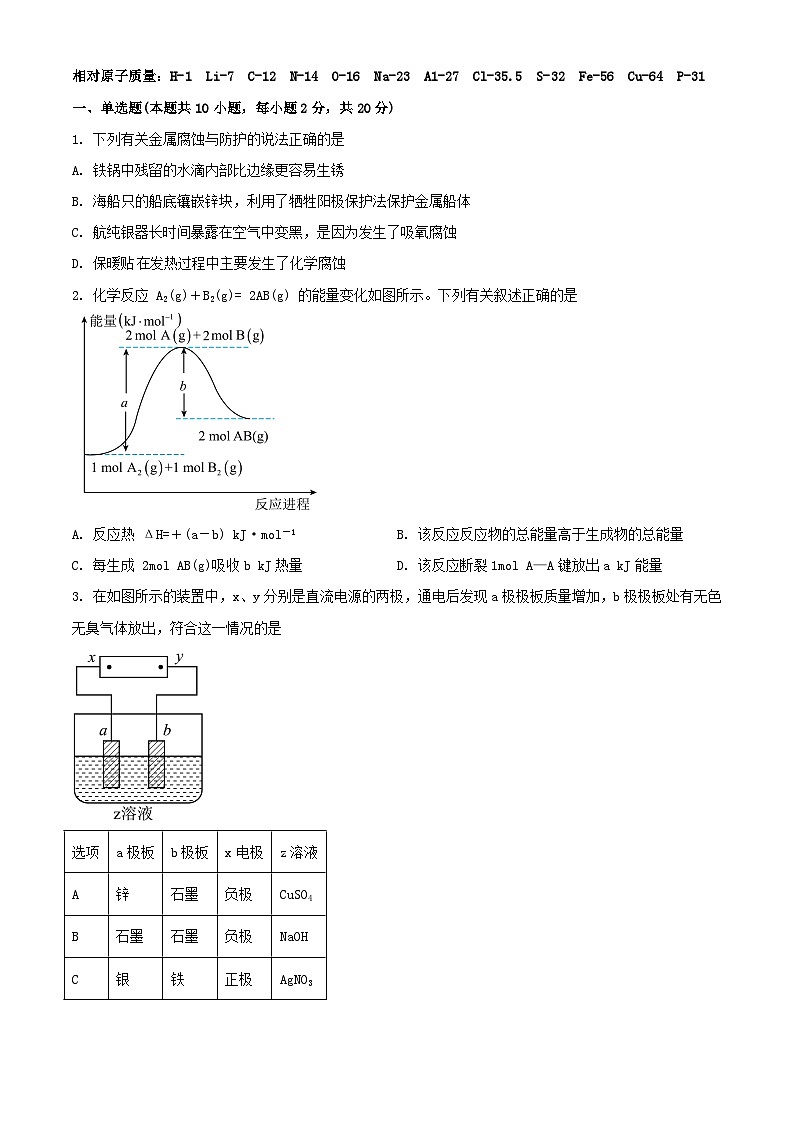
2. 化学反应 A2(g)+B2(g)= 2AB(g) 的能量变化如图所示。下列有关叙述正确的是
A. 反应热 ΔH=+(a-b) kJ·ml-1B. 该反应反应物的总能量高于生成物的总能量
C. 每生成 2ml AB(g)吸收b kJ热量D. 该反应断裂1ml A—A键放出a kJ能量
3. 在如图所示的装置中,x、y分别是直流电源的两极,通电后发现a极极板质量增加,b极极板处有无色无臭气体放出,符合这一情况的是
A. AB. BC. CD. D
4. 下列各装置能达到相应实验目的的是
A. 图甲,中和热的测定B. 图乙,该装置可持续供电
C. 图丙,在铁制品表面镀锌D. 图丁,测定稀硫酸的pH
5. 观察下列几个装置示意图,有关叙述正确的是
A. 装置①中阳极上析出红色固体
B. 装置②中铜片应与电源负极相连
C. 装置③中外电路电流方向:b极 →a极
D. 装置④中阴极反应:2 Cl--2e-= Cl2
6. 以下反应可表示获得乙醇并用作汽车燃料过程,下列有关说法正确
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
A. 2ΔH3= -ΔH1-2ΔH2
B. 植物的光合作用通过反应①将热能转化为化学能
C. 在不同油耗汽车中发生反应③,ΔH3不会不同
D. 若反应①生成1.12 L O2,则转移的电子数为0.2×6.02×1023
7. 微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如下图所示,下列说法正确的是
A. 电子从b流出,经外电路流向a
B. HS—在硫氧化菌作用下转化为SO的反应是:HS—+4H2O—8e—=SO+9H+
C. 该电池在高温下进行效率更高
D. 若该电池有0.4ml电子转移,则有0.45mlH+通过质子交换膜
8. 锂二氧化碳电池可在常温下同时实现二氧化碳的锚定与转化,可以在深海作业、火星探测等高二氧化碳的环境中得到应用,电池总反应为:。下列说法错误的是
A. 该电池不能用水溶液作为电解液
B. 放电时,正极电极反应为:
C. 充电时,锂电极与外接电源负极相连
D. 充电时,当生成(标准状况下),通过隔膜迁移的数目为
9. 钴(C)的合金材料广泛应用于航空航天、机械制造等领域。下图为电解方法制备金属钴的装置示意图。下列说法正确的是
A. C电极与电源的正极相连
B. 电解过程中,Ⅱ室溶液的pH增大
C. 移除阳离子交换膜后,石墨电极上发生的反应不变
D. 外电路每通过1ml电子,Ⅲ室溶液质量理论上减少65g
10. 汽车尾气(含烃类、CO、NO与SO2等),是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)= N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·ml-1、ΔS=-145 J·ml-1·K-1。下列说法中错误的是
A. 该反应中反应物的总能量高于生成物的总能量
B. 该反应常温下不能自发进行,因此需要高温条件
C. 该反应常温下能自发进行,高温只是加快反应的速率
D. 汽车尾气中的这两种气体会与血红蛋白结合而使人中毒
二、不定项选择题(本题共8小题,每题4分,共32分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全得2分,有选错的得0分。)
11. 图甲是CO2电催化还原为碳氢化合物(CxHy)的工作原理示意图,用某钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,电池用硫酸作电解质溶液。下列说法中不正确的是
A. 甲中若CxHy为C2H4,则生成1mlC2H4的同时生成3mlO2
B. 甲中铜片作阴极,K+向铂片电极移动
C. 乙中硫酸的作用是增强溶液的导电性
D. 乙中正极反应式为CO2+6e-+6H+=CH3OH+H2O
12. 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
A. 氯碱工业中,X、Y均为石墨,X附近能得到NaOH
B. 铜的精炼中,X是纯铜,Y是粗铜,M是CuSO4
C. 电镀工业中,X是镀层金属,Y是待镀金属
D. 外加电流的阴极保护法中,Y是待保护金属
13. 利用CH4出燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法错误的是
A. a极反应:CH4-8e-+4O2-=CO2+2H2O
B. A膜和C膜均为阴离子交换膜,B膜为阳离子交换膜
C. 可用铁电极替换阳极的石墨电极
D. a极上通入标况下2.24L甲烷,理论上产品室可新增0.4mlCa(H2PO4)2
14. 下列说法正确的是
A. 已知,,则
B. 中和反应的反应热测定实验中为了减少热量散失,溶液应分多次倒入盛有盐酸的量热计内筒中
C. 已知:的燃烧热为,则时,
D. 下,将和置于密闭容器中充分反应生成,放热,则其热化学方程式为
15. 2022北京冬奥会期间,赛区内使用了氢燃料清洁能源车辆,某氢氧燃料电池工作如图所示。下列说法不正确的是
A. 电极a为电池的负极
B. 电极b表面反应为:
C. 电池工作过程中向负极迁移
D. 氢氧燃料电池将化学能转化为电能的转化率高于火力发电,提高了能源利用率
16. 某温度下,在密闭容器中发生反应,反应达到平衡后将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡时的1.5倍。下列说法正确的是
A. 化学平衡逆向移动B. A的平衡转化率增大
C. 平衡常数变大D.
17. 用氢氧燃料电池为电源,以与辛胺为原料实现了甲酸盐和辛腈的高选择性合成,装置工作原理如图。下列说法错误的是
A. 气体X为氧气,气体Y为氢气
B. 工作过程中燃料电池内溶液的pH保持不变
C. 每消耗1 ml 会有4 ml 由M电极区移向N电极区
D. M电极上的电极反应式为
18. 设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成,将废旧锂离子电池的正极材料转化为,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
A. 装置工作时,甲室溶液pH逐渐增大
B. 装置工作一段时间后,乙室应补充盐酸
C. 乙室电极反应式为
D. 若甲室减少,乙室增加,则此时已进行过溶液转移
三、原理综合题
19. 写出或完成下列热化学方程式。
(1)下列变化过程,属于放热反应的是_______。
①浓稀释;②酸碱中和反应:③在中燃烧;④与;⑤铝热反应:⑧碳高温条件下还原;⑦碳酸钙分解
(2)已知:①
②
③
则固态碳和水蒸气反应生成CO和的热化学方程式为_______。
(3)通常人们把拆开1ml某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
根据键能数据估算下列反应:的反应热为_______。
(4)已知稀溶液中,。
①则稀醋酸与稀氢氧化钠溶液反应生成1ml水时放出的热量比57.3kJ_______(填“大”“小”)。若选用硫酸和氢氧化钡的稀溶液做中和热测定实验(操作无误),测定结果_______(填“>”“=”或“0,a为正反应的活化能,b为逆反应的活化能,ΔH=+(a-b) kJ/ml。
【详解】A.反应热△H=反应物能量总和-生成物能量总和,所以反应热△H=+(a-b)kJml1,故A正确;
B.依据能量图象分析可知反应物能量低于生成物能量,故B错误;
C.依据图象分析判断1ml A2和1ml B2反应生成2mlAB,每生成2mlAB吸收(a-b)kJ热量,故C错误;
D.断裂1mlA-A和1mlB-B键,吸收akJ能量,故D错误;
故选A。
3. 在如图所示的装置中,x、y分别是直流电源的两极,通电后发现a极极板质量增加,b极极板处有无色无臭气体放出,符合这一情况的是
A. AB. BC. CD. D
【答案】A
【解析】
【分析】通电后发现a极板质量增加,所以金属阳离子在a极上得电子,a极是阴极;b极板处有无色无臭气体放出,即溶液中氢氧根离子放电生成氧气,b极是阳极,所以X电极是负极,Y电极是正极。
【详解】A.电解硫酸铜溶液,溶液中铜离子在阴极得电子生成铜单质,a极质量增加,b极是溶液中的氢氧根离子放电生成氧气,A正确;
B.电解氢氧化钠溶液,在两电极上分别得到氧气和氢气,得不到金属单质,B错误;
C.电解硝酸银溶液,铁是活泼金属,作阳极失电子,所以在b极得不到气体,C错误;
D.电解氯化铜溶液,在b极处溶液中的氯离子失电子得到有刺激性气味的气体,D错误;
故选A。
4. 下列各装置能达到相应实验目的的是
A. 图甲,中和热的测定B. 图乙,该装置可持续供电
C. 图丙,在铁制品表面镀锌D. 图丁,测定稀硫酸的pH
【答案】C
【解析】
【详解】A.图甲中缺少环形玻璃搅拌棒,不能达到实验目的,A错误;
B.图乙组成原电池装置,反应过程消耗锌电极,当电极材料完全消耗时,将停止供电,因此该装置不可持续供电,B错误;
C.图丙中阳极锌失去电子变为锌离子,阴极锌离子得到电子变为锌单质,该装置能在铁制品表面镀锌,C正确;
D.不能用湿润的pH试纸测定稀硫酸的pH,不能达到实验目的,D错误;
故选C。
5. 观察下列几个装置示意图,有关叙述正确的是
A. 装置①中阳极上析出红色固体
B. 装置②中铜片应与电源负极相连
C. 装置③中外电路电流方向:b极 →a极
D. 装置④中阴极反应:2 Cl--2e-= Cl2
【答案】C
【解析】
【详解】A、阳极失电子,所以应该生成氯气,而红色铜应该在阴极析出,A不正确;
B、镀层金属应该要失去电子进入溶液中,所以铜片与电源正极相连,B不正确;
C、H2在负极上失电子、O2在正极上得电子,电子由a流向b,所以电流由b流向a,C正确;
D、阴极上H+得电子生成H2,D不正确。
故选C。
6. 以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
A. 2ΔH3= -ΔH1-2ΔH2
B. 植物的光合作用通过反应①将热能转化为化学能
C. 在不同油耗汽车中发生反应③,ΔH3不会不同
D. 若反应①生成1.12 L O2,则转移的电子数为0.2×6.02×1023
【答案】C
【解析】
【详解】A.由盖斯定律可知:-①-②=③×2,则2ΔH3=-ΔH1-ΔH2,A错误;
B.假设反应热均小于0,根据2ΔH3=-ΔH1-ΔH2可知ΔH2=-ΔH1-2ΔH3,则若ΔH1
相关试卷
这是一份浙江省2023_2024学年高二化学上学期10月月考试题含解析,共35页。试卷主要包含了选择题等内容,欢迎下载使用。
这是一份北京市顺义区2023_2024学年高二化学上学期10月月考试题含解析,共36页。试卷主要包含了5 Fe 56 Zn 65, 下列物质中,属于弱电解质的是, 汽车尾气处理存在反应, 下列说法正确的是, 下列热化学方程式书写正确的是,8kJ/ml等内容,欢迎下载使用。
这是一份安徽省2023_2024学年高二化学上学期10月月考试题含解析,共18页。试卷主要包含了考试时间60分钟,满分100分,3kJ/ml,2kJ/mlB, 下列说法正确的是,3ml,因而Q1=0, 下列实验能达到目的的是等内容,欢迎下载使用。










