

福建省福州市长乐区2024-2025学年九年级上学期11月期中化学试题
展开
这是一份福建省福州市长乐区2024-2025学年九年级上学期11月期中化学试题,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
(考试时间:60分钟 满分:100分)
第Ⅰ卷 选择题(共30分)
相对原子质量:H-1 C-12 O-16
一、选择题:本题共10小题,每小颗3分,共30分。在镁小题给出的四个选项中,只有一项是符合题目要求的。
1.下列变化中,与另外三个有本质区别的是
A.弯曲铁丝 B.蜡炬成灰 C.冰雪融化 D.酒精挥发
2.烧制瓷器的黏土中含有以下元素,其中地壳中含量最多的金属元素是
B.氧 C.硅 D.铁 A.铝
3.化学符号是独特的化学语言,下列对“2”的表达正确的是
A.2O:表示2个氧元素 B.Mg2+:2表示镁元素的化合价
C.H2O:一个水分子中有2个氢分子 D.:氧化钙中钙元素为+2价
4.下列图示实验操作中,正确的是
A.取用粉末 B.倾倒液体
C.验满氧气 D.连接仪器
5.下列事实或现象的解释错误的是
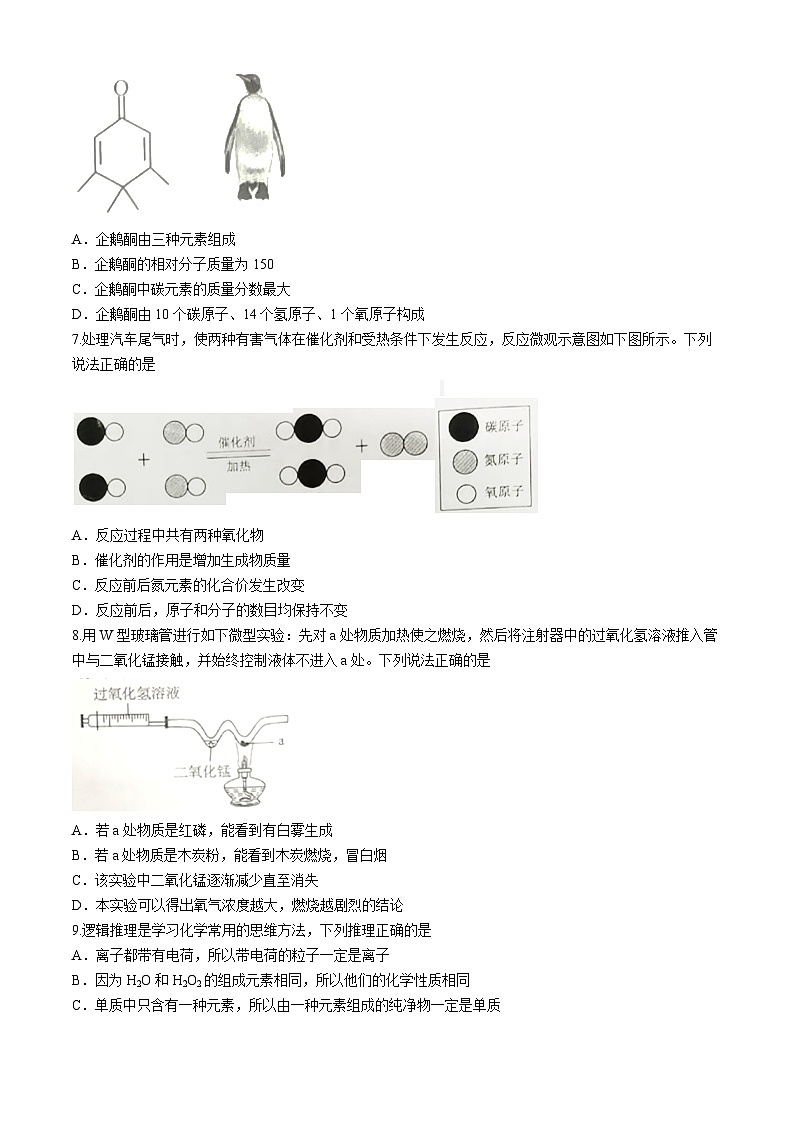
6.如图,“企鹅酮”(C10H14O)是一种分子结构简式形似企鹅的物质。关于企鹅酮的说法错误的是
A.企鹅酮由三种元素组成
B.企鹅酮的相对分子质量为150
C.企鹅酮中碳元素的质量分数最大
D.企鹅酮由10个碳原子、14个氢原子、1个氧原子构成
7.处理汽车尾气时,使两种有害气体在催化剂和受热条件下发生反应,反应微观示意图如下图所示。下列说法正确的是
A.反应过程中共有两种氧化物
B.催化剂的作用是增加生成物质量
C.反应前后氮元素的化合价发生改变
D.反应前后,原子和分子的数目均保持不变
8.用W型玻璃管进行如下微型实验:先对a处物质加热使之燃烧,然后将注射器中的过氧化氢溶液推入管中与二氧化锰接触,并始终控制液体不进入a处。下列说法正确的是
A.若a处物质是红磷,能看到有白雾生成
B.若a处物质是木炭粉,能看到木炭燃烧,冒白烟
C.该实验中二氧化锰逐渐减少直至消失
D.本实验可以得出氧气浓度越大,燃烧越剧烈的结论
9.逻辑推理是学习化学常用的思维方法,下列推理正确的是
A.离子都带有电荷,所以带电荷的粒子一定是离子
B.因为H2O和H2O2的组成元素相同,所以他们的化学性质相同
C.单质中只含有一种元素,所以由一种元素组成的纯净物一定是单质
D.在火焰上方罩干冷的烧杯,内壁出现水雾,可推测该可燃物含有氧元素
10.化学小组的同学受英国科学家法拉第所著的《蜡烛的化学史》的启发,对蜡烛的燃烧过程进行了再一次探究。下列有关说法正确的是
【查阅资料】硫酸铜是一种白色粉末,具有吸水性,吸水后变为蓝色。
A.实验1:可观察到澄清石灰水变浑浊,白色粉未变为蓝色
B.实验2:导管越长,越容易在导管的另一端点燃形成子火焰
C.实验3:用火柴点燃刚刚熄灭的白烟,蜡烛重新燃烧
D.实验4:蜡烛燃烧后天平指针向左偏转
第Ⅱ卷 非选择题(共70分)
二、非选择题:本题共8小题,共70分。
11.(8分)
化学在生活、生产、科技等领域发挥着重要的作用,请回答下列问题:
(1)薯片是易碎、易潮的松脆食品,通常在其密封塑料包装袋中充入一种气体,从食品卫生、食品安全和经济角度综合考虑,猜测薯片包装袋内常用的填充气是_________,空气中该气体的体积分数约为___________。
(2)“打铁花”表演方式独特、文化内涵丰富,被列为国家级非物质文化遗产。铁在氧气中剧烈燃烧,该反应的文字(或符号)表达式是________,其基本反应类型属于___________。
(3)我国自主研发出大型低温制冷装备,被称作“超级低温工厂”。使用该设备可将氢气液化,体积可以减少至约,极大降低运输成本。将氢气转化为液氢的技术,从微观角度解释该过程发生改变的是______。从物质类别的角度分析,液氢属于_________(填“混合物”或“纯净物”)。
12.(8分)在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
(1)物质的组成及构成关系如下图所示,图中②表示的是_________。
(2)从宏观角度看,金属汞是由_____组成:从微观角度看,金属汞是由___构成。保持二氧化碳化学性质的是________。
(3)下列微观示意图中,能表示化合物的是_____。(填字母,下同),能表示3个分子的是________。
13.(8分)
阅读下列材料,回答相应问题。
材料一:锂元素的原子结构示意图及其在元素周期表中的部分信息如图所示。
材料二:锂曾被称为“白色黄金”,银白色,质软,是最轻的金属。锂是一种活泼金属,能与氮气、氧气、水等物质反应。电解熔融氯化锂可制得金属锂,同时生成氯气(Cl2)。锂及其化合物用途广泛,可用作电池材料。
(1)锂的相对原子质量为________。
(2)锂的物理性质:_______(写一条)。
(3)锂与氧气反应生成氧化锂,氧化锂的化学式为_______。
(4)锂离子电池的正极材料含有LiFePO4,已知Fe化合价为+2,则Р化合价为______。
(5)提出保存金属锂的建议:_______(写一条)。
14.(8分)某实验小组收集浑浊的河水,模拟自来水厂的净水过程,最终得到蒸馏水。净水过程如下图所示。
(1)加入明矾的作用是________。
(2)操作①的名称是_______,该操作中用到的玻璃仪器有烧杯、漏斗、_____,其作用是__________。
(3)下图装置(Ⅱ)对应上述实验过程的操作_______(填“②”或“③”),该过程中利用了活性炭的______性质来净化水。为了得到更好的净水效果,装置(Ⅱ)中的入水口应该是______(填“a”或“b”)端。装置(Ⅰ)中碎瓷片的作用是__________。
15.(10分)化学兴趣小组追寻科学家的足迹,对水进行探究。
【宏观辨识】根据实验探究水的组成
(1)水的合成:在密闭容器中将氢气和氧气的混合气体点燃,根据容器内生成的小水珠可知,水是由___组成的化合物。
(2)水的分解:电解水一段时间后(如右图),观察到管a和管b中气体体积比为_______。经检验管a中的气体是_______(填化学式)。
【证据推理】结合实验现象推算水分子中氢、氧原子个数比。
方法一:根据相同条件下气体的体积比等于其分子的个数比,得出电解水的产物中氢、氧原子个数比为_______,进而推算出结果。
方法二:已知电解水实验中氢气和氧气的体积比和正、负极产生气体的_____,可计算出水中各元素质量比,结合氢、氧原子的相对原子质量,可进一步推算出结果。
【微观探析】根据质量守恒定律画出水电解过程的微观示意图。
16.(10分)
根据下图回答有关问题。
(1)仪器①的名称是_______。
(2)实验室用高锰酸钾制取氧气的文字(或符号)表达式为_________,在装入药品前应先检查装置的_______,用装置C收集氧气时,气体应从导管口_______(填字母)通入。
(3)将收集的氧气倒入装置D的烧杯中,观察到带火星的木条自下而上依次复燃,说明氧气具有的性质是_______和_______。
(4)小明用塑料瓶自制了如图E的简易供氧器,利用该装置制取氧气,应将过氧化氢溶液和二氧化锰加入到_______(填“c”或“d”)塑料瓶中。在另一塑料瓶中可装入少量的水,以便于________。
17.(12分)
实验小组研究不同催化剂对过氧化氢分解速率的影响。
【查阅资料】i.二氧化锰(MnO2)、氯化铁(FeCl3)均可作为加快过氧化氢分解速率的催化剂。
ii.锥形瓶内氧气浓度达到最大值时,表明过氧化氢已完全分解。
【实验准备】组装2图所示装置(夹持仪器已略),经检验,装置符合实验要求。
实验1:比较催化剂种类对过氧化氢分解速率的影响。
【进行实验】如下表所示,在锥形瓶中放入催化剂,用注射器推入过氧化氢溶液,记录实验数据。
【解释与结论】
(1)用MnO2催化过氧化氢分解的文字(或符号)表达式为________。
(2)为达成实验1的目的,需要被控制成相同的变量有过氧化氢溶液的浓度、_______和_______。
(3)依据实验1的数据可推知MnO2催化过氧化氢分解的速率大于FeCl3,其证据是____________。
实验2:继续探究FeCl3质量对过氧化氢分解速率的影响。
【进行实验】如下表所示,在锥形瓶中放入FeCl3,用注射器推入5%过氧化氢溶液,记录实验数据。
【解释与结论】
(4)由实验2可得结论:过氧化溶液体积等条件相同时,FeCl3质量在0.03~0.05g范围内,______________。
【反思与评价】
(5)实验小组用1-2的方案制备氧气,发现反应速率偏慢。根据上述实验结论,你认为可采取的改进措施有________(写出两条)。
18.(6分)
葡萄酒中含有白藜芦醇(CxH12O3),现代科技证明,白藜芦醇具有美容养颜之功效。其相对分子质量为228.试计算:
(1)x=______。
(2)白藜芦醇中氢元素和氧元素的质量比为_______。(填最简整数比)
(3)22.8g白藜芦醇中含有氧元素的质量为______g。
2024-2025学年第一学期期中阶段反馈练习
化学参考答案及评分标准
说明:
1、“文字(或符号)表达式”:若出现错字或化学式错误,不得分;未配平、配平错误或气标未标,改卷时可圈出错误,暂不扣分:反应条件错误扣1分。
2、其他化学专业用语出现错字,不得分。
第Ⅰ卷(共10小题,共30分)
一、选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的。
第Ⅱ卷(共8小题,共70分)
二、非选择题:本题共8小题,共70分。
11.(8分)
(1)氮气(或N2)(1分);78%(1分)
(2)铁+氧气四氧化三铁(或Fe+O2Fe3O4)(2分);化合反应(2分)
(3)氢分子之间的间隔(1分);纯净物(1分)
12.(8分)
(1)分子(1分)
(2)汞元素(1分);汞原子(1分)
二氧化碳分子(1分)
(第一空填“元素”不得分:第二空填写“原子”可得分;第三空填写“分子”可得分)
(3)B(2分)
AB(2分,对一个得1分:有错不得分)
13.(8分)
(1)6.941(1分)
(2)银白色(或质软、密度小等答案也可得分)(1分)
(3)Li2O(2分)
(4)+5(2分)
(5)隔绝空气保存(或防潮密封保存等其他合理答案也可得分)(2分)
14.(8分)
(1)使水中悬浮的杂质较快沉降(1分)
(2)过滤(1分);玻璃棒(1分);引流(1分)
(3)②(1分);吸附(1分);b(1分);防止加热时出现暴沸(1分)
15.(10分)
【宏观辨识】(1)氢元素和氧元素(2分)(填写H和O扣1分)
(2)2:1(1分);H2(1分)
【证据推理】2:1(2分);密度(2分)
【微观探析】 (2分)
16.(10分)
(1)长颈漏斗(1分)
(2)高锰酸钾锰酸钾+二氧化锰+氧气(或KMnO4K2MnO4+MnO2+O2)(2分);气密性(l分);a(1分)
(3)密度比空气大(1分);能支持燃烧(或能使带火星的木条复燃等)(1分)
(4)d(l分)
通过产生气泡的速率观察产生氧气的速率(或湿润氧气、过滤杂质等合理答案)(2分)
17.(12分)
(1)过氧化氢水+氧气(或H2O2H2O+O2)(2分)
(2)过氧化氢溶液的体积(2分);催化剂的质量(2分)
(3)相同条件下,产生同等浓度的氧气,二氧化锰所需时间比氯化铁短(2分)
(4)氯化铁质量越大,过氧化氢分解速率越快(2分)
(5)增加氯化铁的质量,将氯化铁换成二氧化锰(2分)
18.(6分)
(1)14(2分)
(2)1:4(2分)
(3)4.8(2分)选项
事实或现象
解释
A
金秋十月,桂花飘香
分子总是在不断运动着
B
将二氧化碳气体制成干冰(固态二氧化碳),体积变小
分子体积变小
C
氮气不如氧气活泼
不同分子化学性质不同
D
氧化汞(HgO)加热会分解
化学变化中分子可以再分
序号
药品
氧气浓度传感器的数据
1-1
3mL、5%过氧化氢溶液
0.03gMnO2固体
1-2
3mL、5%过氧化氢溶液
0.03gFeCl3固体
序号
FeCl3质量
过氧化氢溶液体积
过氧化氢完全分解所用时间
2-1
0.03g
3mL
61s
2-2
0.04g
3mL
56s
2-3
0.05g
3mL
49s
1
2
3
4
5
6
7
8
9
10
B
A
D
A
B
D
C
D
C
C
相关试卷
这是一份福建省福州市长乐区2024-2025学年九年级上学期11月期中化学试题,文件包含2024-2025学年第一学期长乐区九年级化学适应性练习docx、2024-2025学年第一学期九年级化学期中阶段反馈练习参考答案pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
这是一份福建省福州市台江区2024-2025学年九年级上学期期中考试化学试题,文件包含福建省福州市台江区2024-2025学年九年级上学期期中考试化学试题pdf、2024-2025学年第一学期台江区九年级化学期中适应性练习参考答案docx、2024-2025学年第一学期台江区九年级期中适应性练习化学答题卡pdf等3份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
这是一份福建省福州市长乐区2023-2024学年九年级上学期期中化学试题,共7页。试卷主要包含了选择题每题3分,共30分,非选择题等内容,欢迎下载使用。









