所属成套资源:安徽省江淮十校2025届高三上学期高考第二次联考试题
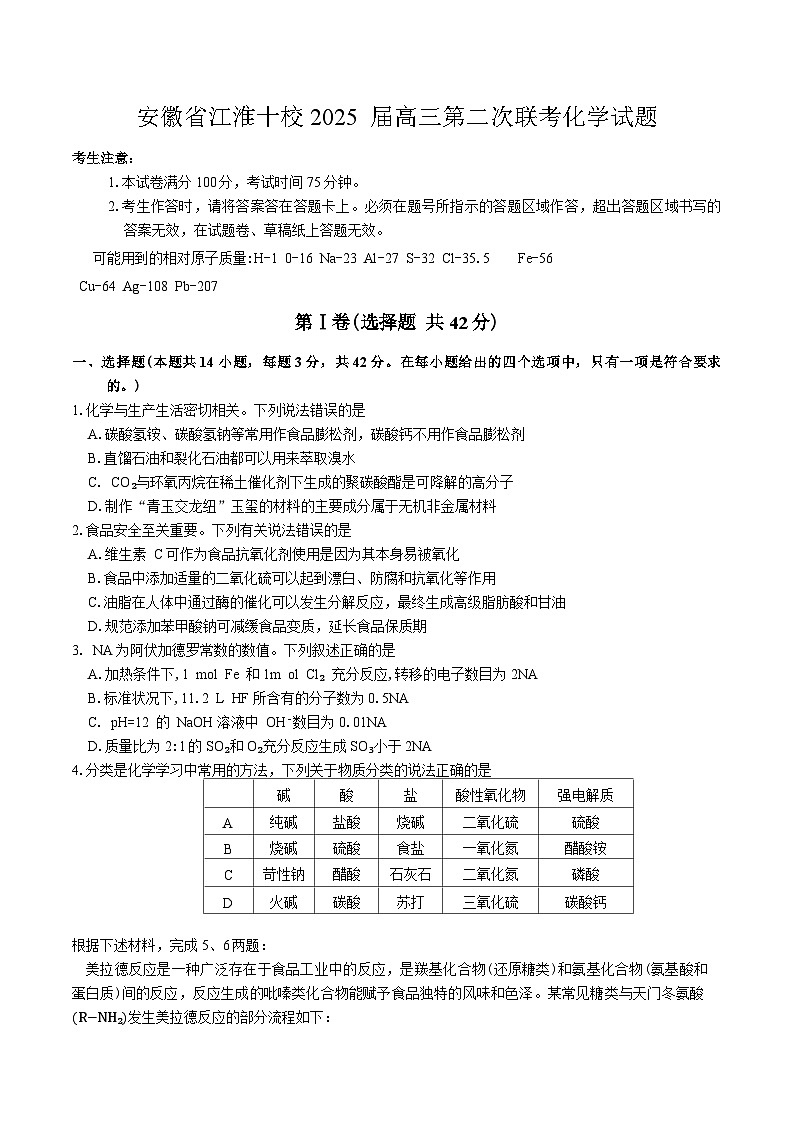
安徽省江淮十校2025届高三上学期高考第二次联考化学试题(含答案)
展开
这是一份安徽省江淮十校2025届高三上学期高考第二次联考化学试题(含答案),共8页。试卷主要包含了5 Fe-56, NA为阿伏加德罗常数的数值,01NA等内容,欢迎下载使用。
1.本试卷满分100分,考试时间75分钟。
2.考生作答时,请将答案答在答题卡上。必须在题号所指示的答题区域作答,超出答题区域书写的答案无效,在试题卷、草稿纸上答题无效。
可能用到的相对原子质量:H-1 0-16 Na-23 Al-27 S-32 Cl-35.5 Fe-56
Cu-64 Ag-108 Pb-207
第Ⅰ卷(选择题 共42分)
一、选择题(本题共14小题,每题3分,共42分。在每小题给出的四个选项中,只有一项是符合要求的。)
1.化学与生产生活密切相关。下列说法错误的是
A.碳酸氢铵、碳酸氢钠等常用作食品膨松剂,碳酸钙不用作食品膨松剂
B.直馏石油和裂化石油都可以用来萃取溴水
C. CO₂与环氧丙烷在稀土催化剂下生成的聚碳酸酯是可降解的高分子
D.制作“青玉交龙纽”玉玺的材料的主要成分属于无机非金属材料
2.食品安全至关重要。下列有关说法错误的是
A.维生素 C可作为食品抗氧化剂使用是因为其本身易被氧化
B.食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化等作用
C.油脂在人体中通过酶的催化可以发生分解反应,最终生成高级脂肪酸和甘油
D.规范添加苯甲酸钠可减缓食品变质,延长食品保质期
3. NA为阿伏加德罗常数的数值。下列叙述正确的是
A.加热条件下,1 ml Fe 和1m l Cl₂ 充分反应,转移的电子数目为2NA
B.标准状况下,11.2 L HF所含有的分子数为0.5NA
C. pH=12 的 NaOH溶液中 OH⁻数目为0.01NA
D.质量比为2:1的SO₂和O₂充分反应生成SO₃小于2NA
4.分类是化学学习中常用的方法,下列关于物质分类的说法正确的是
根据下述材料,完成5、6两题:
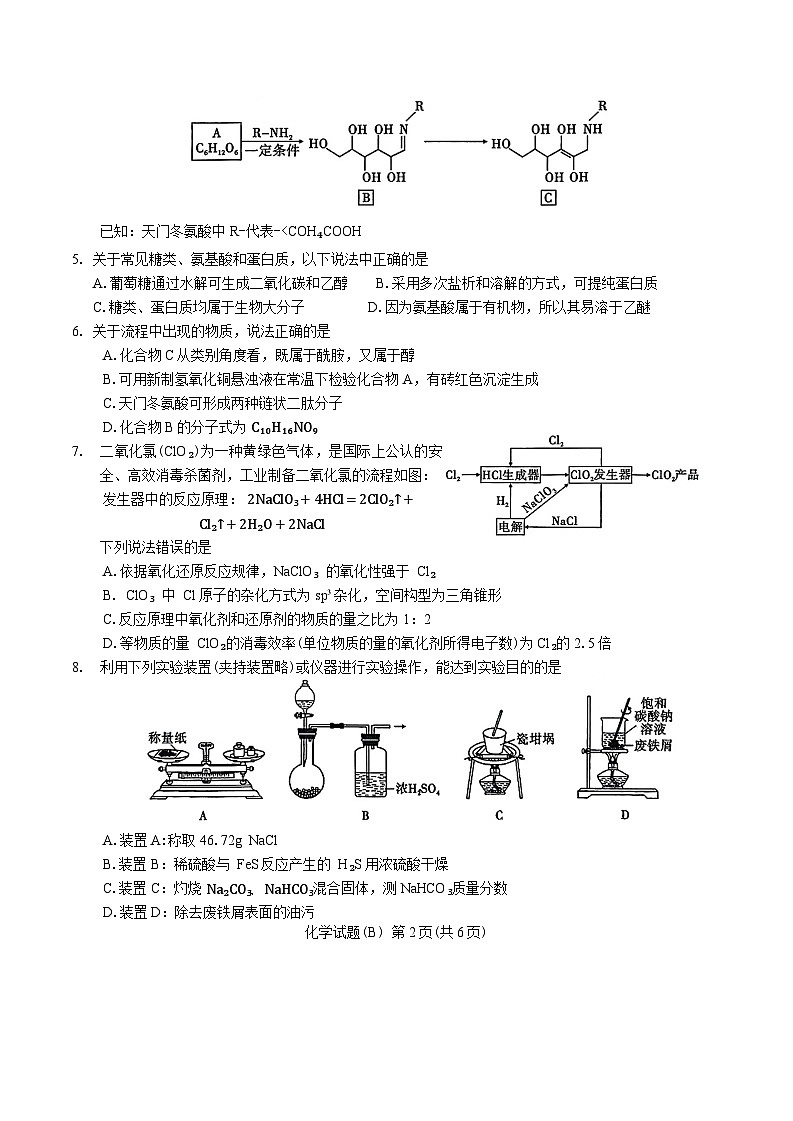
美拉德反应是一种广泛存在于食品工业中的反应,是羰基化合物(还原糖类)和氨基化合物(氨基酸和蛋白质)间的反应,反应生成的吡嗪类化合物能赋予食品独特的风味和色泽。某常见糖类与天门冬氨酸 R−NH₂发生美拉德反应的部分流程如下:
已知:天门冬氨酸中R-代表-X>Y
D.简单离子半径比较:R>Q>Z>Y
12.以物质的量之比为1:2向恒压密闭容器中充入X、Y,发生反应X(g)+Y(g)=2Z(g) △H,相同时间内测得Z的产率和Z在不同温度下的平衡产率随温度的变化关系如图所示。下列说法正确的是
A.据图像分析,该反应是吸热反应
B. Q点是最高点,Q点为平衡状态
C. M、N点反应物分子的有效碰撞几率不同
D.从M点到 P点,可通过加入催化剂或分离产物Z而达到平衡点
化学试题(B) 第3页(共6页)
实验目的
方案设计
现象
结论
A
验证久置的 Na₂SO₃是否变质
取少量久置的 Na₂SO₃样品溶于蒸馏水中,加入足量的稀盐酸,再滴加氯化钡溶液(不考虑溶液中溶解的O₂)
产生白色沉淀
Na₂SO₃已氧化变质
B
探究 NaCl 的化学键类型
将 NaCl 固体溶于水,进行导电性实验
NaCl 溶液能导电
NaCl 的化学键是离子键
C
验证某红棕色气体是否为NO₂
将气体通入淀粉-KI溶液中
溶液变蓝
说明该气体为NO₂
D
探究脱氧剂(主要成分是 Fe粉)是否变质
取少量样品溶于盐酸,滴加KSCN溶液
无明显现象
脱氧剂没有变质
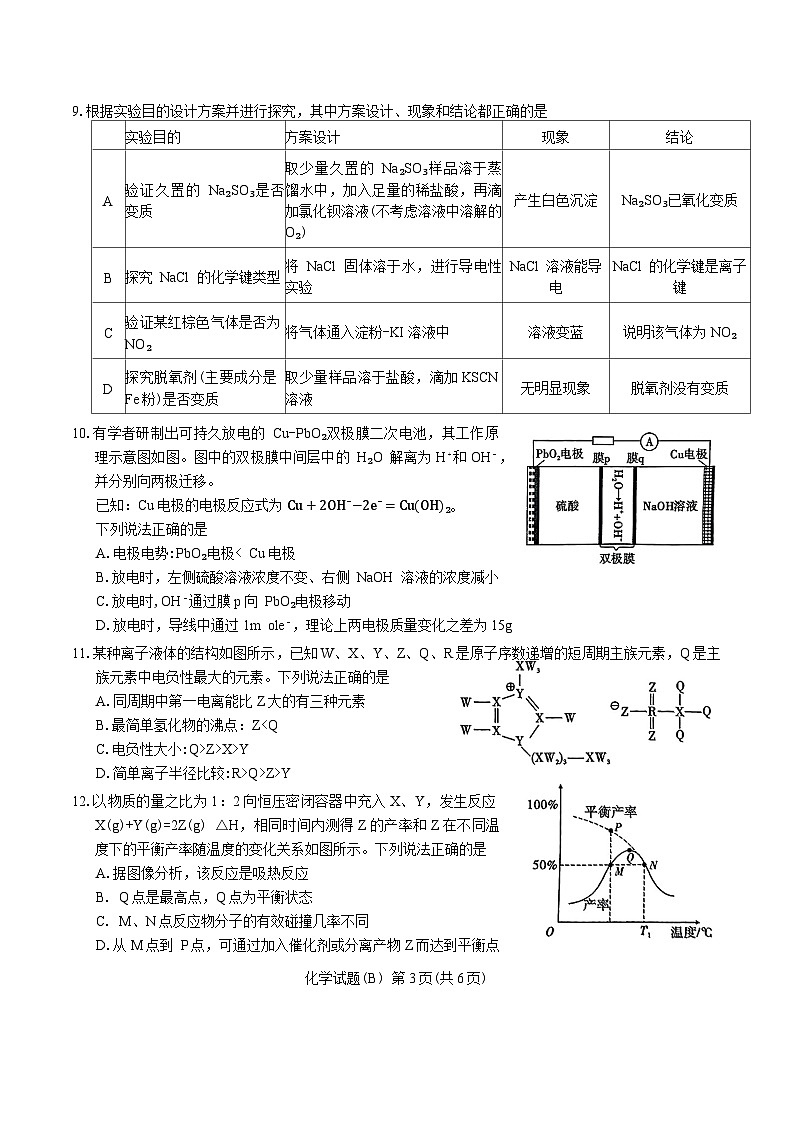
13.氢化铝钠( NaAlH₄是一种新型轻质储氢材料, NaAlH₄可由 AlCl₃和NaH在适当条件下合成,的晶胞结构如图所示,它是由两个正六面体叠加而成。设阿伏加德罗常数的值为 NA,下列说法错误的是
A.NaAlH₄中氢元素显-1价
B.AlH4−的空间结构为正四面体形
C.Na⁺的配位数为8
D.根据物质组成分析, NaAlH₄与水反应时既有沉淀也有气体生成
₄⋅7H₂O样品在. N₂气氛中受热分解过程的热重曲线如图所示,下列说法正确的是
A. P→Q 过程产生的气体为纯净物 B.x=4,y=1
C.加热到 633 ℃剩余的固体呈黑色 D.检验固体Q的成分可用铁氰化钾试剂
第Ⅱ卷(非选择题 共58分)
二、非选择题(本大题共4小题,共58分)
15.(14分)胆矾( CuSO₄⋅5H₂O是一种络合物,其组成也可写为[ CuH₂O₄SO₄⋅H₂O。往硫酸铜溶液中逐滴加入氨水,溶液由蓝色转变为深蓝色。这是因为四水合铜(Ⅱ)离子经过反应,最后生成铜氨络离子 CuNH₃₄²⁺而使溶液呈深蓝色。
(1)铜元素位于元素周期表的 区,( Cu²⁺的价电子排布式为 。
(2)胆矾晶体中含有的化学键有: 。
3CuNH₃₄SO₄中非金属元素电负性由大到小的顺序是 (用元素符号表示)
(4)H₂O 的中心原子轨道杂化类型为 杂化; SO42−的VSEPR 构型是 。
5CuH₂O₄²⁺和 CuNH₃₄²⁺中的配位键哪一个更强? 并解释原因: 。
16.(14分)手工皂早已在韩国、欧洲、日本和我国台湾、香港等地成为时尚。手工皂是使用天然油脂与碱液,由人工制作而成的肥皂。基本上是油脂和碱液起皂化反应的结果,经固化、熟成程序后可用来洗涤、清洁。手工皂还可依据个人的喜好与目的,加入各种不同的添加物,例如牛乳、精油、香精、花草、中药等。
请回答下列问题:
(1)油脂在酸性或者碱性条件下均能发生水解,这两种条件下水解的共同有机产物的名称为 ,结构简式为 。
化学试题(B) 第4页(共6页)(2)牛乳中含有丰富的蛋白质,是一种优质的蛋白质来源,下列关于蛋白质的说法正确的是 。
A.蛋白质只含有 C、H、O、N 四种元素
B.天然蛋白质是由α-氨基酸加聚形成的
C.向蛋白质水溶液中加入食盐会有沉淀产生
D.蛋白质遇硝酸都能发生颜色反应
(3)手工皂的使用的一种包装材料聚芳酯的一种合成路线如下:
①B 的分子式为 ,B中最多有 个原子共面。
②请写出C+F生产聚芳酯的化学方程式: 。
③请写出一种符合下列条件的D 的结构简式: 。
a.能与碳酸氢钠反应产生气体
b.能和新制氢氧化铜悬浊液反应
c.含有手性碳原子
17.(16分)钒(V)被称为钢铁行业的“维生素”。从某钒矿石焙砂中(主要含有 V₂O₅和铝铁硅的氧化物)提取钒的主要流程如下:
已知:
i.滤液A中的阳离子有等;
ii. “萃取”过程可表示为 VO²⁺+2HA(有机相)⇌═VOA₂(有机相)+2H⁺。
化学试题(B) 第5 页(共6页)
金属离子
开始沉淀的pH(c=0.01 ml·L⁻¹)
沉淀完全的pH(c=1.0×10⁻⁵ ml·L⁻¹)
Fe²⁺
6.8
8.3
Al³⁺
3.7
4.7
Fe³⁺
1.8
2.8
(1)“浸钒”时,为加快浸出速率可采取的措施有 (写出1条即可),滤渣 B 的成分为 。
(2)“浸钒”过程中,主要发生的离子方程式为 。
(3)“萃取”前,用石灰乳先中和的原因是 。
(4)“萃取”与“反萃取”的目的是 ,都需要用到的主要玻璃仪器是 ,假设“滤液C”中 cVO²⁺=aml⋅L⁻¹,“萃取”和“反萃取”每进行一次,VO²⁺萃取率为90%,4次“萃取和反萃取”后,“滤液C”中残留的((萃取率 =苯取的最大原量×100%)
(5)写出“煅烧”过程发生反应的化学方程式 。
18.(14分)聚合氯化铝(PAC)是一种无机物,一种新型净水材料、无机高分子混凝剂,简称聚铝。它是介于AlCl₃和 Al(OH)₃之间的一种水溶性无机高分子聚合物,化学通式为 Al₂OHₙCl₆₋ₙₘ,其中m代表聚合程度,n表示 PAC 产品的中性程度。聚合氯化铝是具有 Keggin结构的高电荷聚合环链体,对水中胶体和颗粒物具有高度电中和及桥联作用,并可强力去除微有毒物及重金属离子,性状稳定。
Ⅰ.无水氯化铝的制备
已知:氯化铝熔点、沸点都很低,且易升华,易水解。
(1)若想制取并收集 AlCl₃,,图中仪器正确的连接顺序是 (部分装置可重复使用)。
(2)溶液Ⅰ是一种常见的紫红色溶液,请写出A中反应的离子方程式为 。
(3)B中装有的溶液是 。
(4)F中发生的化学方程式是 。
Ⅱ.聚合氯化铝的制备
聚合氯化铝的一种制备方法是采用氯化铝粉为原料,加工聚合氯化铝。这种方法应用最为普遍。可用结晶氯化铝( AlCl₃⋅6H₂O于170 ℃进行沸腾热解,加水熟化聚合,再经固化、干燥制得。
(5)请根据上述描述写出由 AlCl₃制备聚合氯化铝单体的化学方程式为 。
Ⅲ.聚合氯化铝 Al₂OHₙCl₆₋ₙₘn值的测定
①称取一定质量的晶体,制成粉末,加热至质量不再变化为止,称量为 bg。
②另取一定质量的晶体,进行如下操作:用A 试剂溶解→加足量. AgNO₃溶液→过滤、洗涤→烘干→称量为cg。
(6)A试剂为 ,n= (用含b、c的代数式表示)。
化学试题(B) 第6页(共6页)江淮十校2025 届高三第二次联考
化学试题参考答案
一、选择题(本题共14小题,每题3分,共42分。)
二、非选择题(本大题共4 小题,共58分)
15.【答案】(每空2分,共14分)
(1) ds 3d⁹
(2)离子键、共价键(或离子键、共价键、配位键)
(3)0>N>S>H
(4)sp³ 正四面体形
5CuNH₃₄²⁺中的配位键更强,因为N的电负性小于O,给电子能力更强,形成的配位键更强
(3)电负性大小关系:O>N>S>H。
(4)H₂O的中心原子O 的价层电子对数为4,为 sp³杂化;SO₄²⁻的中心原子S的价层电子对数为4,故 VSEPR模型为正四面体形。
(5)[Cu(NH₃)₄]²¹中的配位键更强,因为N的电负性小于O,给电子能力更强,形成的配位键更强。
16.【答案】(每空2分,共14分)
17.【答案】(每空2分,共16分)
(1)适当增大硫酸浓度、适当升高温度、将矿石粉碎(合理即可) SiO₂
2V2O5+2H+2VO2++H2O
(3)若不用石灰乳中和,溶液中c(H⁺)较大,不利于平衡 VO²⁺+2HA(有机相)⇌═VOA₂(有机相)+2H⁺正向移动,对 VO²⁺萃取效果不好
(4)将VO²⁺.(与其他金属离子分离开 分液漏斗 a×10⁻⁴
5NH42V6O162NH3↑+3V2O5+H2O↑
18.【答案】(每空2分,共14分)
(1)ABECDEF
22MnO4−+10Cl−+16H+2Mn2++5Cl2↑+8H2O
(3)饱和食盐水
(4)Cl₂+2NaOHNaCl+NaClO+H₂O (NaOH、KOH 或离子方程式均可给分)
52AlCl₃+nH₂O=Al₂OHₙCl₆₋ₙ+nHCl
(6)硝酸(写HNO₃或稀硝酸都给分) 861b−102c143.5b
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
选项
B
C
A
D
B
C
C
D
A
D
A
C
D
B
相关试卷
这是一份安徽省江淮十校2024届高三上学期11月第二次联考化学试题含答案,共15页。试卷主要包含了11,5 C-59 Cu-64,63,8025)等内容,欢迎下载使用。
这是一份安徽省江淮十校2024届高三上学期11月第二次联考化学试题(含答案),共15页。试卷主要包含了11,5 C-59 Cu-64,63,8025)等内容,欢迎下载使用。
这是一份2022届安徽省江淮十校高三上学期11月第二次联考化学试题(PDF版含答案),共9页。









