


人教版 (2019)必修 第一册第一节 铁及其化合物课文配套ppt课件
展开
这是一份人教版 (2019)必修 第一册第一节 铁及其化合物课文配套ppt课件,共19页。PPT课件主要包含了铁的化合物,氧化物,氢氧化物,我的实验设计,我的结论,学与问,直接观察,硫氰化钾,不是沉淀,方案一等内容,欢迎下载使用。
学习目标:
1. 通过实验探究铁的氢氧化物、铁盐和亚铁盐的化学性质,并能用化学方程式或离子方程式正确表示。体会实验对认识和研究物质性质的重要作用;
2. 通过学习铁的化合物,学会从物质类别和元素价态的视角认识具有变价金属元素物质之间的转化关系,并建立认识模型,丰富研究物质的思路和方法;
3. 结合应用实例,将铁的化合物性质的知识运用于解决生产、生活中简单的化学问题,强化性质决定用途的观念。
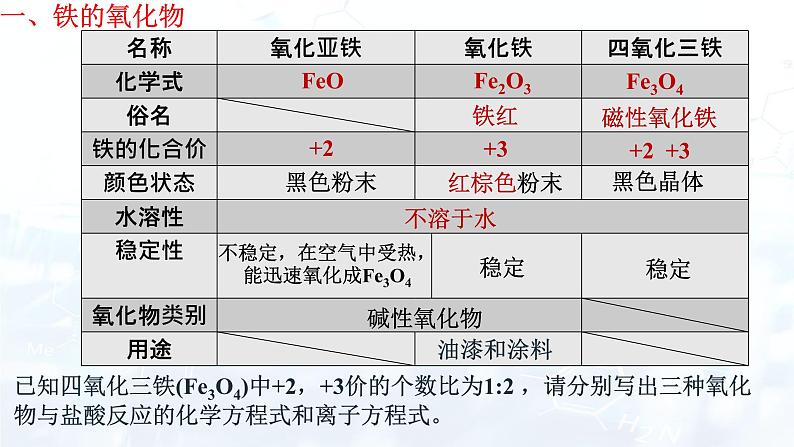
硫酸亚铁(FeSO4)
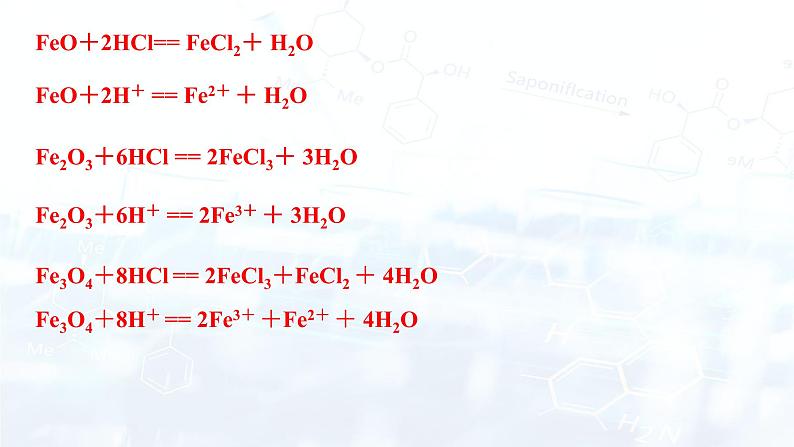
已知四氧化三铁(Fe3O4)中+2,+3价的个数比为1:2 ,请分别写出三种氧化物与盐酸反应的化学方程式和离子方程式。
Fe2O3+6H+ == 2Fe3+ + 3H2O
FeO+2H+ == Fe2+ + H2O
FeO+2HCl== FeCl2+ H2O
Fe2O3+6HCl == 2FeCl3+ 3H2O
Fe3O4+8H+ == 2Fe3+ +Fe2+ + 4H2O
Fe3O4+8HCl == 2FeCl3+FeCl2 + 4H2O
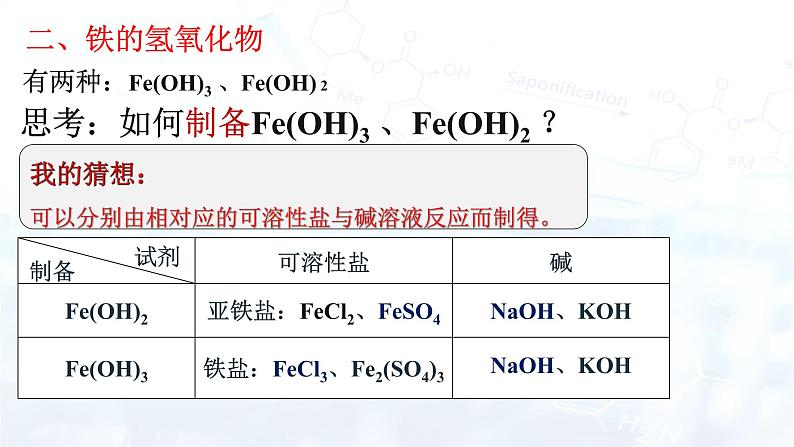
有两种:Fe(OH)3 、Fe(OH) 2
思考:如何制备Fe(OH)3 、Fe(OH)2 ?
我的猜想:可以分别由相对应的可溶性盐与碱溶液反应而制得。
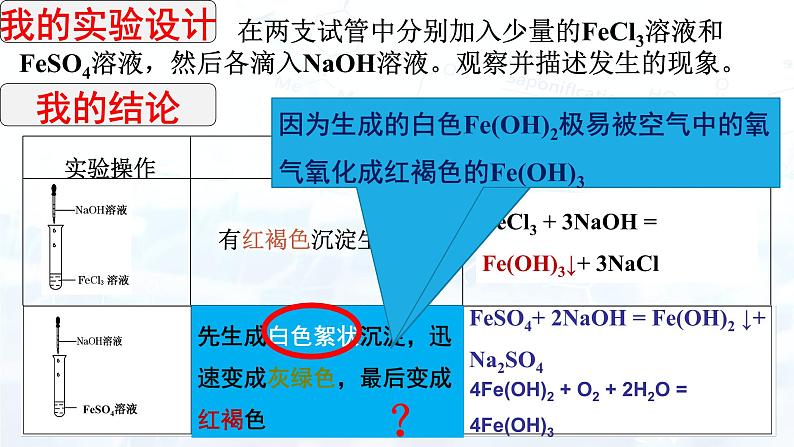
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色
氢氧化亚铁到底是什么颜色呢?
为什么制取Fe(OH)2现象会是
因为生成的白色Fe(OH)2极易被空气中的氧气氧化成红褐色的Fe(OH)3
FeSO4+ 2NaOH = Fe(OH)2 ↓+ Na2SO4
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
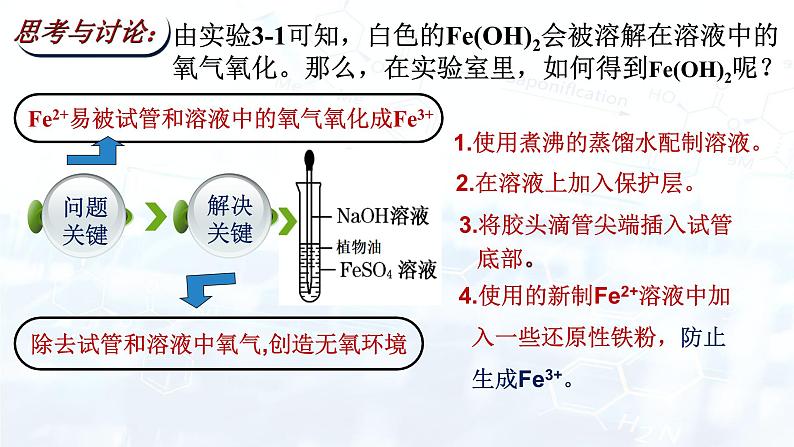
由实验3-1可知,白色的Fe(OH)2会被溶解在溶液中的氧气氧化。那么,在实验室里,如何得到Fe(OH)2呢?
2.在溶液上加入保护层。
3.将胶头滴管尖端插入试管 底部。
4.使用的新制Fe2+溶液中加 入一些还原性铁粉,防止 生成Fe3+。
1.使用煮沸的蒸馏水配制溶液。
1.Fe(OH)2和Fe(OH)3都是不溶性碱,你能写出与盐酸反应 的离子方程式吗?
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3++3H2O
2.Fe(OH)3不稳定,受热易分解,写出其化学方程式。
实验台上两瓶失去标签的FeCl2溶液和FeCl3溶液, 如何鉴别它们?
【实验3-3】在盛有2mLFeC13,溶液的试管中加入少量铁粉,振荡试管。充分反应后,滴入几滴KSCN溶液,观察并记录现象。把上层清液倒入另一支试管中,再滴入几滴氯水,又发生了什么变化?
【实验3-2】在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,各滴入几滴KSCN溶液。观察并记录现象。
由此可知,含有Fe3+的盐溶液遇到KSCN溶液时变成红色。我们可以利用这一反应检验Fe3+的存在。
溶液由棕黄色变成浅绿色
2Fe3++Fe==3Fe2+
2Fe2++Cl2==2Fe3++2Cl-
实验结论:Fe3+遇到较强的还原剂时,会被还原成Fe2+;Fe2+在 较强的氧化剂作用下会被氧化成Fe3+
利用下列两种方案检验某溶液中的Fe2+ ,哪种设计实验证明其中存在Fe2+,并说明理由。
理由:方案二若原溶液中不含Fe2+,含有Fe3+,滴加氯水,加入KSCN溶液同样可以变红色。而方案一先滴加KSCN溶液无明显变化,说明原溶液中不含Fe3+,再滴加氯水,溶液变红,说明原溶液中含有Fe2+
1.除去下列物质中含有的少量杂质,写出除杂所用试剂的化学式和反应的离子方程式:(1)FeC12溶液中含有少量的FeC13杂质;(2)FeC13溶液中含有少量的FeC12杂质;(3)FeSO4溶液中含有少量的CuSO4杂质。2.下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+3价的是( )。A.氯化铁溶液 B.氯气 C.硫酸铜溶液 D.稀盐酸
Fe,Fe+2Fe3+=3Fe2+
Cl2,2Fe2++Cl2=2Fe3++2Cl-
Fe,Fe+Cu2+=Fe2++Cu
3.为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其中结论正确的是( )。A.若滴加KSCN溶液,溶液变红,说明铁粉变质B.若滴加KSCN溶液,溶液未变红,说明铁粉未变质C.若依次滴加氯水、KSCN溶液,溶液变红,说明铁粉全部变质D.若滴加KSCN溶液,溶液未变红;再滴加氢水,溶液变红,说明铁粉全部变质
设计实验鉴别补铁药片中含有的是亚铁盐还是铁盐?
1.鉴别补铁药品是Fe2+还是Fe3+ ?
2.完成课本69页的思考与讨论,并写出化学方程式,与同学讨论交流。
相关课件
这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物公开课课件ppt,共38页。PPT课件主要包含了铁的钝化应用等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第一节 铁及其化合物评优课ppt课件,共24页。PPT课件主要包含了铁的氧化物,铁的氢氧化物,本节重难点,红砖青砖知多少,FeO,Fe2O3,Fe3O4,黑色粉末,红棕色粉末,均不溶于水等内容,欢迎下载使用。
这是一份第7讲 铁及其重要化合物,共60页。PPT课件主要包含了考点一,考点二,考点三,Fe2O3,Fe3O4,FeCO3,FeS2,磁性氧化铁,红棕色,白色固体等内容,欢迎下载使用。










