
备战2025年高考化学考点一遍过考点11离子能否大量共存的判断教案(Word版附解析)
展开
这是一份备战2025年高考化学考点一遍过考点11离子能否大量共存的判断教案(Word版附解析),共14页。教案主要包含了离子共存的判断方法等内容,欢迎下载使用。
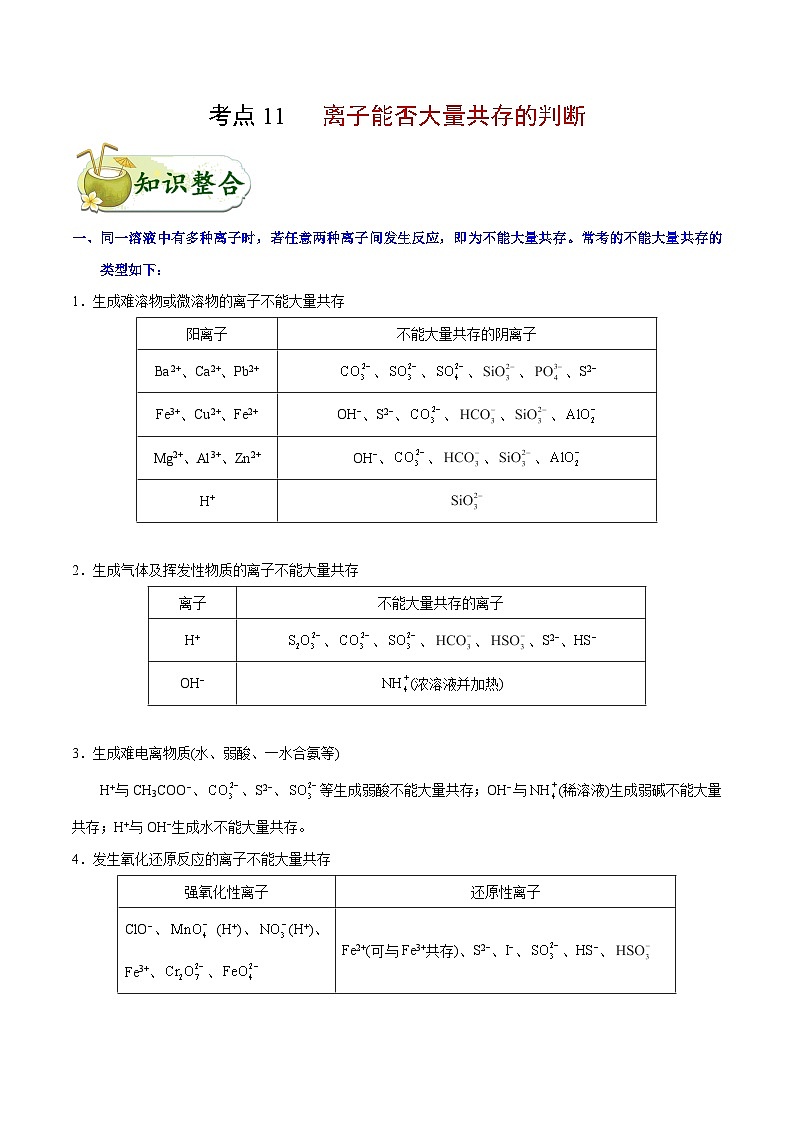
一、同一溶液中有多种离子时,若任意两种离子间发生反应,即为不能大量共存。常考的不能大量共存的类型如下:
1.生成难溶物或微溶物的离子不能大量共存
2.生成气体及挥发性物质的离子不能大量共存
3.生成难电离物质(水、弱酸、一水合氨等)
H+与CH3COO−、、S2−、等生成弱酸不能大量共存;OH−与(稀溶液)生成弱碱不能大量共存;H+与OH−生成水不能大量共存。
4.发生氧化还原反应的离子不能大量共存
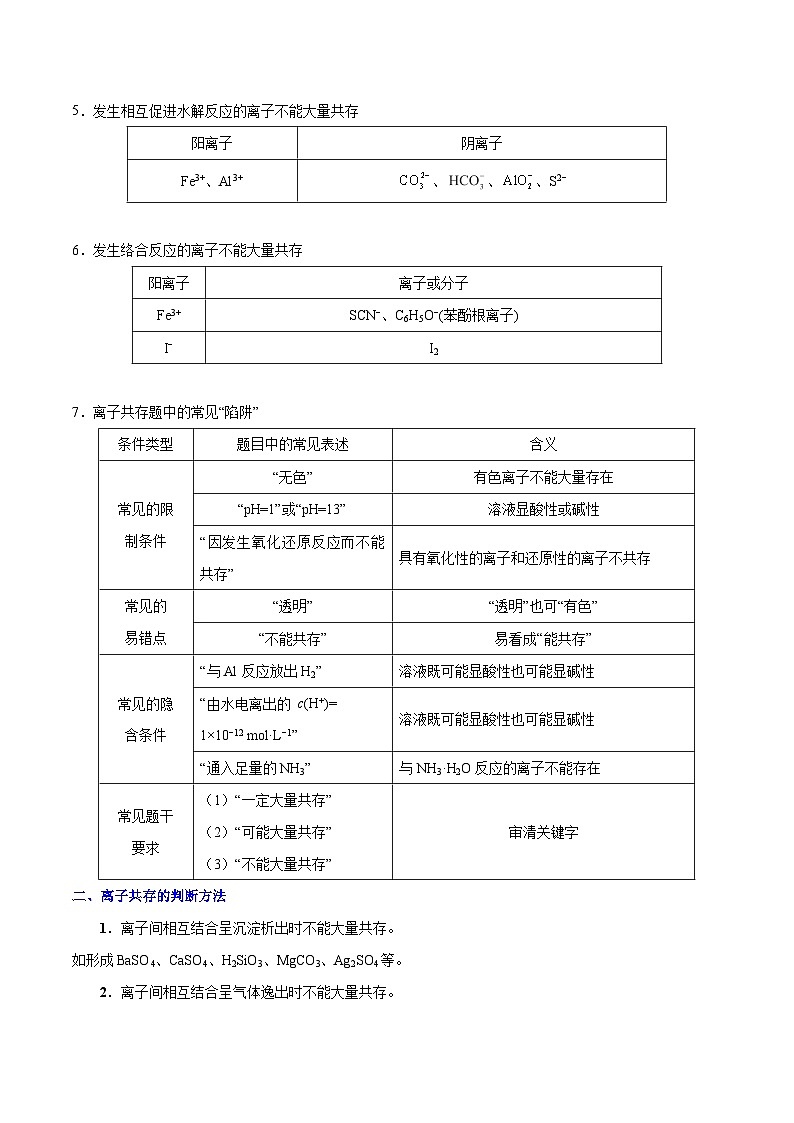
5.发生相互促进水解反应的离子不能大量共存
6.发生络合反应的离子不能大量共存
7.离子共存题中的常见“陷阱”
二、离子共存的判断方法
1.离子间相互结合呈沉淀析出时不能大量共存。
如形成BaSO4、CaSO4、H2SiO3、MgCO3、Ag2SO4等。
2.离子间相互结合呈气体逸出时不能大量共存。
如H+与S2−、HS−、、、、,OH−与等。
3.离子间相互结合成弱电解质时不能大量共存。
如H+与CH3COO−、OH−、ClO−、F−、、、。
4.离子间发生双水解反应析出沉淀或逸出气体时不能大量共存。
如Al3+ 分别与、、、、、C6H5O−;Al3+与S2−、HS−等。
5.离子间发生氧化还原反应时不能大量共存。
如:、ClO−、Fe3+分别与I−、S2−、等。
6.在酸性介质中由于发生氧化还原反应而不能大量共存。
如和I−、S2−、、Fe2+在中性或碱性溶液中可以共存,但在有大量H+存在的情况下则不能共存。
7.离子间相互结合成络合离子时不能大量共存。
如Fe3+与SCN−络合,Ag+、、OH−生成[Ag(NH3)2]+,Fe3+与C6H5O− (H+)也络合等。
8.注意题目的前提设置。
颜色:Cu2+、Fe3+、Fe2+、等有颜色;
酸碱性:直接/间接——指示剂的颜色,水电离出H+或OH−,与Al反应产生H2等。
考向一 无限制条件的离子共存的判断
典例1 水溶液中能大量共存的一组离子是
A.、Ba2+、Br-、
B.Cl-、、Fe2+、H+
C.K+、Na+、、
D.Na+、H+、、
【解析】A.Ba2+与能反应生成BaCO3沉淀,不能大量共存。B. 与H+能反应生成SO2和H2O,与Fe2+能生成沉淀FeSO3,不能大量共存。C.离子之间不反应,可以大量共存。D.H+与能反应生成CO2和H2O,不能大量共存。
【答案】C
1.水溶液中能大量共存的一组离子是
A.Na+、Ca2+、Cl-、
B.Fe2+、H+、、ClO-
C.Mg2+、、Cl-、
D.K+、Fe3+、、SCN-
练 后 归 纳
判断多种离子能否大量共存于同一溶液中,归纳起来就是:一色、二性、三特殊、四反应。
1.一色——溶液颜色
2.二性——溶液的酸碱性
(1)在强酸性溶液中,OH-及弱酸根阴离子(如COeq \\al(2—,3) 、SOeq \\al(2—,3) 、S2-、CH3COO-等)均不能大量存在;
(2)在强碱性溶液中,H+及弱碱阳离子(如NHeq \\al(+,4)、Al3+、Fe3+等)均不能大量存在;
(3)酸式弱酸根离子(HCOeq \\al(-,3)、HSOeq \\al(-,3)、HS-等)在强酸性或强碱性溶液中均不能大量存在。
3.三特殊——三种特殊情况
(1) AlOeq \\al(-,2)与HCOeq \\al(-,3)不能大量共存: AlOeq \\al(-,2)+HCOeq \\al(-,3)+H2O===Al(OH)3↓+COeq \\al(2-,3);
(2)“NOeq \\al(-,3)+H+”组合具有强氧化性,能与S2-、Fe2+、I-、SOeq \\al(2-,3) 等还原性的离子因发生氧化还原反应而不能大量共存;
(3) NHeq \\al(+,4)与CH3COO-、COeq \\al(2-,3),Mg2+与HCOeq \\al(-,3)等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中能大量共存。
4.四反应——四种反应类型
指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。
(1)复分解反应:如Ba2+与COeq \\al(2-,3)、SOeq \\al(2—,4),NHeq \\al(+,4)与OH-,H+与CH3COO-等。
(2)氧化还原反应:如Fe3+与I-、S2-,NOeq \\al(-,3)(H+)与Fe2+,MnOeq \\al(-,4)(H+)与SOeq \\al(2-,3)、Cl-等。
(3)相互促进的水解反应:如Al3+与COeq \\al(2-,3)、HCOeq \\al(-,3)、S2-、HS-、AlOeq \\al(-,2)等。
(4)络合反应:如Fe3+与SCN-等。
考向二 有限制条件的离子大量共存的判断
典例1 在c(Ca2+)=0.1 ml·L-1的新制漂白粉的溶液中,下列各组离子能大量共存的是
A.Na+、K+、COeq \\al(2-,3)、NOeq \\al(-,3)
B.Na+、K+、SOeq \\al(2-,3)、OH-
C.K+、Na+、NOeq \\al(-,3)、CH3COO-
D.H+、NHeq \\al(+,4)、NOeq \\al(-,3)、SOeq \\al(2-,4)
【解析】在c(Ca2+)=0.1 ml·L-1的新制漂白粉的溶液中含有大量的Cl-和ClO-。Ca2+与COeq \\al(2-,3)能够反应生成CaCO3沉淀,不能大量共存,A项错误;ClO-能够将SOeq \\al(2-,3)氧化,不能大量共存,B项错误;K+、Na+、NOeq \\al(-,3)、CH3COO-与Ca2+、Cl-和ClO-都不反应,能够大量共存,C项正确:Ca2+与SOeq \\al(2-,4)能够反应生成硫酸钙沉淀,不能大量共存,D项错误。
【答案】C
2.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1 ml·L-1KNO3溶液:H+、Fe2+、Cl-、
B.甲基橙呈红色的溶液: 、Ba2+、、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:K+、Na+、、
易错警示
易错点 忽视题目中的限制条件导致判断离子共存失误
易错点击:(1)易忽视无色溶液和有色离子的不匹配。常见的有色离子有Fe2+、Fe3+、Cu2+、等,均不能存在于无色溶液中。
(2)易忽视溶液中隐含的酸碱性。如pH=1的溶液隐含着溶液具有强酸性这一条件,不能大量存在、、、S2-、等弱酸根离子。由水电离出的H+浓度为1×10-12 ml·L-1,则隐含着该溶液具有强酸性或强碱性这一条件,不能大量存在能与H+或OH-反应的离子。与Al反应放出H2,隐含着溶液具有酸性或碱性这一条件,不能大量存在能与H+或OH-反应的离子。
(3)易忽视溶液中氧化性离子与还原性离子不能大量共存。如在pH=1的溶液中含有大量,由于在酸性溶液中具有强氧化性,则Fe2+等还原性离子不能存在。
(4)易忽视“水解相互促进”与“大量共存”的关系而作出错误的判断。能水解的阴离子与能水解的阳离子,即:能发生水解相互促进反应的离子,一般不能同时存在于同一溶液中,如Al3+和(或、S2-、HS-、)、Fe3+和(或、)等。
1.在pH=1的无色透明溶液中,能大量共存的离子组是
A.Al3+、Ag+、、
B.Mg2+、、、Cl-
C.Cu2+、Cl-、、Cl-
D.K+、Na+、ClO-、S2-
2.25 ℃时,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 ml·L-1 Ca(NO3)2溶液中:Na+、NHeq \\al(+,4)、COeq \\al(2-,3)、CH3COO-
B.能使甲基橙变红的溶液中:K+、Na+、NOeq \\al(-,3)、Cl-
C.3%H2O2溶液中:Fe2+、H+、SOeq \\al(2-,4)、Cl-
D.0.1 ml·L-1 KSCN溶液中:Fe3+、NHeq \\al(+,4)、Br-、SOeq \\al(2-,4)
3.下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、
D.中性溶液中可能大量存在Fe3+、K+、Cl-、
4.下列各组离子不是因发生氧化还原反应不能大量共存的是
A.pH=12的溶液:Ba2+、Na+、OH-、SOeq \\al(2-,4)
B.pH=1的溶液:Na+、K+、S2-、SOeq \\al(2-,3)
C.滴入酚酞变红的溶液:Na+、Cl-、ClO-、I-
D.滴入甲基橙变红的溶液:Na+、K+、S2Oeq \\al(2-,3)、I-
5.下列离子组在指定的反应体系中能大量存在的是
6.在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是
A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+
B.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+
C.在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3
D.在含等物质的量的、OH-、溶液中逐滴加入盐酸:、Al(OH)3、OH-、
7.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列有关离子共存说法中正确的是
A.a点对应的溶液中大量存在:Fe3+、Na+、SCN-、SOeq \\al(2-,4)
B.b点对应的溶液中大量存在:Na+、Fe3+、HCOeq \\al(-,3)、I-
C.c点对应的溶液中大量存在:Na+、Ca2+、Cl-、COeq \\al(2-,3)
D.d点对应的溶液中大量存在:Na+、K+、SOeq \\al(2-,3)、Cl-
8.下列各组离子能大量共存且满足相应要求的是
9.向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如下图所示。则下列离子组在对应的溶液中一定能大量共存的是
A.a点对应溶液中:Ca2+、Mg2+、Br-、
B.b点对应溶液中:Al3+、Fe3+、、
C.c点对应溶液中:Na+、Ca2+、、Cl-
D.d点对应溶液中:F-、、Fe2+、Ag+
1.[2019江苏] 室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 ml·L−1NaOH溶液:Na+、K+、、
B.0.1 ml·L−1FeCl2溶液:K+、Mg2+、、
C.0.1 ml·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH−
D.0.1 ml·L−1H2SO4溶液:K+、、、
2.[2018江苏卷]室温下,下列各组离子在指定溶液中能大量共存的是
A. 0. 1 ml·L−1KI 溶液:Na+、K+、ClO− 、OH−
B. 0. 1 ml·L−1Fe2(SO4)3溶液:Cu2+、NH4+ 、NO3−、SO42−
C. 0. 1 ml·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3−
D. 0. 1 ml·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3−
3.[2017江苏卷]常温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B.=1×10 −12的溶液中:K+、Na +、、
C.c(Fe2+) =1 ml·L−1的溶液中:K+、、、
D.能使甲基橙变红的溶液中:Na+、、、
4.[2016·四川]下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl−、
B.pH=2的溶液中可能大量存在Na+、、
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+===2Fe3++2H2O
D.稀硫酸和Ba(OH)2溶液反应:H+++Ba2++OH−===BaSO4↓+H2O
5.[2016·江苏]制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH
相关教案
这是一份备战2025年高考化学考点一遍过考点07突破NA教案(Word版附解析),共19页。教案主要包含了以物质的量为核心的转换与计算,以物质的结构为依据求共价键数目,反应程度对粒子数目计算的影响等内容,欢迎下载使用。
这是一份备战2025年高考化学考点一遍过考点10离子反应与离子方程式教案(Word版附解析),共18页。教案主要包含了离子反应的类型和发生条件,离子方程式的概念与意义,离子方程式的书写等内容,欢迎下载使用。
这是一份备战2025年高考化学考点一遍过考点12离子的检验与推断教案(Word版附解析),共21页。教案主要包含了离子的检验,离子的推断等内容,欢迎下载使用。








