

辽宁省沈阳市东北育才学校2024-2025学年高三上学期期中联合考试化学试题(Word版附答案)
展开
这是一份辽宁省沈阳市东北育才学校2024-2025学年高三上学期期中联合考试化学试题(Word版附答案),共10页。试卷主要包含了5NA,60 g,色谱检测纯度为98,5%等内容,欢迎下载使用。
时间:75min 满分:100分 命题人:孙钢 校对人:郭玲
H-1 C-12 O-16 Mg-24 Al-27 S-32 Cl-35.5 Ca-40 V-51 Cu-64
一、单选题(每题3分,共45分)
1.对下列文物的说法错误的是
A.青铜铺首主要成分是铜锡合金B.透雕白玉璧主要成分是硅酸盐
C.石质浮雕主要成分是碳酸钙 D.青花釉里红瓷盖罐主要成分是硫酸钙
2.超氧化钾可用作潜水或宇航装置的CO2吸收剂和供氧剂,反应为4KO2+2CO2=2K2CO3+3O2,NA为阿伏加德罗常数的值。下列说法正确的是
A.44gCO2中σ键的数目为2NA
B.1mlKO2晶体中离子的数目为3NA
C.1L1ml/LK2CO3溶液中CO32-的数目为NA
D.该反应中每转移1ml电子生成O2的数目为1.5NA
3.ClO2可用于处理含CN-的污水,2ClO2+2CN-=2CO2+N2+2Cl-。下列说法正确的是
A.该反应中ClO2被氧化
B.生成物中有一种既非氧化产物,也非还原产物
C.由该反应可判断还原性强弱:CN-<Cl-
D.如下方程式可表示反应中电子转移情况:
4.下列说法不正确的是
A.Al(OH)3呈两性,但能用于治疗胃酸过多
B.元素分为金属元素和非金属元素两类
C.FeO有还原性,能被氧化成 Fe3O4
D.HNO3见光易分解,应保存在棕色试剂瓶中
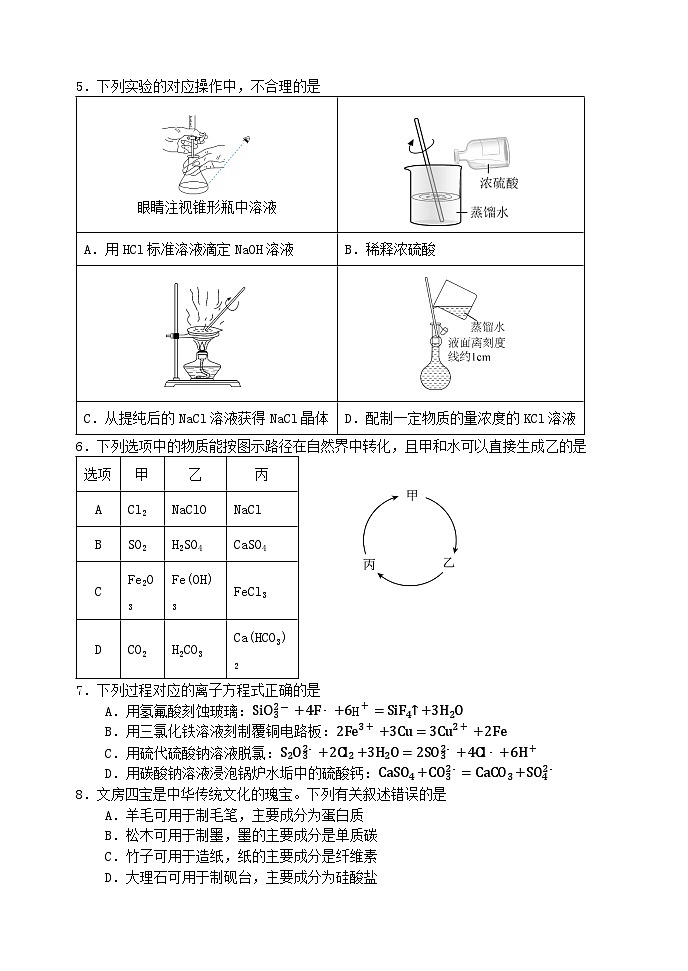
5.下列实验的对应操作中,不合理的是
6.下列选项中的物质能按图示路径在自然界中转化,且甲和水可以直接生成乙的是
7.下列过程对应的离子方程式正确的是
A.用氢氟酸刻蚀玻璃:SiO32-+4F-+6H+=SiF4↑+3H2O
B.用三氯化铁溶液刻制覆铜电路板:2Fe3++3Cu=3Cu2++2Fe
C.用硫代硫酸钠溶液脱氯:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
D.用碳酸钠溶液浸泡锅炉水垢中的硫酸钙:CaSO4+CO32-=CaCO3+SO42-
8.文房四宝是中华传统文化的瑰宝。下列有关叙述错误的是
A.羊毛可用于制毛笔,主要成分为蛋白质
B.松木可用于制墨,墨的主要成分是单质碳
C.竹子可用于造纸,纸的主要成分是纤维素
D.大理石可用于制砚台,主要成分为硅酸盐
9.为从粗食盐水中除去Mg2+、Ca2+、SO42-等离子,以制得精盐水。某同学设计如下方案:
下列说法正确的是( )
A.X中主要有Mg(OH)2和BaSO4,也可能有少量Ca(OH)2
B.②中加入过量Na2CO3溶液的主要目的是除去Mg2+、Ca2+
C.若将①、②步试剂颠倒,也能达到实验目的
D.③中发生的反应只有2H++Ca2++CO32-=CO2↑+H2O
10.设NA为阿伏加德罗常数的值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是( )
A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1 ml Pt2O+转化为Pt2O2+所得电子数为3NA
C.将生成的CO2通入少量的饱和Na2CO3溶液中,无明显现象
D.1 g CO2、N2O的混合气体中含有电子数为0.5NA
11.下列说法不正确的是
A.装置①可用于铜与浓硫酸反应并检验气态产物
B.图②标识表示易燃类物质
C.装置③可用于制取并收集氨气
D.装置④可用于从碘水中萃取碘
12.四瓶无色溶液NH4Cl,Na2CO3,Ba(OH)2,AlCl3,它们之间的反应关系如图所示。其中a、b、c、d代表四种溶液,e和g为无色气体,f为白色沉淀。下列叙述正确的是
A.a呈弱碱性
B.f可溶于过量的b中
C.c中通入过量的e可得到无色溶液
D.b和d反应生成的沉淀不溶于稀硝酸
13.工业生产制取硫酸的原理示意图如下,下列说法不正确的是
A.I的化学方程式:3FeS2+8O2≜Fe3O4+6SO2
B.Ⅱ中的反应条件都是为了提高SO2平衡转化率
C.将黄铁和换成硫黄可以减少废渣的产生
D.生产过程中产生的尾气可用碱液吸收
14.仅用下表提供的试剂和用品,不能实现相应实验目的的是
15.已知:用NH4Cl固体与Ca(OH)2固体加热制取NH3。实验室欲利用如图所示装置模拟“侯氏制碱法”制取纯碱(部分夹持装置省略),下列叙述正确的是( )
A.实验时应先打开装置③中分液漏斗的旋塞,过一段时间后再点燃装置①的酒精灯
B.装置②的干燥管中可盛放碱石灰,作用是吸收多余的NH3
C.向步骤Ⅰ所得滤液中通入氨气,加入细小的食盐颗粒并降温可析出NH4Cl
D.用装置④可实现步骤Ⅱ转化,所得CO2可循环使用
二、填空题(55分)
16(12分).硫、氮元素是重要的非金属元素,其价-类二维图如下图所示。
(1)工业上吸收b制c所用的吸收试剂是 。
(2)除去试管内壁附着的S,洗涤试剂为 。
(3)将过量的a气体通入下列溶液中,几乎无现象的是_____(填标号)。
A.KMnO4溶液 B.CaCl2稀溶液C.H2O2溶液D.品红溶液
(4)常温下,c的浓溶液可储存在铁罐中,其原因是 。
(5)反应③的离子方程式为 。
(6)上图中属于氮的固定的过程是____________
17(13分).V2O5是制造钒铁合金、金属钒的原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石煤中提取V2O5的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下。
已知:Ⅰ 石煤是一种含V2O3的矿物,杂质为大量Al2O3和少量CaO等;苛化泥的主要成分为CaCO3、NaOH、Na2CO3等。
Ⅱ 室温下,偏钒酸钙[Ca(VO3)2]和偏铝酸钙均难溶于水。
回答下列问题:
(1)钒原子的价层电子排布式为_________________;焙烧生成的偏钒酸盐中钒的化合价为_________,产生的气体①为_____________(填化学式)。
(2)水浸工序得到滤渣①和滤液,滤渣①中含钒成分为偏钒酸钙,滤液中杂质的主要成分为_____________(填化学式)。
(3)碱性环境下,偏钒酸钙经盐浸生成碳酸钙发生反应的离子方程式为___________________________________________________________________;
CO2加压导入盐浸工序可提高浸出率的原因为_____________________________;浸取后低浓度的滤液①进入_________________(填工序名称),可实现钒元素的充分利用。
(4)洗脱工序中洗脱液的主要成分为___________________(填化学式)。
18(14分). 某实验小组为实现乙酸乙酯的绿色制备及反应过程可视化,设计实验方案如下:
I.向50 mL烧瓶中分别加入5.7 mL乙酸(100 mml)、8.8 mL乙醇(150 mml)、1.4 g NaHSO4固体及4~6滴1‰甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
II.加热回流50min后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
III.冷却后,向烧瓶中缓慢加入饱和Na2CO3溶液至无CO2逸出,分离出有机相。
IV.洗涤有机相后,加入无水MgSO4,过滤。
V.蒸馏滤液,收集73~78℃馏分,得无色液体6.60 g,色谱检测纯度为98.0%。
回答下列问题:
(1)NaHSO4在反应中起___________作用,用其代替浓H2SO4的优点是__________________________________________________________(答出一条即可)。
(2)甲基紫和变色硅胶的颜色变化均可指示反应进程。变色硅胶吸水,除指示反应进程外,还可________________________________________________________________。
(3)使用小孔冷凝柱承载,而不向反应液中直接加入变色硅胶的优点是__________(填标号)。
A. 无需分离 B. 增大该反应平衡常数
C. 起到沸石作用,防止暴沸 D. 不影响甲基紫指示反应进程
(4)下列仪器中,分离有机相和洗涤有机相时均需使用的是_______(填名称)。
(5)该实验乙酸乙酯的产率为_______(精确至0.1%)。
(6)若改用C2H518OH作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为_______(精确至1)。
19(16分).硼化钛(TiB2)强度高、硬度大,广泛应用于机械制造领域;五氟化锑(SbF5)是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含TiO2、Sb2O3、ZnO、PbO、NiO、CO)为原料制取硼化钛和五氟化锑的流程如图1所示。
已知:①TiO2性质较稳定,加热时可溶于浓硫酸中形成TiO2+;
②高温下B2O3易挥发;
③“热还原”步骤主要反应为TiO2+B2O3+5C高温TiB2+5CO↑;
④25℃时,ZnS、PbS的KSP分别为1.6×10-24、8.0×10-28。
(1)“水解”步骤中对应的离子方程式为 。为了使水解趋于完全,可采取的措施有 (填一条)。
(2)“热还原”步骤中使用石墨化炉高温加热装置(1500-2000℃),B2O3的实际用量超过理论化学计量所要求的量,原因是 。仅增大配料中B2O3的用量,产品中的杂质含量变化如图2所示。杂质TiC含量随w%(B2O3量相对理论化学计量过量百分比)增大而降低的原因可能是 (用化学方程式解释)。
(3)“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理如图3所示。C2+、Ni2+能发生上述转化而Zn2+不能,推测可能的原因为 。
(4)已知滤液Ⅰ中C(Zn2+)=0.01 ml⋅L-1,C(Pb2+)=0.001 ml⋅L-1。“除锌铅”步骤中,缓慢滴加稀Na2S溶液,先产生的沉淀是 (填化学式);当ZnS、PbS共沉时,先沉淀的物质 (填“已”“未”)沉淀完全(离子浓度
相关试卷
这是一份辽宁省沈阳市东北育才学校2024-2025学年高三上学期10月月考化学试题(含答案),共10页。试卷主要包含了5NA,60 g,色谱检测纯度为98,5%等内容,欢迎下载使用。
这是一份辽宁省沈阳市东北育才学校2024-2025学年高三上学期开学考试化学试题(无答案),共9页。试卷主要包含了单选题,主观题等内容,欢迎下载使用。
这是一份辽宁省沈阳市东北育才学校2024-2025学年高三上学期开学考试化学试题,共8页。








