






所属成套资源:(新高考版)2025年高考化学一轮复习课件(含解析)
2025年高考化学一轮复习课件(新高考版)大单元4 第11章 第48讲 影响化学平衡的因素
展开
这是一份2025年高考化学一轮复习课件(新高考版)大单元4 第11章 第48讲 影响化学平衡的因素,共60页。PPT课件主要包含了化学平衡的移动,练真题明考向,课时精练等内容,欢迎下载使用。
1.掌握外界条件改变对化学平衡的影响。2.掌握并会运用勒夏特列原理分析平衡的移动。3.掌握平衡移动与转化率的关系。
考点一 化学平衡的移动
考点二 平衡移动与平衡转化率的关系
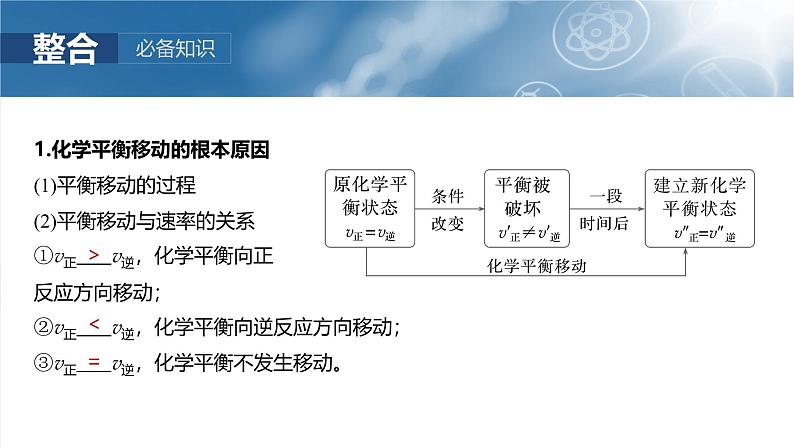
1.化学平衡移动的根本原因(1)平衡移动的过程(2)平衡移动与速率的关系①v正 v逆,化学平衡向正反应方向移动;②v正 v逆,化学平衡向逆反应方向移动;③v正 v逆,化学平衡不发生移动。
2.化学平衡移动的重要实验再现(1)探究浓度对化学平衡的影响实验一:Fe3++3SCN- Fe(SCN)3(红色),加入较浓的FeCl3溶液或KSCN溶液、少量铁粉、KCl固体,通过观察溶液红色的变化,分析平衡移动。
提示 ①加入较浓的FeCl3溶液或KSCN溶液,红色加深,平衡正向移动。②加入少量Fe粉,红色变浅,平衡逆向移动。③加入少量KCl固体,红色几乎不变,平衡不移动。
实验二: (橙色)+H2O (黄色)+2H+,滴加NaOH溶液或硫酸溶液,通过观察溶液颜色的变化,分析平衡移动。
提示 ①滴加NaOH溶液,溶液由橙色变为黄色,平衡正向移动。②滴加H2SO4溶液,溶液橙色加深,平衡逆向移动。
(2)探究压强对化学平衡的影响实验三:2NO2(红棕色) N2O4(无色)通过压缩体积观察颜色变化,分析平衡移动。
提示 气体的颜色先变深后变浅,最终还是比最初的颜色深。增大压强,平衡向生成N2O4的方向(气体体积减小的方向)移动。
(3)探究温度对化学平衡的影响实验四:[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(黄色)+4H2O ΔH>0。将分别盛有2 mL 0.5 ml·L-1 CuCl2溶液的两支试管,一支试管先加热,然后置于冷水中,与另一支试管进行对比。
在其他条件不变时,升高温度,平衡向正反应(吸热)方向移动
在其他条件不变时,降低温度,平衡向逆反应(放热)方向移动
思考 在对CuCl2溶液加热时,为何未看到溶液变为黄色?
答案 因为加热时,平衡正向移动,[Cu(H2O)4]2+有部分转化为[CuCl4]2-,[Cu(H2O)4]2+显蓝色,[CuCl4]2-显黄色,而二者的混合色为绿色,故看不到黄色。
3.化学平衡移动原理——勒夏特列原理如果改变影响平衡的一个因素(如浓度、压强或温度),平衡就向着能够 这种改变的方向移动,这就是勒夏特列原理,也称化学平衡移动原理。
1.外界条件对化学平衡的影响是通过改变正、逆反应速率来实现的,其移动方向取决于改变条件的瞬间v正和v逆的相对大小。试完成下表(说明:表中的压强的变化是指通过改变气体的体积实现的)。
一、外因对正逆反应速率与化学平衡移动的影响
向气体体积减小的方向移动
向气体体积增大的方向移动
2.将NO2装入带活塞的密闭容器中,当反应2NO2(g) N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是A.升高温度,气体颜色加深,则此反应为吸热反应B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍D.恒温恒压时,充入惰性气体,平衡向左移动,混合气体的颜色变深
升高温度,气体颜色加深,则平衡向左移动,该反应为放热反应,A错误;体积减小一半,根据勒夏特列原理,混合气体的颜色比原平衡深,压强小于原平衡的两倍,B错误,C正确;恒温恒压,充入惰性气体,容器体积扩大,平衡向气体分子数增大的方向(即生成NO2的方向)移动,但NO2气体的浓度最终变小,混合气体的颜色变浅,D错误。
惰性气体对化学平衡的影响
3.一定条件下,在密闭容器中发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·ml-1。(1)若在t0时刻只增大压强(缩小容器的体积),请在图1中作出v正、v逆的变化图像。
二、通过图像理解化学平衡移动
(2)请在图2中作出不同温度下(T2>T1)SO2的转化率随时间变化的示意图。
4.(2021·湖南,11改编)已知:A(g)+2B(g) 3C(g) ΔHp,A、B的转化率都_______,体积分数都_______;②m+n=p,A、B的转化率、体积分数都________;③m+nv逆,平衡向正反应方向移动,但是因为温度不变,故平衡常数不变,A不正确;催化剂不影响化学平衡状态,因此,加入催化剂不影响平衡时CH3CH2OH(g)的浓度,B不正确;恒容下,充入一定量的H2O(g),H2O(g)的浓度增大,平衡向正反应方向移动,C正确;恒容下,充入一定量的CH2==CH2(g),平衡向正反应方向移动,但是CH2==CH2(g)的平衡转化率减小,D不正确。
3.[2023·新课标卷,29(4)]在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如图所示。其中一种进料组成为 =0.75、 =0.25,另一种为 =0.675、 =0.225、xAr=0.10。(物质i的摩尔分数:xi= )
①图中压强由小到大的顺序为_____________,判断的依据是_______________________________________________________________________。
合成氨的反应为气体分子数减少的反应,压强越大平衡时氨的摩尔分数越大
合成氨的反应中,压强越大平衡时氨的摩尔分数越大。由图中信息可知,在相同温度下,反应达平衡时氨的摩尔分数:p1<p2<p3,因此,图中压强由小到大的顺序为p1<p2<p3。
②进料组成中含有惰性气体Ar的图是_______。
该反应为气体分子数减小的反应,在相同温度和相同压强下,惰性气体Ar不利于合成氨,进料组成中含有惰性气体Ar的图是图2。
1.下列不能用勒夏特列原理解释的事实是A.红棕色的NO2加压后颜色先变深后变浅B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深C.黄绿色的氯水光照后颜色变浅D.向含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡,溶液红色变浅或褪去
2.反应NH4HS(s) NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况不会使平衡发生移动的是A.温度、容积不变时,通入SO2气体B.移走一部分NH4HS固体C.容器体积不变,充入HCl气体D.保持压强不变,充入氮气
A项,2H2S+SO2===3S+2H2O,通入SO2气体使平衡正向移动;C项,NH3(g)+HCl(g)===NH4Cl(s),充入HCl气体使平衡正向移动;D项,保持压强不变,充入氮气,平衡向正反应方向移动。
3.(2020·浙江7月选考,20)一定条件下:2NO2(g) N2O4(g) ΔH<0。在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是A.温度0 ℃、压强50 kPaB.温度130 ℃、压强300 kPaC.温度25 ℃、压强100 kPaD.温度130 ℃、压强50 kPa
测定NO2的相对分子质量时,要使平衡逆向移动,且逆向移动的程度越大,测定结果的误差越小。该反应的正反应是气体分子数减少的放热反应,因此温度越高、压强越小时,平衡逆向移动的程度越大,故选D。
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙色B.该反应是氧化还原反应C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离 子浓度比原溶液大D.向体系中加入少量水,平衡逆向移动
向该溶液中加入过量浓NaOH溶液后,消耗氢离子,氢离子浓度减小,平衡正向移动,溶液呈黄色,A错误;反应前后元素的化合价均不发生变化,该反应不是氧化还原反应,B错误;向该溶液中滴加适量的浓硫酸,氢离子浓度增大,平衡向逆反应方向移动,由于只能是减弱这种改变,所以再次达到平衡后,氢离子浓度比原溶液大,C正确;向体系中加入少量水,相当于稀释,平衡正向移动,D错误。
5.(2023·广州实验中学模拟)常压下羰基化法精炼镍的原理为Ni(s)+4CO(g) Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。下列判断正确的是A.升高温度,该反应的平衡常数减小B.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)C.第一阶段,在30 ℃和50 ℃两者之间选择反应温度应选30 ℃D.第二阶段,Ni(CO)4分解率较低
升高体系温度,正、逆反应速率都增大,故A错误;
增大体系的压强,平衡逆移,N2O4的平衡转化率降低,故D错误。
A.在该温度下,保持容积固定不变,向容器内补充了B气体,则a<bB.若a=b,则该反应中可能使用了催化剂C.若其他条件不变,升高温度,则a<bD.若保持温度、压强不变,充入惰性气体,则a>b
A项,充入B气体相当于增大压强,B的体积分数增大,故a>b;B项,使用催化剂,平衡不移动,a=b;C项,升高温度,平衡正向移动,a>b;D项,相当于扩大容器容积,减小压强,平衡逆向移动,a<b。
8.在恒温恒压下,某一体积可变的密闭容器中发生反应:A(g)+B(g) 2C(g) ΔH<0,t1时达到平衡后,在t2时改变某一条件,其反应过程如图所示。下列说法正确的是A.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数:Ⅰ>ⅡB.t2时改变的条件是向密闭容器中加入物质CC.0~t2时,v正>v逆D.Ⅰ、Ⅱ两过程达到平衡时,平衡常数:K(Ⅰ)<K(Ⅱ)
反应速率与其物质的量浓度成正比,Ⅰ、Ⅱ达到平衡状态时逆反应速率相等,说明Ⅰ、Ⅱ达到平衡状态时各物质的物质的量浓度不变,则A的体积分数:Ⅰ=Ⅱ,故A错误;
向密闭容器中加物质C,逆反应速率瞬间增大,再次建立的平衡和原平衡相同,符合图像,故B正确;由题图可知,0~t1时,逆反应速率增大,说明平衡正向移动,即v正>v逆,t1~t2时,逆反应速率不变,说明处于平衡状态,即v正=v逆,故C错误;化学平衡常数只与温度有关,Ⅰ、Ⅱ温度相同,则其平衡常数相同,故D错误。
9.(2023·河北沧州高三联考)T ℃下,在恒压密闭容器中发生反应:S2Cl2(l,浅黄色)+Cl2(g) 2SCl2(l,红棕色) ΔH<0。已知S2Cl2分子中各原子均满足8电子稳定结构,下列说法正确的是A.当单位时间内断裂n ml S—S,同时有n ml Cl2被还原时,说明反应达到平衡状态B.平衡后,升高温度,容器体积减小C.平衡后,压缩容器体积,容器中黄绿色先变深后变浅,最终气体颜色和原来一样D.平衡后,增加S2Cl2 (l)的物质的量,平衡向正反应方向移动
11.如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡。下列说法不正确的是A.第一次平衡时,SO2的物质的量左室更多B.气体未反应前,左室压强和右室一样大C.第一次平衡时,左室内压强一定小于右室D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍多
两室中发生反应2SO2(g)+O2(g) 2SO3(g),若右室的容积与左室相等,左室和右室在相同条件下达到的平衡状态相同,含有的SO2物质的量相等,右室在此平衡状态时将体积缩小为原来的 ,压强增大,平衡向生成SO3的方向移动,SO2物质的量减少,则第一次平衡时,SO2的物质的量左室更多,A项正确;通入气体未反应前,左室气体总物质的量为4 ml,右室气体总物质的量为2 ml,左室容积为右室的两倍,温度相同,则左室压强和右室一样大,B项正确;左室从正反应开始建立平衡,左室平衡时压强小于左室起始压强,右室从逆反应开始建立平衡,右室平衡时压强大于右室起始压强,左室与右室起始压强相等,则第一次平衡时左室内压强一定小于右室,C项正确;
若在容积为2倍左室容积的容器中起始充4 ml SO2、2 ml O2,相同条件下达到平衡时SO2的物质的量为左室SO2物质的量的2倍,打开活塞相当于在容积为1.5倍左室容积的容器中起始充入2 ml SO2、1 ml O2、2 ml SO3(g)、1 ml Ar,相当于在容积为1.5倍左室容积的容器中起始充入4 ml SO2、2 ml O2、1 ml Ar,相对于2倍左室容积的容器缩小了体积,压强增大,平衡向正反应方向移动,SO2物质的量减小,即第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍要少,D项错误。
12.(2023·安徽蚌埠统考模拟)能源的合理开发和利用、低碳减排是人类正在努力解决的大问题。(1)在固相催化剂作用下CO2加氢合成甲烷过程中发生以下两个反应:主反应:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1=-156.9 kJ·ml-1副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.1 kJ·ml-1工业合成甲烷通常控制温度为500 ℃左右,其主要原因为__________________________________________________________________________________________________________________________。
温度低于500 ℃,反应速率小;温度高于500 ℃,对副反应影响较大,化学平衡向生成CO的方向移动程度增大,不利于甲烷的生成
①能表示此反应已经达到平衡的是____(填字母)。A.气体总体积保持不变B.混合气体的平均相对分子质量保持不变
该反应前后气体计量数不变,故气体体积也始终不变,混合气体的平均相对分子质量保持不变,不能证明反应达到平衡,A、B错误;
由图示信息可知,在 =1、T2 K下,NO的平衡转化率为40%,根据三段式分析可知, CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)起始/ml a a 0 0 0转化/ml 0.1a 0.4a 0.2a 0.1a 0.2a平衡/ml 0.9a 0.6a 0.2a 0.1a 0.2a
②T3____(填“>”或“0,反应趋势小,反应③ΔG0,不易自发,反应③ΔG
相关课件
这是一份新高考化学一轮复习课件第8章 第48讲 影响化学平衡的因素(含解析),共60页。PPT课件主要包含了化学平衡的移动,必备知识,关键能力,应用举例,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份(人教版)高考化学一轮复习讲义课件第11章第48讲 影响化学平衡的因素(含解析),共60页。PPT课件主要包含了化学平衡的移动,练真题明考向,课时精练等内容,欢迎下载使用。
这是一份大单元四 第十一章 第48讲 影响化学平衡的因素-2025年高考化学大一轮复习(人教版)【配套PPT课件】,共60页。PPT课件主要包含了化学平衡的移动,练真题明考向,课时精练等内容,欢迎下载使用。









