

河南省中州联盟2023-2024学年高二上学期期末考试 化学试题
展开
这是一份河南省中州联盟2023-2024学年高二上学期期末考试 化学试题,共11页。试卷主要包含了本试卷分选择题和非选择题两部分,答题前,考生务必用直径0,本卷命题范围,可能用到的相对原子质量,已知,化学与科技、生产、生活息息相关等内容,欢迎下载使用。
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:人教版选择性必修1,选择性必修2第一章。
5.可能用到的相对原子质量:H 1 C 12 N 14 O 16 23 P 31 S 32 35.5 56 64 207
一、选择题(本大题共15小题,每小题3分,共计45分。在每小题列出的四个选项中,只有一项是符合题目要求的)
1.基态原子的最外层电子排布式正确的是( )
A.B.C.D.
2.核素的研究对工、农业及科技发展至关重要。下列有关与电负性的比较正确的是( )
A.B.C.D.无法确定
3.常温下,在含有的溶液中不能大量共存的离子是( )
A.B.C.D.
4.下列基态原子的价层电子轨道为球形的是( )
A.CB.NC.OD.H
5.用与醋酸反应制取。下列有关说法错误的是( )
A.电离方程式:
B.酸性:
C.电离常数:
D.的电离常数:
6.已知:① ;② 。转化为的热量变化为( )
A.放出B.吸收C.放出D.吸收
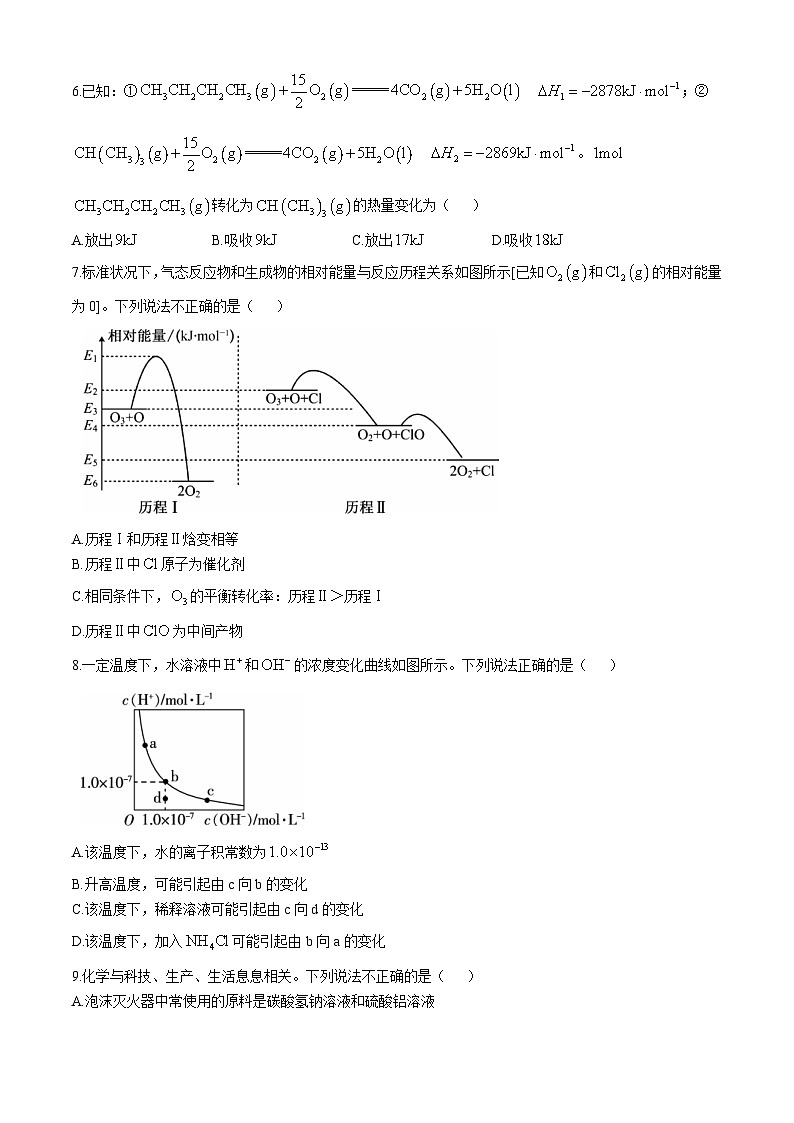
7.标准状况下,气态反应物和生成物的相对能量与反应历程关系如图所示[已知和的相对能量为0]。下列说法不正确的是( )
A.历程Ⅰ和历程Ⅱ焓变相等
B.历程Ⅱ中原子为催化剂
C.相同条件下,的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅱ中为中间产物
8.一定温度下,水溶液中和的浓度变化曲线如图所示。下列说法正确的是( )
A.该温度下,水的离子积常数为
B.升高温度,可能引起由c向b的变化
C.该温度下,稀释溶液可能引起由c向d的变化
D.该温度下,加入可能引起由b向a的变化
9.化学与科技、生产、生活息息相关。下列说法不正确的是( )
A.泡沫灭火器中常使用的原料是碳酸氢钠溶液和硫酸铝溶液
B.在电镀装置中,用镀层金属作阳极材料,也可用惰性电极材料作阳极材料
C.C919大飞机用到了铝锂合金,铝和锂的基态原子中未成对电子数相同
D.2023年杭州亚运会场馆使用了“碲化镉”光伏发电系统,将化学能转化为电能
10.新型电池工作原理如图所示,下列说法不正确的是( )
A.负极电极反应式为
B.M膜为阳离子交换膜、N膜为阴离子交换膜
C.电池工作一段时间后浓度将增大
D.外电路每转移电子,理论上增重
11.设为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下,的溶液中的数目为
B.常温下,1L溶液中氮原子数目为
C.的溶液含有的数目一定小于
D.粗铜精炼中阳极质量减小64g时,转移电子数目一定为
12.根据下列实验操作和现象所得到的结论正确的是( )
13.已知:化学反应的速率常数(A、R为常数,为自然对数的底,为活化能)。反应由如下步骤实现:Ⅰ.,Ⅱ.,反应的速率常数与温度的变化关系如图所示。下列说法正确的是( )
A.反应Ⅰ的活化能大于反应Ⅱ的
B.反应过程涉及两种中间体
C.升高温度,速率常数减小、增大
D.增大压强,反应Ⅰ和Ⅱ的化学平衡常数均增大
14.利用肼—空气燃料电池电解溶液的装置如图所示。下列说法正确的是( )
A.装置甲中负极反应式:
B.装置甲中离子交换膜为阳离子交换膜
C.一段时间后,装置甲中溶液的不变
D.标准状况下,当装置甲中有被还原时,装置乙阳极上放出2.24L气体
15.常温下,将溶液滴加到二元弱酸溶液中,混合溶液的与的关系如图所示。已知代表或,下列说法不正确的是( )
A.水的电离程度:
B.M代表随的变化曲线
C.滴定到b点时,溶液中
D.当刚好被中和时,溶液中
二、非选择题(本题共4小题,共55分)
16.(14分)如图为元素周期表的一部分,请参照元素①~⑧在元素周期表中的位置,回答下列问题:
(1)元素⑧在周期表中的位置是___________,其基态原子价层电子轨道表示式为____________,该元素对应基态原子具有数据___种能量不同的电子,具有_____种运动状态不同的电子。
(2)在空气中⑤和④组成的原子比为的化合物热稳定性小于的化合物,从电子排布的角度分析,其主要原因是_____。
(3)⑥元素位于元素周期表_____区,其基态正二价离子的电子排布式为__________。
(4)第四周期主族元素中,第一电离能介于⑦、⑧之间的元素有、_____(填元素符号)。
17.(14分)氧化钪可用于电子工业、激光及超导材料、合金添加剂等。以赤泥(含有、、、、等)为原料提取的工艺流程如图所示:
已知:①P204为二(2-乙基己基)磷酸酯,属于磷类萃取剂;
②TBP为中性磷类萃取剂;
③不与盐酸发生反应;
④,。
回答下列问题:
(1)提高“酸浸”效率,可采取的措施有_____(任写两条)。“酸浸”后得到的滤渣的成分是_____(填化学式)。
(2)图1、图2所示分别为“酸浸”时温度和“酸浸”时间对酸浸率的影响,根据图中信息确定最佳反应条件为_____;超过70℃,浸出率下降的主要原因是_____。
(3)常温下,进行“反萃取1”需调整反萃取液的,已知时沉淀完全,当恰好沉淀完全时,溶液的为__________(用代数式表示,不用化简)。写出“沉钪”过程中发生反应的离子方程式:_____。
(4)、水溶液经过“萃取”除铁后,将溶液蒸发结晶,煅烧,即可得到氧化铝。用惰性电极电解熔融氧化铝制取铝时,需要加入冰晶石,其目的是_____。
18.(13分)、是常见的化工原料,常用作还原剂。回答下列问题:
(1)25℃时,、、存在于和溶液反应后的溶液中,某微粒的物质的量分数与的关系如图所示。
①25℃时,_____。
②向溶液中通入,所得溶液中一定存在的等式是__________(用溶液中所含微粒的物质的量浓度表示)。
③若向溶液中通入制取溶液,则当溶液的为_____时应停止通入。
④溶液呈_____(填“酸”“碱”或“中”)性。
(2)固体久置后会被氧化,为测定某久置固体中的含量,现进行如下实验:称取该固体于锥形瓶中,加水溶解后,边振荡边向其中滴加的标准溶液,充分反应后,向溶液中滴加2滴淀粉溶液作指示剂,继续滴加标准溶液与过量的反应(发生反应),恰好完全反应时消耗标准溶液。
①达到滴定终点的操作及现象为_____。
②该样品中的纯度为________。
③下列情况会造成样品中含量测定结果偏高的是_____(填序号)。
A.滴定过程中用蒸馏水冲洗锥形瓶瓶壁
B.装标准溶液的滴定管水洗后未润洗
C.开始滴定时,滴定管尖嘴部分未充满液体
D.滴定前仰视读数,滴定后俯视读数
19.(14分)链烷烃来源于天然气、油田伴生气等,价格低廉,合理利用该资源开发化工产品具有十分重要的意义。回答下列问题:
(1)控制适当的反应条件,发生反应: 。实验测得;,其中、为速率常数。在两种压强(分别为、且)下,分别测得与平衡时的体积分数随温度的变化趋势如图1所示。
①平衡常数_____(用速率常数表示)。
②、、的相对大小关系是_____(用“>”或“=”连接)。
③线Ⅱ代表的物质是_____,线Ⅲ代表的物质是_____。
(2)若不加控制,除发生(1)中反应外,还会发生副反应:。℃时,向恒容密闭容器中投入发生反应,部分物质的物质的量浓度随时间变化如图2所示,平衡时总压强为。
①内,_____(保留三位有效数字,分压=总压物质的量分数);时,增大正丁烷浓度,的变化对应图2中线_____(填字母)。
②T℃时,反应用分压表示的平衡常数_____。
中州联盟2023~2024学年上学期期末考试・高二化学
参考答案、提示及评分细则
1.C 位于元素周期表第三周期第ⅦA族,最外层电子排布式为,C项正确。
2.A 同一周期的主族元素,从左至右电负性逐渐增强,A项正确。
3.C 与能相互促进水解发生双水解反应,不能共存,C项符合题意。
4.D H的价层电子排布式为,其轨道为球形,项正确。
5.A 向醋酸中加碳酸钠溶液观察到有气泡产生,说明有生成,。,,A项错误;根据强酸制弱酸的原理,说明醋酸的酸性强于碳酸,B项正确;电离平衡常数越大,酸性越强,C项正确;多元弱酸的第一步电离远大于第二步电离,D项正确。
6.A 根据盖斯定律:①-②得, ,A项正确。
7.C 由图可知,Cl原子是历程Ⅱ的催化剂,催化剂不能改变反应的反应热,则历程Ⅰ、Ⅱ的反应热相等,A项、B项正确;催化剂不能改变反应物的平衡转化率,即相同条件下的平衡转化率:历程Ⅱ=历程Ⅰ,C项错误;由图可知,D项正确。
8.D 由b点计算可得,A项错误;升高温度,增大,、均增大,将不在曲线上变化,B项错误;c点呈中性,稀释后仍呈中性,而d点呈碱性,C项错误;水解,溶液中增大,溶液显酸性,D项正确。
9.D 泡沫灭火器中常使用的原料是碳酸氢钠溶液和硫酸铝溶液,A项正确;在电镀装置中,用镀层金属作阳极材料,也可用惰性电极材料作阳极材料,电解质中含有镀层金属离子,B项正确;大飞机C919用到了铝锂合金,铝和锂的基态原子价层电子排布式分别为和,未成对电子数相同,均为1,C项正确;光伏发电系统是将太阳能转化为电能,D项错误。
10.D 由题图可知,电极为负极,电极反应式为,A项正确;为了维持溶液呈电中性,应通过M膜进入到之间,因此M膜为阳离子交换膜;应通过N膜进入到之间,因此N膜为阴离子交换膜;电池工作一段时间后,浓度将增大,B项、C项正确;为正极,电极反应式为,外电路每转移电子,理论上增重,D项错误。
11.B 在溶液中水解使溶液呈酸性,常温下的溶液中,,的数目为,A项错误;1个中含有2个氮原子,由元素质量守恒可知,溶液中氮原子数为,B项正确;缺溶液的体积,无法计算的溶液中的数目,C项错误;粗铜精炼时,阳极中锌、铁、铜均失去电子转化为金属阳离子,则无法计算阳极质量减小64g时铜放电的物质的量和反应转移的电子数目,D项错误。
12.A 计测定相同浓度的溶液和溶液的,前者的小于后者的,可知次氯酸根离子的水解程度大,的酸性弱,则的酸性弱于,A项正确;亚铁离子、氯离子均可被酸性高锰酸钾溶液氧化,溶液褪色,不能证明有还原性,B项错误;硫酸为二元酸,硝酸为一元酸,由等浓度酸溶液的不能比较S、N的非金属性强弱,C项错误;溶液过量,分别与、溶液反应生成沉淀,由实验操作和现象不能比较、的大小,D项错误。
13.A 由化学反应速率常数公式知,步骤Ⅰ反应的活化能大于步骤Ⅱ的,A项正确;反应过程只涉及Q一种中间体,B项错误;升高温度,速率常数、均增大,C项错误;压强不影响化学平衡常数,D项错误。
14.D 左图为燃料电池,负极失电子生成和,负极反应式为,A项错误;正极生成氢氧根离子、负极消耗氢氧根离子,所以图中离子交换膜为阴离子交换膜,B项错误;左图总反应为,有水生成,一段时间后,左图中电解质溶液的减小,C项错误;标况下,当左图中有被还原时,电路中转移电子,右图阳极上氢氧根离子放电生成氧气,,根据电子守恒,放出氧气,标准状况下的体积为,D项正确。
15.B 溶液的,溶液的酸性越强对水的电离抑制程度越大,所以水的电离程度,A项正确;,,由可知,相同时,即相同,则,故其负对数前者小于后者,即M代表随的变化曲线,B项错误;b点时,,溶液显酸性,即,结合电荷守恒:得,即,C项正确;当刚好被中和时,溶质为,由质子守恒可知,溶液中,D项正确。
16.(1)第四周期第ⅤA族(2分);(2分);8(1分);33(1分)
(2)基态价层电子排布式为,而基态的价层电子排布式为,为半充满稳定结构,故的热稳定性小于(2分)
(3)ds;或(各2分)
(4)、(2分)
17.(1)适当加热、搅拌(或其他合理答案);、
(2)70℃、2h;盐酸受热易挥发
(3);
(4)作助熔剂,降低氧化铝的熔点(每空2分)
18.(1)①(1分)②(2分)③5(2分)④酸(2分)
(2)①当滴入最后半滴硫代硫酸钠溶液时,溶液由蓝色变为无色,且半分钟内不恢复原色,说明达到滴定终点(2分)②84%(2分)③D(2分)
19.(1)①②③正丁烷(或);丙烯(或)(物质名称或结构简式均可)
(2)①1.17p;b②3p(每空2分)
选项
实验操作和现象
结论
A
用计测定相同浓度的溶液和溶液的,前者的小于后者的
的酸性弱于
B
向较浓的溶液中滴入少量酸性溶液,观察溶液紫色褪去
证明有还原性
C
常温下测得的溶液和的溶液的分别为0.7和1.0
硫元素的非金属性强于氮元素的
D
向溶液中加入溶液,产生白色沉淀;再加入溶液,产生红褐色沉淀
大于
相关试卷
这是一份河南省部分学校2023-2024学年高二上学期期末考试化学试题,共8页。
这是一份河南省顶尖联盟2023-2024学年高二上学期期中检测化学试题(含答案),共14页。试卷主要包含了5ml混合后反应生成的分子数为等内容,欢迎下载使用。
这是一份河南省顶尖联盟2023-2024学年高二上学期期中检测化学试题(PDF版含答案),文件包含25届高二化学上学期pdf、化学高二鲁科版答案简易pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。









