




第04讲 晶体结构与性质(课件)-2025年高考化学一轮复习讲练测(新教材新高考)
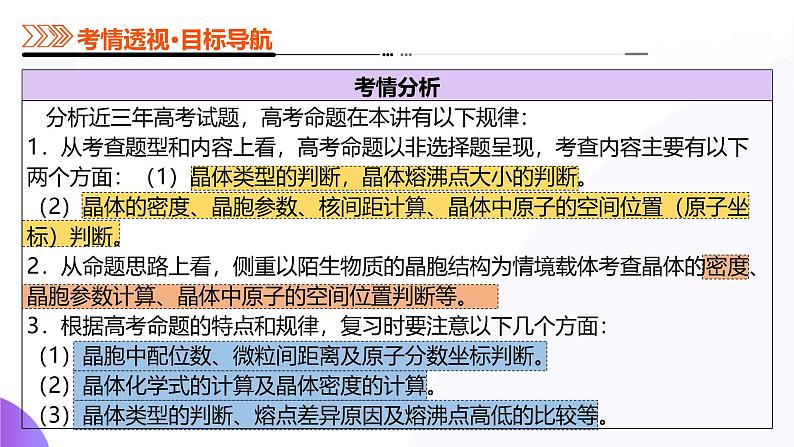
展开考向1 考察常见晶体的比较与晶体类型的判断
考向2 考察晶体熔沸点高低的比较
考向1 考察晶体与非晶体
考向2 考察有关晶胞的计算
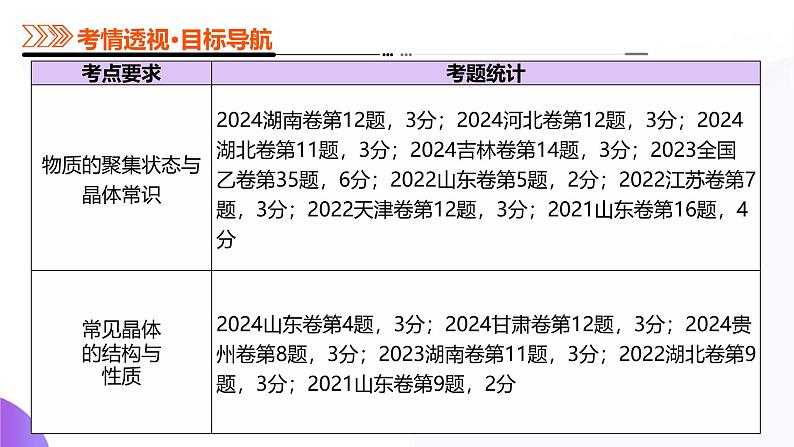
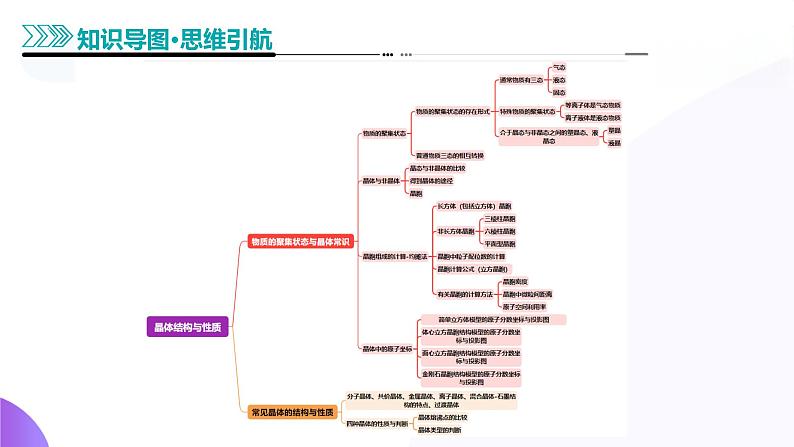
物质的聚集状态与晶体常识
1.物质的聚集状态的存在形式
(1)通常物质有三态:____态、____态和____态。
(2)特殊物质的聚集状态:等离子体是______物质,离子液体是______物质。
(3)更多的物质聚集状态:晶态、非晶态,______态、______态等。
2.普通物质三态的相互转化
知识点1 物质的聚集状态
注:普通物质三态间的相互转化只是分子间距离发生了变化,分子在固态只能振动,在气态能自由移动,而液态则介于二者之间。
3.气态①普通气体②等离子体:
A.定义:等离子体是由电子、阳离子和电中性粒子(分子或原子)组成的整体 上呈电中性的气态物质。B.产生途径:高温、紫外线、x射线、y射线、高能电磁波的照射及大自然的天体现象等都能使气体变成等离子体。
C.存在:存在于日光灯和霓虹灯的灯管里、蜡烛火焰里、极光和雷电里等。D.性质:具有良好的导电性和流动性。E.应用:等离子体显示技术可以制造等离子体显示器,利用等离子体可以进行化学合成、核聚变等。
4.液态①普通液体②离子液体:
A.定义:在室温或室温附近温度下呈液态的由离子构成的物质,称为室温离子液体,也称为低温熔融盐。
B.组成:(低温熔融盐)一般由有机阳离子和无机或有机阴离子构成,常见的阳离子有季铵盐离子、季鏻盐离子、咪唑盐离子和吡咯盐离子等(如图所示),阴离子有卤素离子、四氟硼酸根离子、六氟磷酸根离子等。
5.介乎晶态和非晶态之间的塑晶态、液晶态①塑晶:在一定温度条件下,能保持固态晶体__________但具有一定______(即物体发生永久形变的性质)的一种物质聚集状态。②液晶:
A.定义:在由固态向液态转化过程中存在的取向________流体状态。B.分类:分为_______液晶(只存在于某一温度范围内的液晶相)和_______液晶(某些化合物溶解于水或有机溶剂后而呈现的液晶相)。C.性质:具有液体的某些性质(如流动性、黏度、形变性等)和晶体的某些性质(如导热性、各向异性等)。D.用途:手机、电脑和电视的液晶显示器,合成高强度液晶纤维已广泛用于飞机、火箭、坦克、舰船、防弹衣、防弹头盔等。
6.固态①晶体:内部粒子(原子、离子或分子)在三维空间按一定规律呈________________构成的固体物质,绝大多数常见的固体都是晶体。如:高锰酸钾、金刚石、干冰、金属铜、石墨等。②非晶体:内部原子或分子的排列呈________________状态的固体物质。如:玻璃、松香、硅藻土、橡胶、沥青等。
(1)构成物质三态的粒子不一定都是______,还可以是______或______等,如水的三态都是由分子构成的,离子液体是熔点不高的仅由离子组成的液体物质。
(2)物质的聚集状态除了____态、____态和____态,还有____态、______态,以及介于晶态和非晶态之间的______态、______态等。
知识点2 晶体与非晶体
1.晶体与非晶体的比较
2.得到晶体的途径①________物质凝固。②______物质冷却不经______直接凝固(凝华)。注:升华与凝华:______物质受热不经过______直接到气态的过程叫做升华;_____物质冷却不经过______直接到固态的过程叫做凝华。升华和凝华都属于______变化。③溶质从溶液中______。
A.无隙:相邻晶胞之间没有任何间隙。B.并置:所有晶胞平行排列、取向相同。
①长方体(包括立方体)晶胞中不同位置的粒子数的计算。
②非长方体晶胞中粒子视具体情况而定
3.晶胞中粒子配位数的计算一个粒子周围________的粒子的数目称为配位数
(1)晶体中原子(或分子)的配位数:若晶体中的微粒为同种原子或同种分子,则某原子(或分子)的配位数指的是该原子(或分子)________________的原子(或分子)的数目。
(2)离子晶体的配位数:指一个离子周围________________的______电性离子的数目。
每个面上有4个,共计12个。
4.晶胞计算公式(立方晶胞)
5.有关晶胞的计算方法
(1)计算晶体密度的方法
一个晶胞所含的粒子数目n
(2)计算晶体中微粒间距离的方法
(3)原子空间利用率的计算
B.已知晶胞结构求空间利用率
知识点4 晶体中原子坐标
简单立方堆积的晶胞中8个顶点的微粒是__________的,因此可以__________________为坐标原点。以立方体的______________
2.简单立方体模型的原子分数坐标与投影图
(1)原子分数坐标:原子2为_______,因为其他顶点与2完全相同,所以其他顶点的分数坐标都为_______。
观察外观:晶体有规则的几何外形,而非晶体没有。
测定熔点是否固定:晶体有固定熔点,而非晶体没有。鉴别晶体与非晶体的方法
3.体心立方晶胞结构模型的原子分数坐标与投影图
4.面心立方晶胞结构模型的原子分数坐标与投影图
5.金刚石晶胞结构模型的原子分数坐标与投影图
(1)若a原子为坐标原点,晶胞边长的单位为1,则原子1、2、3、4的分数坐标分别为________、________、________、________。
(3)沿体对角线的投影图为________。
(4)沿体对角线切开的剖面图为_________________。
考向1 考查晶体与非晶体
A.准晶和晶体可以通过X射线衍射实验加以区别B.准晶具有良好的导电、导热性C.自然界中不存在天然条件下形成的准晶D.已知的准晶中都含有共价键
A.准晶和晶体可以通过X射线衍射实验加以区别B.准晶具有良好的导电、导热性
A.晶体具有自范性,而准晶不具有自范性,可以通过X射线衍射实验加以区别
B.准晶具有各向异性,不具有良好的导电、导热性
C.自然界中不存在天然条件下形成的准晶D.已知的准晶中都含有共价键
D.已知的准晶中不一定含有共价键,如Al65Cu23Fe12中没有共价键
C.自然界中存在天然条件下形成的准晶,如Al65Cu23Fe12
1.晶体与非晶体的根本区别在于其内部粒子在空间上是否按一定规律做周期性重复排列。
2.鉴别晶体与非晶体的方法(1)观察外观:晶体有规则的几何外形,而非晶体没有。(2)测定熔点是否固定:晶体有固定熔点,而非晶体没有。(3)测定是否具有各向异性:晶体有各向异性,而非晶体没有。(4)X-射线衍射法(最科学可靠的方法):晶体能使X-射线发生衍射(得到分立的斑点或明锐的谱线),而非晶体只能散射(得到连续的谱线)。
A.玛瑙 B.白磷 C.玻璃 D.石蜡
【变式训练2】(23-24高三上·江西省乐安·开学考试)下列关于晶体的说法,不正确的是( )
A.①②③ B.②③⑦ C.④⑤⑥ D.②③④
考向2 考查有关晶胞的计算
1.晶体中微粒的排列具有周期性,晶体中最小的结构重复单元称为晶胞,利用“均摊法”可以计算一个晶胞中的粒子数,从而确定晶体的化学式。
2.“均摊法”的基本思想是晶胞中任意位置上的一个粒子被n个晶胞共用,那么每个晶胞对这个原子分得份额就是(1/n)。常见考题里涉及的晶胞有立方晶胞、六方晶胞、三棱晶胞,以立方晶胞最为常见。(1)立方晶胞:每个顶点上的粒子被8个晶胞共用,每个粒子只有(1/8)属于该晶胞;每条棱上的粒子被4个晶胞共用,每个粒子只有(1/4)属于该晶胞;每个面心上的粒子被2个晶胞共用,每个粒子只有(1/2)属于该晶胞;晶胞内的粒子完全属于该晶胞。
(2)六方晶胞:每个顶点上的粒子被6个晶胞共用;每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被3个晶胞共用;每个面心上的粒子被2个晶胞共用;晶胞内的粒子完全属于该晶胞。(3)三棱晶胞:每个顶点上的粒子被12个晶胞共用;每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被6个晶胞共用;每个面心上的粒子被2个晶胞共用;晶胞内的粒子完全属于该晶胞。
考向1 考察常见晶体的比较与晶体类型
1.概念:只含______的晶体称为分子晶体。
2.粒子间的相互作用力:分子晶体内相邻分子间以______________相互吸引,分子内原子之间以________结合。
4.物理性质分子晶体熔、沸点较____,硬度较____。
5.分子晶体的结构特征①分子间作用力只是范德华力:晶体中分子堆积方式为____________。
②分子间还有其他作用力:水分子之间的主要作用力是______,在冰的每个水分子周围只有___个紧邻的水分子。冰的晶体结构如图:
1.构成微粒及其相互作用
2.物理性质①共价晶体中,由于各原子均以强的共价键相结合,因此一般熔点____,硬度____。②结构相似的共价晶体,原子半径越小,键长越____,键能越____,晶体的熔点越____。
晶体硼、晶体硅、金刚石等
碳化硅(SiC)、二氧化硅(SiO2)、氮化硅(Si3N4)、氮化硼(BN)等
2.金属晶体①在金属晶体中,原子间以________相结合。②金属晶体的性质:优良的________、________和________。③用电子气理论解释金属的性质:
金属晶体具有导电性,但导电的物质不一定是金属,如石墨晶体导电但不是金属晶体。
1.构成粒子:________和________。
2.作用力:________。
3.配位数:一个离子周围________的________离子的数目。
4.离子晶体结构的决定因素①几何因素:晶体中正负离子的________。②电荷因素:晶体中正负离子的________。③键性因素:离子键的__________。
1.同层内,碳原子采用____杂化,以________相结合形成__________平面网状结构。所有碳原子的p轨道平行且相互重叠,p轨道中的电子可在整个平面中运动。
2.层与层之间以__________相结合。
3.石墨晶体中,既有________,又有________和__________,属于__________。
(1)石墨层状晶体中,层与层之间的作用是__________。
(2)平均每个正六边形拥有的碳原子个数是___,C原子采取的杂化方式是____。
(3)在每层内存在______键和_____键。
知识点7 四种晶体的性质与判断
2.晶体熔、沸点的比较
1)不同类型晶体熔、沸点的比较
(1)不同类型晶体的熔、沸点高低的一般规律:共价晶体____离子晶体____分子晶体。
(2)金属晶体的熔、沸点__________,如钨、铂等熔、沸点很____,汞、铯等熔、沸点很____。
2)同种晶体类型熔、沸点的比较
①一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如熔点:MgO____NaCl____CsCl。
②衡量离子晶体稳定性的物理量是________。晶格能越____,形成的离子晶体越______,熔、沸点越____,硬度越____。
(1)依据构成晶体的粒子和粒子间的作用判断
①离子晶体的构成粒子是____________,粒子间的相互作用是______键。
②共价晶体(共价晶体)的构成粒子是______,粒子间的相互作用是______键。
③分子晶体的构成粒子是______,粒子间的相互作用为______________。
④金属晶体的构成粒子是______________________,粒子间的相互作用是______键。
(2)依据物质的类别判断
③常见的共价晶体单质有金刚石、晶体硅、晶体硼等,常见的共价晶体化合物有碳化硅、二氧化硅等。
④金属单质与合金是金属晶体。
(3)依据晶体的熔点判断
①离子晶体的熔点较____,常在数百至一千摄氏度以上。
②共价晶体熔点____,常在一千至几千摄氏度。
③分子晶体熔点____,常在数百摄氏度以下至很低温度。
④金属晶体多数熔点____,但也有相当低的,如汞。
①离子晶体水溶液或熔融态时能______。
②共价晶体一般为________。
③分子晶体为________,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由离子也能______。
④金属晶体是电的________。
(5)依据硬度和机械性能判断
①离子晶体的硬度较____或略硬而脆。
②共价晶体的硬度____。
③分子晶体的硬度____且较脆。
④金属晶体多数硬度____,但也有硬度较小的,且具有________。
A.分子晶体 B.金属晶体 C.离子晶体 D.共价晶体
考向1 考查常见晶体的比较与晶体类型判断
【思维建模】判断晶体类型的5种方法(1)依据构成晶体的粒子和粒子间的作用判断①离子晶体的构成粒子是阴、阳离子,粒子间的相互作用是离子键。②原子晶体(共价晶体)的构成粒子是原子,粒子间的相互作用是共价键。③分子晶体的构成粒子是分子,粒子间的相互作用为分子间作用力。④金属晶体的构成粒子是金属阳离子和自由电子,粒子间的相互作用是金属键。
(3)依据晶体的熔点判断①离子晶体的熔点较高,常在数百至一千摄氏度以上。②原子晶体(共价晶体)熔点高,常在一千至几千摄氏度。③分子晶体熔点低,常在数百摄氏度以下至很低温度。④金属晶体多数熔点高,但也有相当低的,如汞。(4)依据导电性判断①离子晶体水溶液或熔融态时能导电。②原子晶体(共价晶体)一般为非导体。③分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由离子也能导电。④金属晶体是电的良导体。
(5)依据硬度和机械性能判断①离子晶体的硬度较大或略硬而脆。②原子晶体(共价晶体)的硬度大。③分子晶体的硬度小且较脆。④金属晶体多数硬度大,但也有硬度较小的,且具有延展性。
【例2】(23-24高三上·辽宁·期中)下列关于物质的熔沸点高低顺序中,正确的是( )
考向2 考查晶体熔沸点高低的比较
A.金刚石>晶体硅>金刚砂
C.邻羟基苯甲酸>对羟基苯甲酸
晶体熔、沸点的比较(1)不同类型晶体的熔、沸点高低的一般规律:原子晶体>离子晶体>分子晶体。(2)相同类型晶体①金属晶体:金属原子的价电子数越多,原子半径越小,金属熔、沸点就越高,如熔、沸点:Na<Mg
【变式训练2】(23-24高三上·四川·期末)下列物质的性质变化规律与分子间作用力有关的是( )
,当2个晶胞2放在一起时,图中红框截取的部分就是晶胞3,晶胞2和晶胞3表示同一晶体,故D正确;故选B。
A.中心原子的配位数是4 B.晶胞中配合物分子的数目为2C.晶体中相邻分子间存在范德华力 D.该晶体属于混合型晶体
(1)Sn位于元素周期表的第5周期第IVA族。将Sn的基态原子最外层轨道表示式补充完整:________。
(3)白锡和灰锡是单质Sn的常见同素异形体。二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn原子周围与它最近且距离相等的Sn原子有___个。
第03讲 盐类的水解(课件)-2025年高考化学一轮复习讲练测(新教材新高考): 这是一份第03讲 盐类的水解(课件)-2025年高考化学一轮复习讲练测(新教材新高考),共60页。PPT课件主要包含了考情透视,知识导图,考点突破,真题练习,考点一,考点二,考点三等内容,欢迎下载使用。
第02讲 物质的量浓度(课件)-2025年高考化学一轮复习讲练测(新教材新高考): 这是一份第02讲 物质的量浓度(课件)-2025年高考化学一轮复习讲练测(新教材新高考),共48页。
第02讲 原电池、化学电源(课件)-2025年高考化学一轮复习讲练测(新教材新高考): 这是一份第02讲 原电池、化学电源(课件)-2025年高考化学一轮复习讲练测(新教材新高考),共60页。PPT课件主要包含了考情透视,知识导图,考点突破,真题练习,考点一,原电池的工作原理,考点二,化学电源,考向1一次电池,考向2二次电池等内容,欢迎下载使用。












