

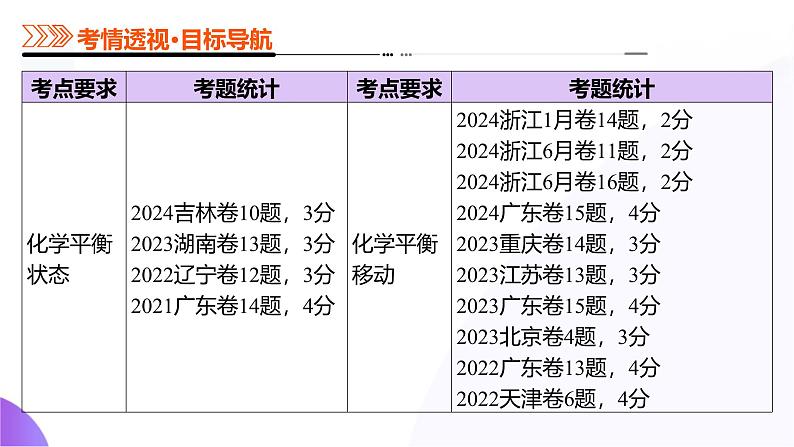


第02讲 化学平衡状态、化学平衡的移动(课件)-2025年高考化学一轮复习讲练测(新教材新高考)
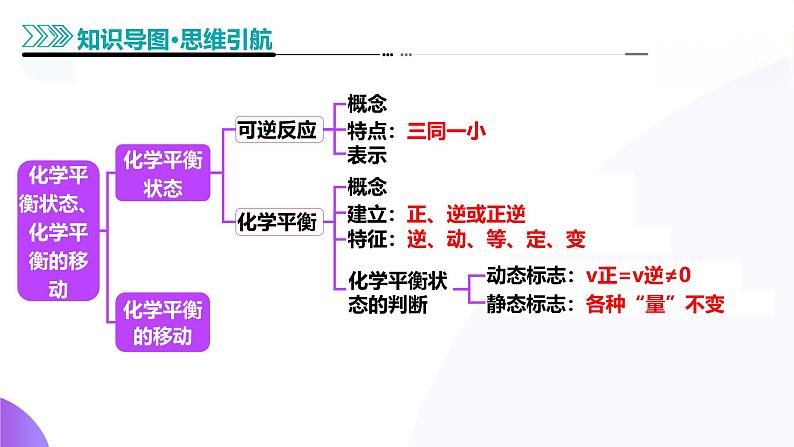
展开化学平衡状态、化学平衡的移动
特征:逆、动、等、定、变
动态标志:v正=v逆≠0
静态标志:各种“量”不变
改变下列条件对化学平衡的影响
图示影响化学平衡移动的因素
考向1 考查可逆反应的特点
考向2 考查化学平衡状态的判断
考向1 考查化学平衡的移动方向的判断
考向2 考查等效平衡的应用
考向3 考查勒夏特列原理的应用
在方程式中用“______”表示,而不用“_____”表示。
1.概念:在一定条件下的可逆反应中,当反应进行到一定程度时,正反应速率和逆反应速率______,反应物的浓度和生成物的浓度保持______的状态。
(1)对于只加入反应物从正向建立的平衡:
(1)对于只加入生成物从逆向建立的平衡:
化学平衡状态既可以从正反应方向建立,也可以从逆反应方向建立,或者同时从正、逆两方向建立。
4.化学平衡状态的判断
(2)动态标志:_____________
①同种物质:同一物质的生成速率______消耗速率。
(3)静态标志:各种“量”不变
①各物质的______、__________或______不变。
②各物质的__________(______________、__________等)不变。
③______(化学反应方程式两边气体体积________)或______(某组分有______)不变。
④绝热容器中______不变。
气体质量或气体物质的量
(1)化学平衡状态判断“三关注”关注反应条件,是恒温恒容、恒温恒压,还是绝热恒容容器;关注反应特点,是等体积反应,还是非等体积反应;关注特殊情况,是否有固体参加或生成,或固体的分解反应。
c1、c2=(0.1+x) ml/L:(0.3+3x) ml/L=1:3
平衡时,各物质之间的速率之比等于化学计量数之比
反应完全正向进行X最大值(X转化率最大):Z的初始浓度为0 ml/L
反应开始时c1(X)=(0.1+0.04) ml/L=0.14 ml/L
反应逆向进行X最小值(X转化率最小):X的初始浓度为0 ml/L
极端假设法确定各物质浓度范围
可逆反应的平衡物理量一定在最大值和最小值之间,但起始物理量可以为最大值或最小值。
反应物最小值生成物最大值
下列有关说法正确的是( )
B.b、c两点的正反应速率:Vb>Vc
C.此反应在任意温度下都可自发进行D.当容器内气体的平均相对分子质量不变时,反应达平衡状态
T1下x1甲烷的转化率大于x2
下列说法不正确的是( )
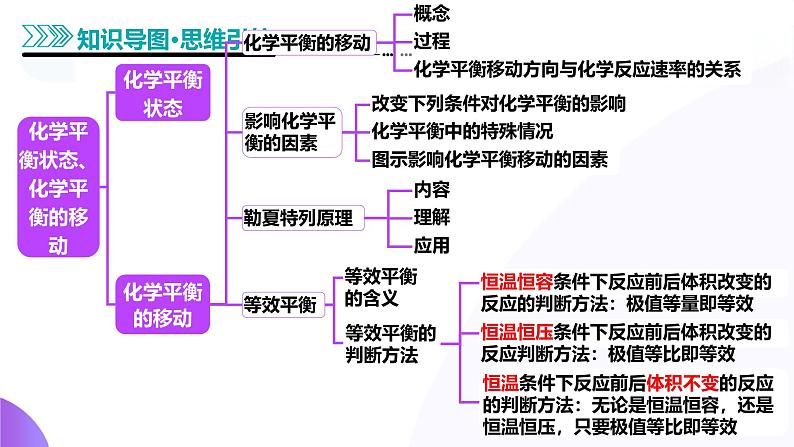
知识点1 化学平衡的移动
1.概念:一个可逆反应,达到化学平衡状态以后,若改变反应条件(如温度、压强、浓度等),使正、逆反应的速率________,化学平衡发生移动。最终在新的条件下,会建立新的化学平衡,这个过程叫作化学平衡的移动。
2.化学平衡移动的过程
原化学平衡状态v正=v逆
平衡被破坏v’正≠v’逆
建立新化学平衡状态v’’正=v’’逆
3.化学平衡移动方向与化学反应速率的关系
知识点2 影响化学平衡的因素
1.改变下列条件对化学平衡的影响
2.化学平衡中的特殊情况
(1)当反应物或生成物中存在与其他物质不相混溶的固体或液体物质时,由于其“浓度”是________,不随其量的增减而变化,故改变这些固体或液体的____,对化学平衡没影响。
(2)______程度地改变反应混合物中各物质的浓度时,应视为压强的影响。
体系中各组分的浓度同倍数减小(等效于减压)
压强对化学平衡的影响主要看改变压强能否引起反应物和生成物的浓度变化,只有引起物质的浓度变化才会造成平衡移动,否则压强对平衡无影响。
3.图示影响化学平衡移动的因素
知识点3 勒夏特列原理
1.内容:对于一个已经达到平衡的体系,如果改变影响化学平衡的一个条件 (如______、______、______),平衡将向着能够______这种改变的方向移动。
2.理解勒夏特列原理的注意问题
(1)勒夏特列原理适用于任何动态平衡(如溶解平衡、电离平衡等),________状态不能用此来分析。
(2)勒夏特列原理可判断“改变影响平衡的一个条件”时平衡移动的方向。若同时改变影响平衡移动的几个条件,则不能简单地根据勒夏特列原理来判断平衡移动的方向,只有在改变的条件对平衡移动的方向影响一致时,才能根据勒夏特列原理进行判断。
(3)平衡移动的结果是“减弱”外界条件的影响,而不是“______”外界条件的影响,更不是“扭转”外界条件的影响。
1.等效平衡的含义在一定条件下(恒温恒容或恒温恒压)下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,还是正、逆反应同时投料,达到化学平衡状态时,任何相同组分的百分含量(质量分数、物质的量分数、体积分数等)均______。
2.等效平衡的判断方法
3.虚拟“中间态”法构建等效平衡
(1)构建恒温恒容平衡思维模式新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大______。
(2)构建恒温恒压平衡思维模式(以气体物质的量增加的反应为例,见图示)新平衡状态可以认为是两个原平衡状态简单的叠加,压强______,平衡________。
A.反应Ⅲ的ΔH3=+104kJ · ml-1
ΔH1、ΔH2、ΔH3均大于0,T↑,反应Ⅰ、反应Ⅱ和反应Ⅲ的化学平衡均正向移动
丁烯的物质的量分数一直减少,乙烯一直增加,丙烯先增加后减少
故a为丙烯,b为丁烯,c为乙烯
T↓或p↑,反应Ⅰ、反应Ⅲ的化学平衡均逆向移动,C4H8的物质的量分数增大
D.超过700K后曲线a下降的原因可能是随着温度升高反应Ⅰ逆向移动,反应Ⅱ正向移动
ΔH1>0,T↑,反应Ⅰ正向移动
是否有固体或纯液体参加
下列有关叙述不正确的是( )
A.容器中反应的平均速率①<②是因为二者的活化能不同
活化能的大小只与温度和反应本身有关
同一反应,恒温,故活化能不变
恒温恒容,②投料比①多,浓度更大,改变单位体积的活化分子数目,从而提高反应速率,与活化能无关
B.该制H2反应在此条件下可自发进行
ΔH<0,ΔG=ΔH-TΔS<0反应自发进行
C.容器②中CO的平衡转化率应等于50%
ΔH:每生成或消耗1ml物质需吸收或放出QkJ热量
故①消耗CO的物质的量:20.5kJ÷41kJ/ml=0.5ml
①的CO的平衡转化率等于50%
相似等效,故②CO消耗的物质的量为1ml
②中CO的平衡转化率=1÷2=50%
D.容器②中反应达到平衡状态时Q=41
由C选项得消耗1mlCO,恒温故②放出的热量=反应的焓变
两平衡状态间要互为等效应满足四点:①同一条件;②同一可逆反应;③仅仅由于初始投料不同(即建立平衡的方向可以不同);④平衡时相应物质在各自平衡体系中的体积分数(或物质的量分数)相同。
催化剂只加快反应速率,不改变平衡
酯为生成物,酯蒸出,生成物浓度减小,反应正向移动
合成氨中低温才使平衡正向移动,500℃不符合平衡移动原理
锌与硫酸铜反应生铜,形成锌铜原电池,加快反应速率
1.对于溶液中的离子反应,向溶液中加入含与实际反应无关的离子固体,平衡不移动。2.溶液中的可逆反应,达平衡后加水稀释,平衡向溶质微粒数增多的方向移动。3.改变固体或纯液体的量,对平衡无影响。4.当反应混合物中不存在气态物质时,压强的改变对平衡无影响。5.对于反应前后气体体积无变化的反应,如H2(g)+I2(g) 2HI(g),压强的改变对平衡无影响。但增大(或减小)压强会使各物质的浓度增大(或减小),混合气体的颜色变深(或浅)。6.“惰性气体”对化学平衡的影响
平衡向气体体积增大的方向移动
A.生铁比高纯度的铁在空气中更容易发生电化学腐蚀
A.3h 时,反应②正、逆反应速率相等
B.该温度下的平衡常数:①>②
C.0~3h平均速率(异山梨醇)=0.014ml·kg-1·h-1
D.反应②加入催化剂不改变其平衡转化率
A. B. C. D.
C.酯的水解速率:FCH2COOCH2CH3>ClCH2COOCH2CH3
新高考化学一轮复习讲义课件 第7章 第34讲 化学平衡状态 化学平衡的移动: 这是一份新高考化学一轮复习讲义课件 第7章 第34讲 化学平衡状态 化学平衡的移动,共60页。PPT课件主要包含了复习目标,真题演练明确考向,课时精练巩固提高,内容索引,知识梳理·夯基础,同一条件,质量或浓度,2建立,3平衡特点,错误的写明原因等内容,欢迎下载使用。
新高考化学一轮复习讲义课件第7章 第21讲 化学平衡状态 化学平衡的移动: 这是一份新高考化学一轮复习讲义课件第7章 第21讲 化学平衡状态 化学平衡的移动,共60页。PPT课件主要包含了考点一,考点二,考点三,考点清单,保持不变,小题自测,×√×,×××,√××,①③④⑦等内容,欢迎下载使用。
第28讲 化学平衡状态 化学平衡的移动 课件—2025届高考化学大一轮复习: 这是一份第28讲 化学平衡状态 化学平衡的移动 课件—2025届高考化学大一轮复习,共60页。PPT课件主要包含了必备知识·强基固本,关键能力·核心突破,素养评价·真题演练,知识梳理,自主评价等内容,欢迎下载使用。












