





高中化学人教版 (2019)必修 第一册第一节 铁及其化合物集体备课课件ppt
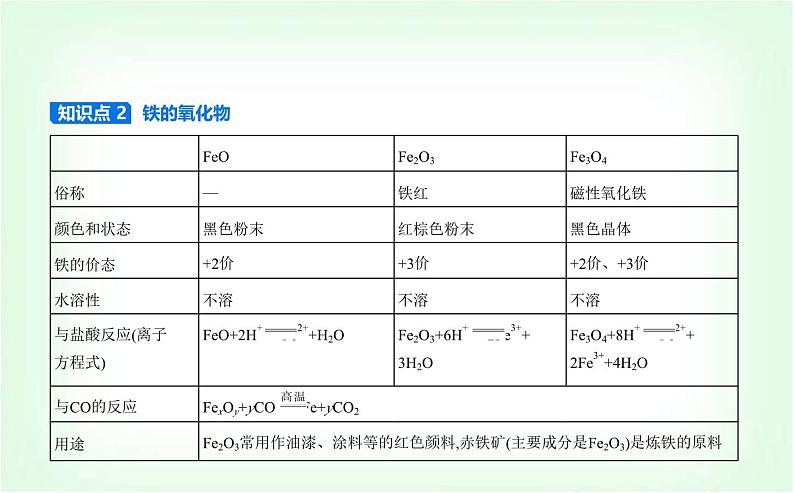
展开知识点 2 铁的氧化物
注意 ①FeO不稳定,易被氧化为Fe3O4。②FeO、Fe3O4遇氧化性酸(如HNO3)发生氧化还原反应,+2价的铁均被氧化为+3价。
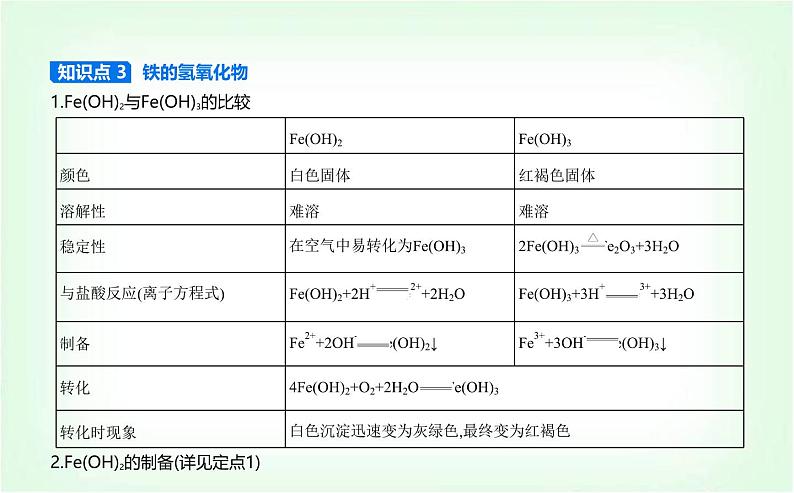
1.Fe(OH)2与Fe(OH)3的比较
知识点 3 铁的氢氧化物
2.Fe(OH)2的制备(详见定点1)
1.Fe2+、Fe3+的检验方法(详见定点2)2.Fe2+与Fe3+的转化
知识点 4 铁盐和亚铁盐
知识辨析1.铁在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2。这种说法是否正确?2.Fe3O4中Fe元素的化合价既有+2价又有+3价,因而Fe3O4是FeO与Fe2O3组成的混合物。这种 说法是否正确?3.FeCl3、FeCl2和Fe(OH)3均可能通过化合反应制得。这种说法是否正确?
一语破的1.不正确。铁在Cl2中燃烧,只能生成FeCl3,与反应物的用量无关。2.不正确。虽然Fe3O4可用FeO·Fe2O3来表示,但Fe3O4是一种纯净物,不能将Fe3O4看作是FeO和 Fe2O3组成的混合物。3.正确。通过特定的反应,FeCl3、FeCl2和Fe(OH)3均能通过化合反应制备。如2Fe+3Cl2 2FeCl3、2FeCl3+Fe 3FeCl2、4Fe(OH)2+O2+2H2O 4Fe(OH)3。
定点 1 Fe(OH)2的制备
1.制备原理(1)可溶性亚铁盐(如FeSO4)与强碱(如NaOH)溶液反应:Fe2++2OH- Fe(OH)2↓。(2)白色沉淀Fe(OH)2很容易被O2氧化为红褐色的Fe(OH)3。因此实验过程中一定要防止Fe(OH)2被氧化,应与O2隔绝。2.防止Fe(OH)2被氧化的措施(1)将用于配制溶液的蒸馏水煮沸,使O2逸出。(2)将盛有NaOH溶液的胶头滴管尖嘴插入试管中亚铁盐溶液底部(不接触试管底),并慢慢挤 出NaOH溶液。(3)在试管中亚铁盐溶液的上方充入保护气,如H2、N2、稀有气体等。(4)在试管中亚铁盐溶液上面加保护层,如苯(密度小于水,与水不互溶)、植物油等。
3.常见实验装置 ① ② ③
典例 如图所示装置可用于制取Fe(OH)2并观察Fe(OH)2被O2氧化时颜色的变化。实验提供的 试剂:铁屑、稀硫酸、NaOH溶液等,下列说法不正确的是 ( )A.烧瓶A中发生反应的离子方程式为Fe+2H+ Fe2++H2↑B.实验开始前先打开止水夹E,其目的是利用产生的H2将装置中的空气排尽
C.生成Fe(OH)2的操作:关闭止水夹E,将烧瓶A中FeSO4溶液压入装置B中进行反应D.若取下装置B的橡胶塞,可观察到沉淀由白色迅速变为红褐色
解析 制取Fe(OH)2应使用FeSO4溶液和NaOH溶液,需在隔绝空气的条件下制备Fe(OH)2。结 合图示装置可知装置B中是NaOH溶液,A中利用Fe和稀硫酸反应可制备FeSO4。烧瓶A中反 应的离子方程式为Fe+2H+ Fe2++H2↑,A项正确;实验开始时应利用A中产生的H2排出装置中的空气,即实验开始前需打开止水夹E,B项正确;当装置中空气排尽后,可关闭止水夹E,随着 A中不断反应,A中压强增大,将A中FeSO4溶液压入装置B中反应生成Fe(OH)2,C项正确;取下 装置B的橡胶塞,Fe(OH)2被空气中的O2氧化,看到白色固体迅速变成灰绿色,最后变成红褐色, D项错误。
1.Fe3+的检验方法2.Fe2+的检验方法
定点 2 Fe2+、Fe3+的检验方法
3.同时含有Fe2+、Fe3+的检验方法
1.从类别角度分析,Fe属于金属单质,具有金属单质的通性;从价态角度分析,Fe处于最低价态, 只有还原性,可以被氧化剂氧化为Fe2+、Fe3+。
定点 3 利用“价类二维图”理解铁及其化合物之间的转化
2.从类别角度分析,Fe(OH)2、Fe(OH)3属于碱,具有碱的通性,能与酸反应生成盐和水;从价态 角度分析,Fe(OH)2中Fe元素为+2价,具有还原性,与强氧化性酸反应时Fe2+会被氧化为Fe3+; Fe(OH)3中Fe元素为+3价,具有氧化性,与还原性较强的酸(如HI)反应时Fe3+会被还原为Fe2+。3.从类别角度分析,亚铁盐具有盐类物质的通性;从价态角度分析,亚铁盐中Fe2+既有氧化性又有还原性。
人教版 (2019)第三章 铁 金属材料第一节 铁及其化合物课文课件ppt: 这是一份人教版 (2019)第三章 铁 金属材料第一节 铁及其化合物课文课件ppt,共29页。
高中人教版 (2019)第一节 铁及其化合物集体备课课件ppt: 这是一份高中人教版 (2019)第一节 铁及其化合物集体备课课件ppt,共31页。
化学第一节 铁及其化合物作业课件ppt: 这是一份化学第一节 铁及其化合物作业课件ppt,共24页。PPT课件主要包含了B级关键能力提升练,提供反应需要的水蒸气等内容,欢迎下载使用。













