





还剩27页未读,
继续阅读
浙江版高考化学复习专题五金属及其化合物教学课件
展开
这是一份浙江版高考化学复习专题五金属及其化合物教学课件,共35页。
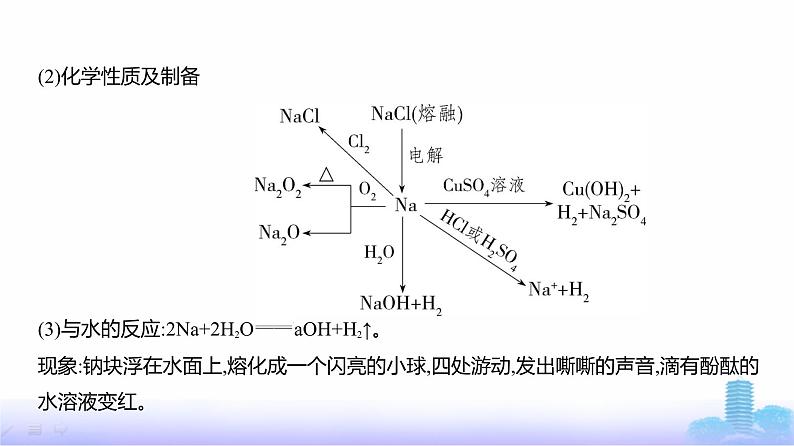
考点1 钠、铁及其化合物一、钠及其化合物1.钠(1)物理性质及保存方式:质软、银白色、有金属光泽,导电性、导热性良好,密度ρ煤油< ρ钠<ρ水,熔点较低;保存在煤油或石蜡油中。
(3)与水的反应:2Na+2H2O 2NaOH+H2↑。现象:钠块浮在水面上,熔化成一个闪亮的小球,四处游动,发出嘶嘶的声音,滴有酚酞的 水溶液变红。
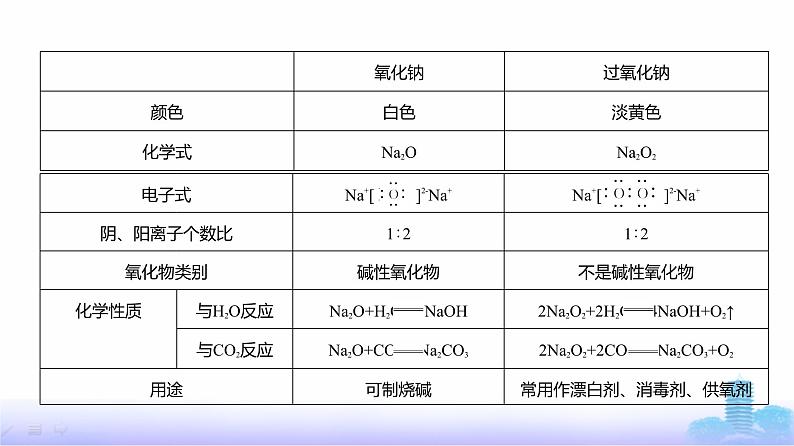
注意 钠与活泼性比钠弱的金属的盐溶液反应时,不能将金属单质置换出来,例如,Na 加入CuSO4溶液中,Na先与H2O反应生成NaOH,NaOH再与CuSO4反应。(4)制备:2NaCl(熔融) 2Na+Cl2↑。(5)用途:①冶炼金属;②高压钠灯;③钠钾合金用作原子反应堆的导热剂。2.钠的氧化物(1)氧化钠和过氧化钠
注意 Na2O在加热条件下与氧气反应会生成Na2O2:2Na2O+O2 2Na2O2。(2)Na2O2的强氧化性与还原性从元素化合价角度分析Na2O2的性质 Na2 3.Na2CO3和NaHCO3(1)俗名和用途:Na2CO3俗称纯碱、苏打,用于纺织、制皂、造纸、制玻璃等,和酸性物 质等混合可作复合膨松剂;NaHCO3俗称小苏打,用于制药、焙制糕点等,作膨松剂。(2)物理性质:均为白色,Na2CO3为粉末状固体,NaHCO3为细小晶体。都易溶于水,相同 温度时,溶解度:Na2CO3>NaHCO3。Na2CO3溶于水放热,NaHCO3溶于水吸热。
(3)化学性质①水溶液均显碱性,同浓度时碱性:Na2CO3>NaHCO3。②热稳定性:Na2CO3>NaHCO3。2NaHCO3 Na2CO3+CO2↑+H2O③与盐酸反应:Na2CO3+2HCl 2NaCl+H2O+CO2↑,NaHCO3+HCl NaCl+H2O+CO2↑(盐酸逐滴加入时,NaHCO3先产生气泡)。(4)相互转化Na2CO3 NaHCO3Na2CO3+CO2+H2O 2NaHCO3
2NaHCO3 Na2CO3+CO2↑+H2ONaHCO3+NaOH Na2CO3+H2O(5)碳酸钠与碳酸氢钠的鉴别方法①利用热稳定性不同
②利用和酸反应生成气体的速率不同(相同条件下)③利用溶液的酸碱度不同
4.焰色试验(1)本质:电子的跃迁,物理变化。(2)实验步骤:铂丝 观察火焰颜色 铂丝 。注意 也可用洁净无锈的铁丝代替铂丝。(3)一些金属元素的焰色
注意 透过蓝色钴玻钾元素的焰色。
5.侯氏制碱法(1)工艺流程
注意 制取NaHCO3时,先向饱和食盐水中通入氨气,再通入二氧化碳。
(2)反应原理①产生NaHCO3的反应:NH3+NaCl+CO2+H2O NaHCO3↓+NH4Cl。②产生Na2CO3的反应:2NaHCO3 Na2CO3+CO2↑+H2O。二、铁及其化合物1.铁(1)Fe位于元素周期表第四周期Ⅷ族。原子结构示意图: 。常见价态:+2和+3。
(2)物理性质:导热性、延展性良好,有导电性,易被磁铁吸引。(3)化学性质 ①常温下,铁遇浓H2SO4、浓HNO3时,表面迅速生成致密的氧化物薄膜,发生钝化。
Fe与过量稀HNO3的反应:Fe+N +4H+ Fe3++NO↑+2H2OFe与少量稀HNO3的反应:3Fe+2N +8H+ 3Fe2++2NO↑+4H2O注意 氧化性酸会把Fe氧化为Fe3+,但当Fe过量时,2Fe3++Fe 3Fe2+。②氧化性较强的物质,如Cl2、Br2与Fe反应生成Fe3+,氧化性较弱的物质,如I2、S等与Fe 反应生成Fe2+。2Fe+3Cl2 2FeCl3Fe+S FeS
2.铁的氧化物(1)物理性质及用途
(2)化学性质①FeO、Fe2O3都属于碱性氧化物,能溶于强酸,它们溶于盐酸的离子方程式分别为FeO+2H+ Fe2++H2O、Fe2O3+6H+ 2Fe3++3H2O。②铁的氧化物还能被CO、Al还原,以氧化铁为例:Fe2O3+3CO 2Fe+3CO2,Fe2O3+2Al 2Fe+Al2O3。③Fe3O4溶于足量稀硝酸、氢碘酸(HI)的离子方程式分别为3Fe3O4+28H++N 9Fe3++NO↑+14H2O、Fe3O4+8H++2I- 3Fe2++I2+4H2O。
3.铁的氢氧化物Fe2++2OH- Fe(OH)2↓Fe3++3OH- Fe(OH)3↓Fe(OH)2、Fe(OH)3均难溶于水;碱性条件下,Fe(OH)2极易被空气中的氧气氧化生成Fe(OH)3。4Fe(OH)2+O2+2H2O 4Fe(OH)3颜色:白色→灰绿色→红褐色
4.铁盐及亚铁盐的检验及鉴别(1)观察颜色:含Fe2+的溶液呈浅绿色,含Fe3+的溶液呈棕黄色。(2)用KSCN和氯水检验 (3)加碱法 (4)淀粉-KI试纸法
(5)加溴水 (6)特征试剂法溶液 褪色→Fe2+ 注意 ①检验Fe2+时不能先加氯水后加KSCN溶液,也不能将加KSCN后的混合溶液加 入足量的新制氯水中(新制氯水可能会氧化SCN-)。②Fe3+、Fe2+、Cl-同时存在时不能 用酸性KMnO4溶液检验Fe2+(Cl-能还原KMnO4,有干扰)。
Fe+2HCl FeCl2+H2↑2Fe+3Cl2 2FeCl32Fe2++Cl2 2Fe3++2Cl-
5.Fe、Fe2+、Fe3+相互转化
Fe2++Zn Fe+Zn2+2Fe3++Cu 2Fe2++Cu2+Fe2O3+3CO 2Fe+3CO2
考点2 金属资源的开发利用1.金属的冶炼 (1)热分解法:适用于冶炼不活泼的金属。2HgO 2Hg+O2↑2Ag2O 4Ag+O2↑(2)热还原法:用还原剂(C、CO、H2、Al等)还原金属氧化物,适合冶炼较活泼的金属。Fe2O3+3CO 2Fe+3CO2
2Al+Cr2O3 2Cr+Al2O3(3)电解法:适合冶炼金属活动性很强的金属。2NaCl(熔融) 2Na+Cl2↑MgCl2(熔融) Mg+Cl2↑2Al2O3(熔融) 4Al+3O2↑2.合金(1)合金:两种或多种金属(或金属与非金属)熔合而成的具有金属特性的物质。合金具 有优良的物理、化学和机械加工性能,通常情况下,合金的熔点低、硬度大。
(2)常见的合金①铁合金:生铁和钢(可分为碳素钢和合金钢)。碳素钢根据含碳量不同,可分为低碳 钢、中碳钢、高碳钢。注意 生铁含碳量较高,质脆,含碳量降低,延展性增强。②铝合金,如硬铝,它的密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞 船的理想材料。③新型合金:储氢合金,它的研究和开发为氢气作为能源的实际应用起到重要的推动 作用。此外,钛合金、耐热合金、形状记忆合金等,广泛用于航空航天、生物工程和 电子工业等领域。
3.镁及其化合物的性质(1)镁(Mg)①物理性质:银白色、有金属光泽的固体,密度、硬度较小,导电性、导热性、延展性 良好。②化学性质 ③用途:用于信号弹和焰火,镁合金用于制造航天部件。
(2)氧化镁(MgO):白色粉末,熔点高,可作耐高温、耐火材料,是一种碱性氧化物。(3)氢氧化镁[Mg(OH)2]:白色固体,难溶于水,溶解度小于碳酸镁,是一种中强碱。4.从海水中提取金属镁的方法(1)流程
(2)注意事项①MgCl2·6H2O加热易水解,且生成的HCl会挥发,为抑制其水解,“脱水”时应在HCl氛 围中进行;②金属镁应通过电解熔融MgCl2制得。5.铝及其化合物的性质(1)铝(Al)①物理性质:银白色、有金属光泽的固体,密度、硬度较小,导电性、导热性、延展性 良好。
注意 铁、铝遇冷的浓硝酸、浓硫酸发生钝化,表面生成一层致密的氧化物薄膜,阻 止内部金属与酸反应,故可用铁制或铝制容器贮存和运输浓硝酸、浓硫酸。
(2)氧化铝(Al2O3)①物理性质及用途:白色固体,难溶于水,熔、沸点高;可作耐火材料,冶炼铝的原料。②化学性质a.两性氧化物:Al2O3+6H+ 2Al3++3H2O、Al2O3+2OH- 2Al +H2O。b.发生分解:2Al2O3(熔融) 4Al+3O2↑。(3)氢氧化铝[Al(OH)3]①物理性质及用途:白色不溶于水的固体,可用于制药。②两性氢氧化物:Al(OH)3+3H+ Al3++3H2O、Al(OH)3+OH- Al +2H2O。注意 三价铝常见的四种形态:Al3+、Al(OH)3、Al2O3、Al ,其中酸性溶液中以Al3+形式存在,强碱性溶液中以Al 形式存在,Al(OH)3受热分解生成Al2O3,Al(OH)3和Al2O3都有两性,既能与酸反应,也能与碱反应。
6.铜及其化合物的性质(1)铜(Cu)①物理性质:紫红色固体,导热性、导电性、延展性良好。②化学性质
注意 铜与氧化性强的Cl2、O2反应生成+2价铜的化合物,与氧化性弱的S反应生成+1 价铜的化合物。
氧化亚铜(Cu2O):砖红色固体,难溶于水,在稀硫酸中发生歧化反应:Cu2O+2H+ Cu2++Cu+H2O。无水CuSO4:遇水变蓝色(生成CuSO4·5H2O),可用于检验水。
(2)铜的化合物及转化
1.判断正误,正确的画“√”,错误的画“×”。(1)小苏打的主要成分是Na2CO3。 ( )(2)将铁锈溶于浓盐酸,滴入KMnO4溶液中,溶液紫色褪去,说明铁锈中含有Fe2+。( )(3)青铜比纯铜熔点低、硬度大,古代用青铜铸剑。 ( )(4)过氧化钠的电子式为Na+[·· ·· ··]2-Na+。 ( )(5)侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl。 ( )(6)检验Fe(NO3)2晶体是否变质:将样品溶于稀硫酸后滴加KSCN溶液,观察溶液是否变 红。 ( )
(7)Al(OH)3是两性氢氧化物,溶于H2CO3溶液或氨水。 ( )(8)将铜粉加入1.0 ml·L-1 Fe2(SO4)3溶液中,现象是溶液变蓝,有黑色固体出现。( )2.金属的冶炼事关国家的发展和人民的生活。下列用于制备相应金属的反应原理中, 可行的是 ( )A.用氢气还原氧化铝制备铝B.湿法炼铜:Fe+CuSO4 FeSO4+CuC.用铝热法可制备铁、锰、钒、铬等金属,也可用此法制镁D.用金属钠与AgNO3溶液反应制银
3.下列关于钠及其化合物的叙述正确的是( )A.Na2O2与SO2反应生成Na2SO3和O2B.将Na投入盐酸中,Na先与水反应,生成的NaOH再与HCl反应C.石蕊试液中加入Na2O2粉末,溶液先变蓝后褪色,没有气泡生成D.钠与浓NH4Cl溶液反应,放出的气体中含H2和NH3
4.类推是化学学习和研究中常用的思维方法,下列类推合理的是 ( )A.CuO在空气中加热得Cu2O,则Fe3O4在空气中加热得FeOB.明矾在水中水解生成Al(OH)3胶体,有净水作用,则Fe2(SO4)3溶于水形成Fe(OH)3胶体, 可作净水剂C.MgCl2溶液在空气中蒸干得到Mg(OH)2固体,则SrCl2溶液在空气中蒸干得Sr(OH)2固体D.若发生2CuS+3O2 2CuO+2SO2,则发生2HgS+3O2 2HgO+2SO2
考点1 钠、铁及其化合物一、钠及其化合物1.钠(1)物理性质及保存方式:质软、银白色、有金属光泽,导电性、导热性良好,密度ρ煤油< ρ钠<ρ水,熔点较低;保存在煤油或石蜡油中。
(3)与水的反应:2Na+2H2O 2NaOH+H2↑。现象:钠块浮在水面上,熔化成一个闪亮的小球,四处游动,发出嘶嘶的声音,滴有酚酞的 水溶液变红。
注意 钠与活泼性比钠弱的金属的盐溶液反应时,不能将金属单质置换出来,例如,Na 加入CuSO4溶液中,Na先与H2O反应生成NaOH,NaOH再与CuSO4反应。(4)制备:2NaCl(熔融) 2Na+Cl2↑。(5)用途:①冶炼金属;②高压钠灯;③钠钾合金用作原子反应堆的导热剂。2.钠的氧化物(1)氧化钠和过氧化钠
注意 Na2O在加热条件下与氧气反应会生成Na2O2:2Na2O+O2 2Na2O2。(2)Na2O2的强氧化性与还原性从元素化合价角度分析Na2O2的性质 Na2 3.Na2CO3和NaHCO3(1)俗名和用途:Na2CO3俗称纯碱、苏打,用于纺织、制皂、造纸、制玻璃等,和酸性物 质等混合可作复合膨松剂;NaHCO3俗称小苏打,用于制药、焙制糕点等,作膨松剂。(2)物理性质:均为白色,Na2CO3为粉末状固体,NaHCO3为细小晶体。都易溶于水,相同 温度时,溶解度:Na2CO3>NaHCO3。Na2CO3溶于水放热,NaHCO3溶于水吸热。
(3)化学性质①水溶液均显碱性,同浓度时碱性:Na2CO3>NaHCO3。②热稳定性:Na2CO3>NaHCO3。2NaHCO3 Na2CO3+CO2↑+H2O③与盐酸反应:Na2CO3+2HCl 2NaCl+H2O+CO2↑,NaHCO3+HCl NaCl+H2O+CO2↑(盐酸逐滴加入时,NaHCO3先产生气泡)。(4)相互转化Na2CO3 NaHCO3Na2CO3+CO2+H2O 2NaHCO3
2NaHCO3 Na2CO3+CO2↑+H2ONaHCO3+NaOH Na2CO3+H2O(5)碳酸钠与碳酸氢钠的鉴别方法①利用热稳定性不同
②利用和酸反应生成气体的速率不同(相同条件下)③利用溶液的酸碱度不同
4.焰色试验(1)本质:电子的跃迁,物理变化。(2)实验步骤:铂丝 观察火焰颜色 铂丝 。注意 也可用洁净无锈的铁丝代替铂丝。(3)一些金属元素的焰色
注意 透过蓝色钴玻钾元素的焰色。
5.侯氏制碱法(1)工艺流程
注意 制取NaHCO3时,先向饱和食盐水中通入氨气,再通入二氧化碳。
(2)反应原理①产生NaHCO3的反应:NH3+NaCl+CO2+H2O NaHCO3↓+NH4Cl。②产生Na2CO3的反应:2NaHCO3 Na2CO3+CO2↑+H2O。二、铁及其化合物1.铁(1)Fe位于元素周期表第四周期Ⅷ族。原子结构示意图: 。常见价态:+2和+3。
(2)物理性质:导热性、延展性良好,有导电性,易被磁铁吸引。(3)化学性质 ①常温下,铁遇浓H2SO4、浓HNO3时,表面迅速生成致密的氧化物薄膜,发生钝化。
Fe与过量稀HNO3的反应:Fe+N +4H+ Fe3++NO↑+2H2OFe与少量稀HNO3的反应:3Fe+2N +8H+ 3Fe2++2NO↑+4H2O注意 氧化性酸会把Fe氧化为Fe3+,但当Fe过量时,2Fe3++Fe 3Fe2+。②氧化性较强的物质,如Cl2、Br2与Fe反应生成Fe3+,氧化性较弱的物质,如I2、S等与Fe 反应生成Fe2+。2Fe+3Cl2 2FeCl3Fe+S FeS
2.铁的氧化物(1)物理性质及用途
(2)化学性质①FeO、Fe2O3都属于碱性氧化物,能溶于强酸,它们溶于盐酸的离子方程式分别为FeO+2H+ Fe2++H2O、Fe2O3+6H+ 2Fe3++3H2O。②铁的氧化物还能被CO、Al还原,以氧化铁为例:Fe2O3+3CO 2Fe+3CO2,Fe2O3+2Al 2Fe+Al2O3。③Fe3O4溶于足量稀硝酸、氢碘酸(HI)的离子方程式分别为3Fe3O4+28H++N 9Fe3++NO↑+14H2O、Fe3O4+8H++2I- 3Fe2++I2+4H2O。
3.铁的氢氧化物Fe2++2OH- Fe(OH)2↓Fe3++3OH- Fe(OH)3↓Fe(OH)2、Fe(OH)3均难溶于水;碱性条件下,Fe(OH)2极易被空气中的氧气氧化生成Fe(OH)3。4Fe(OH)2+O2+2H2O 4Fe(OH)3颜色:白色→灰绿色→红褐色
4.铁盐及亚铁盐的检验及鉴别(1)观察颜色:含Fe2+的溶液呈浅绿色,含Fe3+的溶液呈棕黄色。(2)用KSCN和氯水检验 (3)加碱法 (4)淀粉-KI试纸法
(5)加溴水 (6)特征试剂法溶液 褪色→Fe2+ 注意 ①检验Fe2+时不能先加氯水后加KSCN溶液,也不能将加KSCN后的混合溶液加 入足量的新制氯水中(新制氯水可能会氧化SCN-)。②Fe3+、Fe2+、Cl-同时存在时不能 用酸性KMnO4溶液检验Fe2+(Cl-能还原KMnO4,有干扰)。
Fe+2HCl FeCl2+H2↑2Fe+3Cl2 2FeCl32Fe2++Cl2 2Fe3++2Cl-
5.Fe、Fe2+、Fe3+相互转化
Fe2++Zn Fe+Zn2+2Fe3++Cu 2Fe2++Cu2+Fe2O3+3CO 2Fe+3CO2
考点2 金属资源的开发利用1.金属的冶炼 (1)热分解法:适用于冶炼不活泼的金属。2HgO 2Hg+O2↑2Ag2O 4Ag+O2↑(2)热还原法:用还原剂(C、CO、H2、Al等)还原金属氧化物,适合冶炼较活泼的金属。Fe2O3+3CO 2Fe+3CO2
2Al+Cr2O3 2Cr+Al2O3(3)电解法:适合冶炼金属活动性很强的金属。2NaCl(熔融) 2Na+Cl2↑MgCl2(熔融) Mg+Cl2↑2Al2O3(熔融) 4Al+3O2↑2.合金(1)合金:两种或多种金属(或金属与非金属)熔合而成的具有金属特性的物质。合金具 有优良的物理、化学和机械加工性能,通常情况下,合金的熔点低、硬度大。
(2)常见的合金①铁合金:生铁和钢(可分为碳素钢和合金钢)。碳素钢根据含碳量不同,可分为低碳 钢、中碳钢、高碳钢。注意 生铁含碳量较高,质脆,含碳量降低,延展性增强。②铝合金,如硬铝,它的密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞 船的理想材料。③新型合金:储氢合金,它的研究和开发为氢气作为能源的实际应用起到重要的推动 作用。此外,钛合金、耐热合金、形状记忆合金等,广泛用于航空航天、生物工程和 电子工业等领域。
3.镁及其化合物的性质(1)镁(Mg)①物理性质:银白色、有金属光泽的固体,密度、硬度较小,导电性、导热性、延展性 良好。②化学性质 ③用途:用于信号弹和焰火,镁合金用于制造航天部件。
(2)氧化镁(MgO):白色粉末,熔点高,可作耐高温、耐火材料,是一种碱性氧化物。(3)氢氧化镁[Mg(OH)2]:白色固体,难溶于水,溶解度小于碳酸镁,是一种中强碱。4.从海水中提取金属镁的方法(1)流程
(2)注意事项①MgCl2·6H2O加热易水解,且生成的HCl会挥发,为抑制其水解,“脱水”时应在HCl氛 围中进行;②金属镁应通过电解熔融MgCl2制得。5.铝及其化合物的性质(1)铝(Al)①物理性质:银白色、有金属光泽的固体,密度、硬度较小,导电性、导热性、延展性 良好。
注意 铁、铝遇冷的浓硝酸、浓硫酸发生钝化,表面生成一层致密的氧化物薄膜,阻 止内部金属与酸反应,故可用铁制或铝制容器贮存和运输浓硝酸、浓硫酸。
(2)氧化铝(Al2O3)①物理性质及用途:白色固体,难溶于水,熔、沸点高;可作耐火材料,冶炼铝的原料。②化学性质a.两性氧化物:Al2O3+6H+ 2Al3++3H2O、Al2O3+2OH- 2Al +H2O。b.发生分解:2Al2O3(熔融) 4Al+3O2↑。(3)氢氧化铝[Al(OH)3]①物理性质及用途:白色不溶于水的固体,可用于制药。②两性氢氧化物:Al(OH)3+3H+ Al3++3H2O、Al(OH)3+OH- Al +2H2O。注意 三价铝常见的四种形态:Al3+、Al(OH)3、Al2O3、Al ,其中酸性溶液中以Al3+形式存在,强碱性溶液中以Al 形式存在,Al(OH)3受热分解生成Al2O3,Al(OH)3和Al2O3都有两性,既能与酸反应,也能与碱反应。
6.铜及其化合物的性质(1)铜(Cu)①物理性质:紫红色固体,导热性、导电性、延展性良好。②化学性质
注意 铜与氧化性强的Cl2、O2反应生成+2价铜的化合物,与氧化性弱的S反应生成+1 价铜的化合物。
氧化亚铜(Cu2O):砖红色固体,难溶于水,在稀硫酸中发生歧化反应:Cu2O+2H+ Cu2++Cu+H2O。无水CuSO4:遇水变蓝色(生成CuSO4·5H2O),可用于检验水。
(2)铜的化合物及转化
1.判断正误,正确的画“√”,错误的画“×”。(1)小苏打的主要成分是Na2CO3。 ( )(2)将铁锈溶于浓盐酸,滴入KMnO4溶液中,溶液紫色褪去,说明铁锈中含有Fe2+。( )(3)青铜比纯铜熔点低、硬度大,古代用青铜铸剑。 ( )(4)过氧化钠的电子式为Na+[·· ·· ··]2-Na+。 ( )(5)侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl。 ( )(6)检验Fe(NO3)2晶体是否变质:将样品溶于稀硫酸后滴加KSCN溶液,观察溶液是否变 红。 ( )
(7)Al(OH)3是两性氢氧化物,溶于H2CO3溶液或氨水。 ( )(8)将铜粉加入1.0 ml·L-1 Fe2(SO4)3溶液中,现象是溶液变蓝,有黑色固体出现。( )2.金属的冶炼事关国家的发展和人民的生活。下列用于制备相应金属的反应原理中, 可行的是 ( )A.用氢气还原氧化铝制备铝B.湿法炼铜:Fe+CuSO4 FeSO4+CuC.用铝热法可制备铁、锰、钒、铬等金属,也可用此法制镁D.用金属钠与AgNO3溶液反应制银
3.下列关于钠及其化合物的叙述正确的是( )A.Na2O2与SO2反应生成Na2SO3和O2B.将Na投入盐酸中,Na先与水反应,生成的NaOH再与HCl反应C.石蕊试液中加入Na2O2粉末,溶液先变蓝后褪色,没有气泡生成D.钠与浓NH4Cl溶液反应,放出的气体中含H2和NH3
4.类推是化学学习和研究中常用的思维方法,下列类推合理的是 ( )A.CuO在空气中加热得Cu2O,则Fe3O4在空气中加热得FeOB.明矾在水中水解生成Al(OH)3胶体,有净水作用,则Fe2(SO4)3溶于水形成Fe(OH)3胶体, 可作净水剂C.MgCl2溶液在空气中蒸干得到Mg(OH)2固体,则SrCl2溶液在空气中蒸干得Sr(OH)2固体D.若发生2CuS+3O2 2CuO+2SO2,则发生2HgS+3O2 2HgO+2SO2
相关课件
浙江版高考化学复习专题二物质的量教学课件: 这是一份浙江版高考化学复习专题二物质的量教学课件,共26页。
新高考化学复习专题六非金属及其化合物教学课件: 这是一份新高考化学复习专题六非金属及其化合物教学课件,共60页。
新高考化学复习专题五金属及其化合物练习课件: 这是一份新高考化学复习专题五金属及其化合物练习课件,共60页。












