




还剩52页未读,
继续阅读
所属成套资源:全套新高考化学一轮复习专题课件+练习含答案
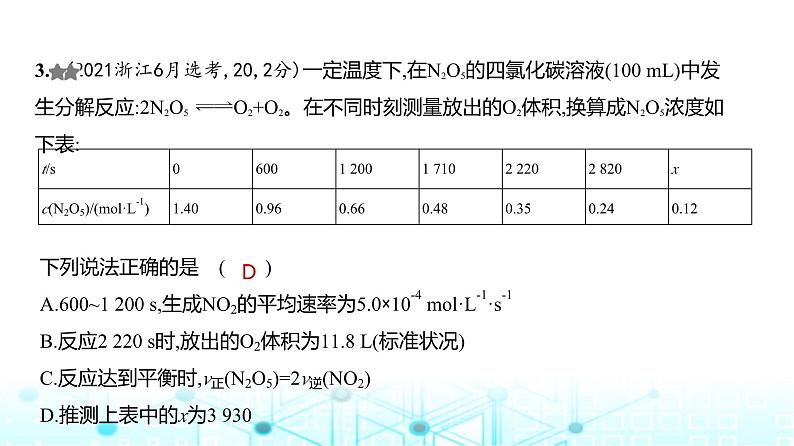
成套系列资料,整套一键下载
新高考化学复习专题一0一化学反应速率和化学平衡练习课件
展开这是一份新高考化学复习专题一0一化学反应速率和化学平衡练习课件,共60页。
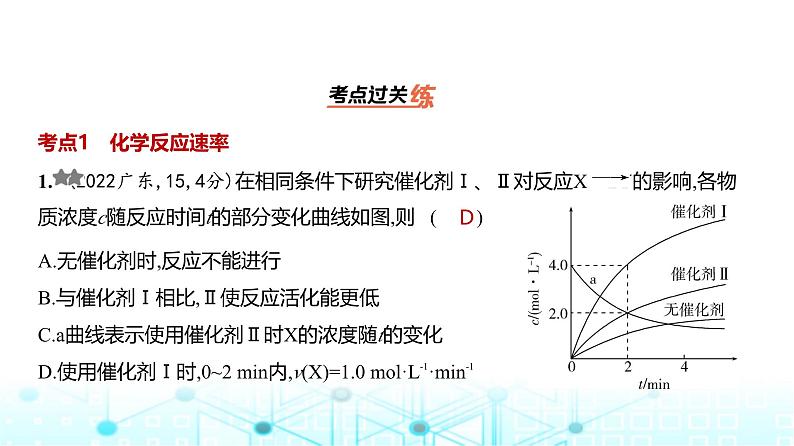
1. (2022广东,15,4分)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X 2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则 ( )
A.无催化剂时,反应不能进行B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 ml·L-1·min-1
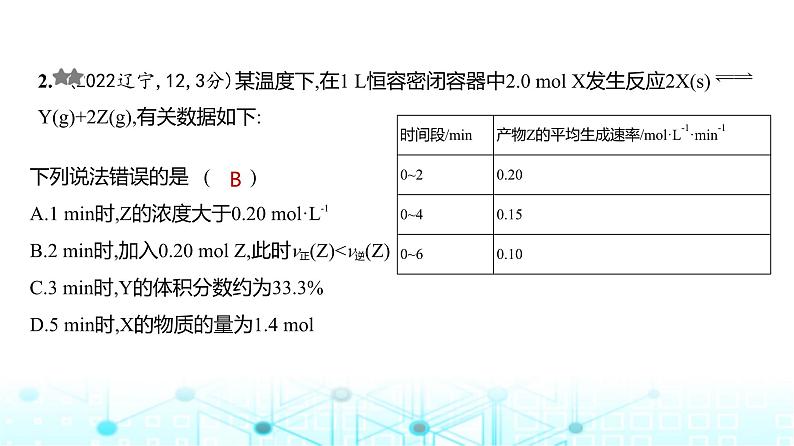
2. (2022辽宁,12,3分)某温度下,在1 L恒容密闭容器中2.0 ml X发生反应2X(s) Y(g)+2Z(g),有关数据如下:
下列说法错误的是 ( )A.1 min时,Z的浓度大于0.20 ml·L-1B.2 min时,加入0.20 ml Z,此时v正(Z)
下列说法正确的是 ( )A.600~1 200 s,生成NO2的平均速率为5.0×10-4 ml·L-1·s-1B.反应2 220 s时,放出的O2体积为11.8 L(标准状况)C.反应达到平衡时,v正(N2O5)=2v逆(NO2)D.推测上表中的x为3 930
4. (2021辽宁,12,3分)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法 错误的是( )
A.其他条件相同时,催化剂浓度越大,反应速率越大B.其他条件相同时,降冰片烯浓度越大,反应速率越大C.条件①,反应速率为0.012 ml·L-1·min-1D.条件②,降冰片烯起始浓度为3.0 ml·L-1时,半衰期为62.5 min
5. (2023北京,4,3分)下列事实能用平衡移动原理解释的是 ( )A.H2O2溶液中加入少量MnO2固体,促进H2O2分解B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深C.铁钉放入浓HNO3中,待不再变化后,加热能产生大量红棕色气体D.锌片与稀H2SO4反应过程中,加入少量CuSO4固体,促进H2的产生
考点2 化学平衡 化学反应的方向
6. (2022天津,6,3分)向恒温恒容密闭容器中通入2 ml SO2和 1 ml O2,反应2SO2(g)+O2(g) 2SO3(g)达到平衡后,再通入一定量O2,达到新平衡时,下列有关判断错误的是 ( )A.SO3的平衡浓度增大B.反应平衡常数增大C.正向反应速率增大D.SO2的转化总量增大
7. (2022海南,8,2分)某温度下,反应CH2 CH2(g)+H2O(g) CH3CH2OH(g)在密闭容器中达到平衡。下列说法正确的是 ( )A.增大压强,v正>v逆,平衡常数增大B.加入催化剂,平衡时CH3CH2OH(g)的浓度增大C.恒容下,充入一定量的H2O(g),平衡向正反应方向移动D.恒容下,充入一定量的CH2 CH2(g),CH2 CH2(g)的平衡转化率增大
8. (2021海南,8,2分)制备水煤气的反应C(s)+H2O(g) H2(g)+CO(g) ΔH>0,下列说法正确的是 ( )A.该反应ΔS<0B.升高温度,反应速率增大C.恒温下,增大总压,H2O(g)的平衡转化率不变D.恒温恒压下,加入催化剂,平衡常数增大
9. (2021辽宁,11,3分)某温度下,在恒容密闭容器中加入一定量X,发生反应2X(s) Y(s)+Z(g),一段时间后达到平衡。下列说法错误的是 ( )A.升高温度,若c(Z)增大,则ΔH>0B.加入一定量Z,达新平衡后m(Y)减小C.加入等物质的量的Y和Z,达新平衡后c(Z)增大D.加入一定量氩气,平衡不移动
10. (2022广东,13,4分)恒容密闭容器中,BaSO4(s)+4H2(g) BaS(s)+4H2O(g)在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是 ( )
A.该反应的ΔH<0B.a为n(H2O)随温度的变化曲线C.向平衡体系中充入惰性气体,平衡不移动D.向平衡体系中加入BaSO4,H2的平衡转化率增大
考点3 化学平衡常数及其相关计算
11. (2023江苏,10,3分)金属硫化物(MxSy)催化反应CH4(g)+2H2S(g) CS2(g)+4H2(g),既可以除去天然气中的H2S,又可以获得H2。下列说法正确的是 ( )
B.该反应的平衡常数K= C.题图所示的反应机理中,步骤Ⅰ可理解为H2S中带部分负电荷的S与催化剂中的M之 间发生作用D.该反应中每消耗1 ml H2S,转移电子的数目约为2×6.02×1023
12. (2020北京,10,3分)一定温度下,反应I2(g)+H2(g) 2HI(g)在密闭容器中达到平衡时,测得c(I2)=0.11 mml·L-1、c(H2)=0.11 mml·L-1、c(HI)=0.78 mml·L-1。相同温度 下,按下列4组初始浓度进行实验,反应逆向进行的是 ( )
(注:1 mml·L-1=10-3 ml·L-1)
13. (2023湖南,13,3分)向一恒容密闭容器中加入1 ml CH4和一定量的H2O,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率按不同投料比x[x= ]随温度的变化曲线如图所示。下列说法错误的是 ( )
A.x1
①下列操作中,能提高CH4(g)平衡转化率的是 (填标号)。A.增加CH4(g)用量B.恒温恒压下通入惰性气体C.移除CO(g)D.加入催化剂
②恒温恒压条件下,1 ml CH4(g)和1 ml H2O(g)反应达平衡时,CH4(g)的转化率为α,CO 2(g)的物质的量为b ml,则反应Ⅰ的平衡常数Kx= [写出含有α、 b的计算式;对于反应mA(g)+nB(g) pC(g)+qD(g),Kx= ,x为物质的量分数]。其他条件不变,H2O(g)起始量增加到5 ml,达平衡时α=0.90,b=0.65,平衡体系中H2 (g)的物质的量分数为 (结果保留两位有效数字)。
考法1 分压平衡常数(Kp)的计算
1. (2022重庆,14,3分)两种酸式碳酸盐的分解反应如下。某温度平衡时总压强分别为p1和p2。
反应1:NH4HCO3(s) NH3(g)+H2O(g)+CO2(g) p1=3.6×104 Pa
反应2:2NaHCO3(s) Na2CO3(s)+H2O(g)+CO2(g) p2=4×103 Pa
该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存 在。下列说法错误的是 ( )A.反应2的平衡常数为4×106 Pa2B.通入NH3,再次平衡后总压强增大C.平衡后总压强为4.36×105 PaD.缩小体积,再次平衡后总压强不变
2. (2023浙江6月选考,19,节选)水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·ml-1
该反应分两步完成:3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH1=-47.2 kJ·ml-12Fe3O4(s)+H2O(g) 3Fe2O3(s)+H2(g) ΔH2
请回答:(1)ΔH2= kJ·ml-1。(2)恒定总压1.70 MPa和水碳比[n(H2O)/n(CO)=12∶5]投料,在不同条件下达到平衡时 CO2和H2的分压(某成分分压=总压×该成分的物质的量分数)如下表:
①在条件1下,水煤气变换反应的平衡常数K= 。②对比条件1,条件2中H2产率下降是因为发生了一个不涉及CO2的副反应,写出该反应 方程式 。
3. (2023新课标,29,15分)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:(1)根据图1数据计算反应 N2(g)+ H2(g) NH3(g)的ΔH= kJ·ml-1。
(2)研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附 位, 表示被吸附于催化剂表面的N2)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为 (填步骤前的标号),理由是 。
(3)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已 知α-Fe属于立方晶系,晶胞参数a=287 pm,密度为7.8 g·cm-3。则α-Fe晶胞中含有Fe的原 子数为 (列出计算式,阿伏加德罗常数的值为NA)。(4)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结 果如图所示。其中一种进料组成为 =0.75、 =0.25,另一种为 =0.675、 =0.225、xAr=0.10。(物质i的摩尔分数:xi=ni/n总)
图3 图4
①图中压强由小到大的顺序为 ,判断的依据是 。②进料组成中含有惰性气体Ar的图是 。
③图3中,当p2=20 MPa、 =0.20时,氮气的转化率α= 。该温度时,反应 N2(g)+ H2(g) NH3(g)的平衡常数Kp= MPa-1(化为最简式)。
4. (2023全国乙,28,14分)硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:(1)在N2气氛中,FeSO4·7H2O的脱水热分解过程如图所示:
根据上述实验结果,可知x= ,y= 。(2)已知下列热化学方程式:FeSO4·7H2O(s) FeSO4(s)+7H2O(g) ΔH1=a kJ·ml-1FeSO4·xH2O(s) FeSO4(s)+xH2O(g) ΔH2=b kJ·ml-1FeSO4·yH2O(s) FeSO4(s)+yH2O(g) ΔH3=c kJ·ml-1
则FeSO4·7H2O(s)+FeSO4·yH2O(s) 2(FeSO4·xH2O)(s)的ΔH= kJ·ml-1。(3)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ)
平衡时 ~T的关系如下图所示。660 K时,该反应的平衡总压p总= kPa,平衡常数Kp(Ⅰ)= (kPa)2。Kp(Ⅰ)随反应温度升高而 (填“增大”“减小” 或“不变”)。
(4)提高温度,上述容器中进一步发生反应2SO3(g) 2SO2(g)+O2(g)(Ⅱ),平衡时 =
(用 、 表示)。在929 K时,p总=84.6 kPa, =35.7 kPa,则 = kPa,Kp(Ⅱ)= kPa(列出计算式)。
5. (2023河北,12,3分)在恒温恒容密闭容器中充入一定量W(g),发生如下反应:
考法2 反应速率常数的应用
反应②和③的速率方程分别为v2=k2c2(X)和v3=k3c(Z),其中k2、k3分别为反应②和③的速 率常数,反应③的活化能大于反应②。测得W(g)的浓度随时间的变化如下表。
下列说法正确的是 ( )A.0~2 min内,X的平均反应速率为0.080 ml·L-1 ·min-1 B.若增大容器容积,平衡时Y的产率增大C.若k2=k3,平衡时c(Z)=c(X) D.若升高温度,平衡时c(Z)减小
6. (双选)(2022河北,13,4分)恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为①X Y;②Y Z。反应①的速率v1=k1c(X),反应②的速率v2=k2c(Y),式中k1、k2为速率常数。图a为该体系中X、Y、Z浓度随时间变化的曲线,图b为反应① 和②的lnk~ 曲线。下列说法错误的是 ( )
A.随c(X)的减小,反应①、②的速率均降低B.体系中v(X)=v(Y)+v(Z)C.欲提高Y的产率,需提高反应温度且控制反应时间D.温度低于T1时,总反应速率由反应②决定
7. (2021河北,13,4分)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N X+Y;②M+N X+Z。反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随 时间变化情况如图。下列说法错误的是 ( )
A.0~30 min时间段内,Y的平均反应速率为6.67×10-3ml·L-1·min-1B.反应开始后,体系中Y和Z的浓度之比保持不变C.如果反应能进行到底,反应结束时62.5%的M转化为ZD.反应①的活化能比反应②的活化能大
8. (2021重庆,12,3分)甲异腈(CH3NC)在恒容密闭容器中发生异构化反应:CH3NC(g) CH3CN(g)。反应过程中甲异腈浓度c随时间t的变化曲线如图所示(图中T为温度)。该反应的反应速率v与c的关系为v=kc,k为速率常数(常温下为常数),a点和b点反 应速率相等,即v(a)=v(b)。下列说法错误的是 ( )
A.bf段的平均反应速率为1.0×10-4 ml/(L·min)B.a点反应物的活化分子数多于d点C.T1>T2D.3v(d)=2v(e)
9. (2022辽宁,17,节选)某合成氨速率方程为v=kcα(N2)cβ(H2)cγ(NH3),根据表中数据,Γ= ;
在合成氨过程中,需要不断分离出氨的原因为 。a.有利于平衡正向移动b.防止催化剂中毒c.提高正反应速率
10. (2023重庆,17,节选)(2)一定条件下,银催化剂表面上存在反应:Ag2O(s) 2Ag(s)+ O2(g), 该反应平衡压强pe与温度T的关系如下:
①463 K时的平衡常数Kp= (kPa 。
②起始状态Ⅰ中有Ag2O、Ag和O2,经下列过程达到各平衡状态:
已知状态Ⅰ和Ⅲ的固体质量相等,下列叙述正确的是 (填字母)。A.从Ⅰ到Ⅱ的过程ΔS>0B.pe(Ⅱ)>pe(Ⅲ)C.平衡常数:K(Ⅱ)>K(Ⅳ)D.若体积V(Ⅲ)=2V(Ⅰ),则Q(Ⅰ)= K(Ⅲ)E.逆反应的速率:v(Ⅰ)>v(Ⅱ)=v(Ⅲ)>v(Ⅳ)
③某温度下,向恒容容器中加入Ag2O,分解过程中反应速率v(O2)与压强p的关系为v(O2) =k(1- ),k为速率常数(定温下为常数)。当固体质量减少4%时,逆反应速率最大。若转化率为14.5%,则v(O2)= (用k表示)。
考法3 多重平衡体系的分析与计算
11. (2023福建,13,节选)探究甲醇对丙烷制丙烯的影响。
丙烷制烯烃过程主要发生的反应有ⅰ.C3H8(g) C3H6(g)+H2(g) ΔH1=+124 kJ·ml-1 ΔS1=127 J·K-1·ml-1 ⅱ.C3H8(g) C2H4(g)+CH4(g) ΔH2=+82 kJ·ml-1 ΔS2=135 J·K-1·ml-1 ⅲ.C3H8(g)+2H2(g) 3CH4(g) ΔH3=-120 kJ·ml-1 ΔS3=27.5 J·K-1·ml-1
已知:Kp为用气体分压表示的平衡常数,分压=物质的量分数×总压。(1)比较反应自发进行(ΔG=ΔH-TΔS<0)的最低温度,反应ⅰ 反应ⅱ(填“>”或 “<”)。(2)在0.1 MPa,t ℃下,丙烷单独进料时,平衡体系中各组分的体积分数φ见下表。
②从初始进料到体系达平衡时,反应ⅰ、ⅱ、ⅲ消耗丙烷的平均速率从大到小的顺序 为反应 >反应 >反应 (填标号)。
③平衡体系中检测不到H2,可认为存在反应:3C3H8(g) 2C3H6(g)+3CH4(g) Kp。下列相关说法正确的是 (填标号)。a.Kp= · b.Kp= (MPa)2c.使用催化剂,可提高丙烯的平衡产率d.平衡后再通入少量丙烷,可提高丙烯的体积分数
④由表中数据推算:丙烯选择性= ×100%= (列出计算式)。(3)丙烷、甲醇共进料时,还发生反应:ⅳ.CH3OH(g) CO(g)+2H2(g) ΔH4=+91 kJ·ml-1
在0.1 MPa、t ℃下,平衡体系中各组分体积分数与进料比的关系如图所示。
①进料比n(丙烷)∶n(甲醇)=1时,体系总反应:C3H8(g)+CH3OH(g) CO(g)+3CH4(g) ΔH= kJ·ml-1
②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是 。
12. (2020山东,18,节选)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·ml-1Ⅱ.CO(g)+2H2(g) CH3OH(g) ΔH2=-90.4 kJ·ml-1Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
回答下列问题:(2)一定条件下,向体积为V L的恒容密闭容器中通入1 ml CO2和3 ml H2发生上述反 应,达到平衡时,容器中CH3OH(g)为a ml, CO为b ml,此时H2O(g)的浓度为 ml·L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为 。
答案
13. (2023湖南,16,14分)聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。Ⅰ.苯乙烯的制备(1)已知下列反应的热化学方程式:①C6H5C2H5(g)+ O2(g) 8CO2(g)+5H2O(g) ΔH1=-4 386.9 kJ·ml-1②C6H5CH CH2(g)+10O2(g) 8CO2(g)+4H2O(g) ΔH2=-4 263.1 kJ·ml-1③H2(g)+ O2(g) H2O(g) ΔH3=-241.8 kJ·ml-1
计算反应④C6H5C2H5(g) C6H5CH CH2(g)+H2(g)的ΔH4= kJ·ml-1;(2)在某温度、100 kPa下,向反应器中充入1 ml气态乙苯发生反应④,其平衡转化率为 50%,欲将平衡转化率提高至75%,需要向反应器中充入 ml水蒸气作为稀释 气(计算时忽略副反应);(3)在913 K、100 kPa下,以水蒸气作稀释气、Fe2O3作催化剂,乙苯除脱氢生成苯乙烯 外,还会发生如下两个副反应:⑤C6H5C2H5(g) C6H6(g)+CH2 CH2(g)⑥C6H5C2H5(g)+H2(g) C6H5CH3(g)+CH4(g)
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S(S= ×100%)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是 ,理由是 ;
(4)关于本反应体系中催化剂Fe2O3的描述错误的是 ;A.X射线衍射技术可测定Fe2O3晶体结构B.Fe2O3可改变乙苯平衡转化率C.Fe2O3降低了乙苯脱氢反应的活化能D.改变Fe2O3颗粒大小不影响反应速率
Ⅱ.苯乙烯的聚合苯乙烯聚合有多种方法,其中一种方法的关键步骤是某Cu(Ⅰ)的配合物促进C6H5CH2X (引发剂,X表示卤素)生成自由基C6H5 H2,实现苯乙烯可控聚合。(5)引发剂C6H5CH2Cl、C6H5CH2Br、C6H5CH2I中活性最高的是 ;(6)室温下,①Cu+在配体L的水溶液中形成[Cu(L)2]+,其反应平衡常数为K;②CuBr在水中 的溶度积常数为Ksp。由此可知,CuBr在配体L的水溶液中溶解反应的平衡常数为 (所有方程式中计量系数关系均为最简整数比)。
答案 (1)+118(2)5(3)甲苯 随着反应④进行,c(H2)增大,导致反应⑥速率加快,甲苯的选择性提高(4)BD (5)C6H5CH2I (6)K·Ksp
1. (2024届重庆9月月考,10)将4 ml A和2 ml B在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 ml·L-1,现有下列几种说法,其中错误的是 ( )
①用物质A表示的反应的平均速率为0.6 ml·L-1·s-1
②反应速率分别表示为v(A)、v(B)、v(C),则2v(A)=v(B)③2 s时物质A的转化率为30%④2 s时物质B的浓度为0.7 ml·L-1A.①② B.①③ C.②③ D.③④
2. (2024届内蒙古呼和浩特质检一,14)某研究人员通过测定不同条件下的化学反应速率得到以下两组数据(Ea为反应活化能)
基于数据分析和平衡原理,以下认识错误的是( )A.该实验的目的是对比温度和活化能对化学反应速率的影响程度B.其他条件相同时,温度升高,化学反应速率加快C.对于吸热反应,温度升高对于放热方向的反应速率影响较大D.一般离子反应的活化能接近于零,所以反应速率很快
3. (2023江西吉安三中一模,12)室温下,气体M、N、P、Q之间存在如下转化关系:①M N+P;②M N+Q。反应①的速率可表示为v1=k1c(M),反应②的速率可表示为v2=k2c(M)(k1、k2为速率常数)。在容积为10 L的密闭容器中,反应体系中组分M、P 的物质的量随时间的变化如下表所示:
下列说法正确的是 ( )A.0~3 min时间段内,Q的平均反应速率为0.15 ml·L-1·min-1B.反应开始后,体系中P和Q的浓度之比保持不变C.平衡时M生成Q的转化率为36%D.反应①的活化能比反应②的活化能低
4.(2024届河北石家庄精英中学期中,19)一定温度下,密闭容器中发生反应:A(s)+3B(g) C(g)+2D(g) ΔH<0。下列图示与对应的叙述相符的是 ( )
A.t1时,减小C的浓度 B.纵坐标表示生成物含量C.t1时,一定使用了催化剂 D.纵坐标表示反应物转化率
5. (2023天津和平三模,10)通过催化还原,可将汽车尾气中的有害气体转化为无害气体,对应的原理为2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=-746.5 kJ·ml-1。下列说法正确的是 ( )A.该反应在任何条件下都能自发进行B.反应的平衡常数可表示为K= C.其他条件不变,增大 的值,NO的转化率下降D.使用高效的催化剂可以降低反应的焓变
6. (2024届广西南宁二中、柳铁一中9月调研,12)反应Fe3++SCN- Fe(SCN)2+(红色),一定温度下达到平衡时,c(Fe3+)=0.04 ml·L-1,c(SCN-)=0.1 ml·L-1,c[Fe(SCN)2+]=0.68 ml·L-1。下列说法不正确的是 ( )A.加入固体KSCN后,平衡正向移动B.加水稀释,溶液颜色变浅,据此判断平衡逆向移动C.该温度下,反应的平衡常数K=170D.加入铁粉,平衡逆向移动
7.(2024届北京朝阳期中,10)一定温度下,在2 L的恒容密闭容器中,“甲烷重整”反应 (CH4+H2O CO+3H2)的原理如下。
已知“甲烷重整”反应在不同温度下的化学平衡常数如下表所示:
下列说法不正确的是 ( )A.物质a可能是Fe3O4B.若增大n(CH4)∶n(H2O)的值,则CH4的平衡转化率降低C.CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0D.1 000 ℃,若容器中n(CH4)=n(H2O)=n(H2)=1、n(CO)=2 ml,则反应处于平衡状态
8. (2024届广东湛江部分学校开学考,15)在Fe2O3的催化作用下,向200 ℃的恒温恒容密闭容器中充入1 ml CH4和2 ml NO2,发生反应CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(g),反应过程及能量变化示意图如图所示。下列说法正确的是( )
A.容器内气体的密度不再发生变化时,该反应达到平衡状态B.反应一段时间后(未达平衡),Fe3O4会远远多于Fe2O3C.起始条件相同,其他条件不变,仅改为绝热密闭容器,CH4和NO2的转化率降低D.使用更高效的催化剂能提高该反应平衡时的转化率
9. (2024届河北泊头一中开学考,11)将a ml X、Y混合气体(物质的量之比为1∶1)加入某容积可变的密闭容器中,发生反应:mX+nY qZ。保持一定温度,改变压强分别达到平衡时,测得不同压强下气体X的物质的量浓度如下表所示:
下列说法正确的是 ( )A.保持一定温度,增大压强,平衡正向移动B.当压强为3×106 Pa时,此反应的平衡常数表达式为Kp= C.2×105 Pa时X的平衡转化率大于5×105 Pa时X的平衡转化率D.当压强为2×105 Pa时,若再向体系中加入b ml Y,重新达到平衡时,体系中气体总物 质的量为(a+b) ml
10. (2024届福建三明一中开学考,7)在催化剂作用下,向容积为1 L的容器中加入1 ml X和3 ml Y,发生反应X(g)+2Y(g) 2Z(s),平衡时和反应10 min时X的转化率[α(X)]随温度的变化分别如曲线Ⅰ、Ⅱ所示。下列说法错误的是 ( )
A.该反应ΔH>0B.200 ℃时,前10 min的平均反应速率v(X)=0.02 ml·L-1·min-1C.400 ℃时,反应的平衡常数K=2D.ab段变化可能是随温度升高反应速率加快,bc段变化可能是催化剂在温度高于400 ℃时活性降低导致
11. (2024届河南安阳一调,18)CO、NOx均是大气污染物,在适当条件下CO可将NOx还原为相应的单质,从而消除其对大气的污染。(1)已知:ⅰ.2NO2(g)+4CO(g) N2(g)+4CO2(g) ΔH1=-869 kJ·ml-1ⅱ.2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH2=-747 kJ·ml-1
①反应ⅲ.NO2(g)+CO(g) NO(g)+CO2(g) ΔH3,则ΔH3= 。
②反应ⅱ的平衡常数为K2,则lgK2与温度的倒数 的变化关系符合图中的直线 (填“a”或“b”)。
(2)T K下,向初始压强(3.3 MPa)、容积(10 L)均相等的A、B两个密闭容器中分别充入4 ml NO2(g)、x ml CO(g),维持容器A容积不变、容器B压强不变使其仅发生反应ⅰ,x =8时测得容器B中NO2(g)的转化率随时间的变化如图所示:
①在图中作出容器A中反应从开始到达到平衡时NO2转化率的变化曲线(只画变化趋 势,不用标出具体数值)。
②当x=8时,0~5 min内容器B中v(CO)= MPa·min-1,反应ⅰ的平衡常数Kp= (结果保留两位有效数字)。当x 8(填“>”或“<”)时CO的平衡 转化率大于50%。③若容器B中还存在反应ⅲ,则T K时,容器B中反应ⅰ的平衡常数Kp (填 “增大”“减小”或“不变”)。
答案 (1)①-61 kJ·ml-1 ②a(2)① ②0.2 0.83 < ③不变
12. (2023吉林白山四模,28)我国科研团队发现了一种具有超高稳定性的一维钯银合金纳米线催化剂,能高选择性、高稳定性地将CO2还原成甲酸(HCOOH)。化学反应 为CO2(g)+H2(g) HCOOH(g) ΔH。(1)已知:①2HCOOH(g)+O2(g) 2CO2(g)+2H2O(g) ΔH1=-a kJ·ml-1②H2(g)+ O2(g) H2O(g) ΔH2=-b kJ·ml-1(a>2b>0);CO2(g)+H2(g) HCOOH(g) ΔH= kJ·ml-1。(2)在某催化剂作用下,CO2(g)+H2(g) HCOOH(g)的速率方程为v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH)(k正、k逆为速率常数,只与温度、催化剂有关,与浓度无关)。若在某温 度下,k正=4k逆,则该反应的平衡常数K= 。加入催化剂,k正增大的倍数
(填“大于”“小于”或“等于”)k逆增大的倍数。(3)CO2催化氢化制甲酸的反应历程图(M为过渡金属)如下图所示。
上述循环中,M(CO)4PR3是 (填“催化剂”或“中间产物”)。(4)在反应器中充入CO2和H2,发生反应CO2(g)+H2(g) HCOOH(g)。化学反应速率随时间的变化关系如下图所示。
反应2:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0
测得CO2的平衡转化率、CH3OH的选择性(CH3OH的选择性等于CH3OH的物质的量与 CO2转化的物质的量之比)与温度的关系如下图所示。
①其他条件不变,升高温度,CO2的平衡转化率增大的原因是 。
1. (2023湖北黄冈中学二模,15)T ℃时,向容积为2 L的刚性容器中充入1 ml CO2和一定量的H2发生反应:CO2(g)+2H2(g) HCHO(g)+H2O(g)。达到平衡时,HCHO的分压(分压=总压×物质的量分数)与起始 的关系如图所示。已知:初始加入2 ml H2时,容器内气体的总压为1.2p kPa。下列说法正确的是 ( )
2. (2024届河北精英中学二调,27)氨的用途十分广泛,如氨是制造硝酸和氮肥的重要原料。工业合成氨是人类科学技术的一项重大突破。回答下列问题:(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。
在合成氨的基元反应中,决速步骤的能垒为 kJ· ml-1。(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是 (填选 项序号)。①v(N2)=0.5 ml·L-1·min-1②v(H2)=0.02 ml·L-1·s-1③v(NH3)=0.4 ml·L-1·min-1④v(NH3)=0.02 ml·L-1·s-1(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是 (填选项字母)。
(4)一定温度下,向2 L恒容密闭容器中充入0.4 ml N2、1.2 ml H2发生反应,NH3的浓度 随时间变化情况如下表所示:
0~10 min内,用H2表示的平均反应速率为 ;实验测得体系平衡时的压强为10 MPa,则该反应的平衡常数Kp= MPa-2(用分数表示,Kp为分压表示的平衡常数, 分压=总压×体积分数);若维持温度不变,向另一2 L恒容密闭容器中充入H2、N2和NH3 各4 ml时,该反应的v正 v逆(填“>”“<”或“=”)。
答案 (1)352 (2)④①②③ (3)BD (4)0.021 ml·L-1·min-1 >
3. (2023辽宁沈阳二中第6次模拟,12)某反应A(g)+B(g) C(g)+D(g)的速率方程为v=k·cm(A)·cn(B),其半衰期(当剩余的反应物恰好是起始的一半时所需的时间)为 。当其他条件不变,改变反应物浓度时,反应的瞬时速率如下表所示:
下列说法正确的是 ( )A.该反应的速率方程中的m=n=1B.该反应的速率常数k=6.4×10-2min-1C.表格中的c1=0.75,v1=6.4×10-3,v2=12.8×10-3D.在过量的B存在时,反应掉93.75%的A所需的时间是500 min
4. (双选)(2024届山东日照高三开学考,14)已知反应2CO(g)+4H2(g) C2H4(g)+2H2O(g),ΔH>0。在一定条件下存在v正(H2)=k1·c2(CO)c4(H2),v逆(H2O)=k2·c(C2H4)c2(H2O),反应速率随温度的变化如图所示。下列说法错误的是 ( )
A.a为v正(H2)B.T2℃时,v正(CO)=1.05 ml·L-1·min-1C.T3℃和T4℃时反应均达到平衡状态D.K=k1/k2
5. (2023湖南郴州三模,11)在T1 ℃和T2 ℃(T1
6.(2024届重庆巴蜀中学11月适应考,17,节选)(3)向恒压(3.0 MPa)密闭装置中通入1 ml CO2和2 ml H2反应生成甲醇,在不同催化剂下测定甲醇的平均生成速率随温度的变 化曲线如下。
答案 ②可能是催化剂活性降低,也可能是平衡逆向移动,使甲醇平均生成速率降低 ③2
7. (2024届辽宁东北育才中学三模,10)工业上用CO2和H2合成甲醇涉及以下反应:
反应Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
反应Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
在催化剂作用下,将1 ml CO2和2 ml H2的混合气体充入一恒容密闭容器中进行反应, 达到平衡时,CO2的转化率和容器中混合气体的平均相对分子质量随温度变化如图。 下列判断正确的是 ( )
已知:平衡时甲醇的选择性为生成甲醇消耗的CO2在CO2总消耗量中的占比。A.ΔH2<0B.T ℃,平衡时甲醇的选择性为40%C.T ℃,反应Ⅱ的平衡常数K= D.为同时提高CO2的平衡转化率和平衡时甲醇的选择性,应选择的反应条件为高温、高压
8. (2024届重庆八中月考三,17,节选)“碳达峰”“碳中和”是推动我国经济社会高质量发展的内在要求。通过二氧化碳催化加氢合成二甲醚是一种重要的转化方法, 其过程如下:
反应Ⅰ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH1=-122.5 kJ/ml
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ/ml
回答下列问题:(1)反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的ΔH= 。(2)二氧化碳与氢气合成CH3OCH3时,通常控制温度为500 ℃左右,其可能的原因为 (填字母)。A.反应速率快B.平衡的转化率高C.催化剂活性高D.主反应催化剂选择性好(3)在1 L恒温密闭容器中充入4 ml CO2和6 ml H2,初始压强为p,20 min时反应Ⅰ、Ⅱ
都达到平衡状态,体系压强为0.8p,测得c(H2O)=3 ml/L。①0~20 min内v(CO)= 。②反应Ⅱ的化学平衡常数Kp= 。
③平衡时CH3OCH3的选择性= 。(CH3OCH3的选择性可表示为 ×100%)(4)在密闭容器中通入1 ml CO2和3 ml H2,在铁系催化剂作用下进行反应,CO2的平衡 转化率随温度和压强的变化如图所示。图中,温度大于800 ℃时,随着压强的增大,CO2 的平衡转化率减小,请解释原因: 。
答案 (1)-204.9 kJ/ml(2)ACD(3)①0.075 ml/(L·min) ②2 ③40%(4)温度大于800 ℃时,以反应Ⅱ为主,压强增大平衡不移动,但压强增大反应Ⅰ平衡正 向移动,水蒸气浓度增大,CO2、H2浓度减小,从而导致反应Ⅱ平衡逆移,故二氧化碳的 平衡转化率减小
1. (双选)(2023海南,13,4分)工业上苯乙烯的生产主要采用乙苯脱氢工艺:C6H5CH2CH3(g) C6H5CH CH2(g)+H2(g)。某条件下无催化剂存在时,该反应的正、逆反应速率v随时间t的变化关系如图所示。下列说法正确的是 ( )
A.曲线①表示的是逆反应的v-t关系B.t2时刻体系处于平衡状态C.反应进行到t1时,Q>K(Q为浓度商)D.催化剂存在时,v1、v2都增大
微专题 反应速率和平衡图像分析
2. (2022浙江1月选考,19,2分)在恒温恒容条件下,发生反应A(s)+2B(g) 3X(g),c(B)随时间的变化如图中曲线甲所示。下列说法不正确的是 ( )
A.从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率B.从b点切线的斜率可求得该化学反应在反应开始时的瞬时速率C.在不同时刻都存在关系:2v(B)=3v(X)D.维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,c(B)随时间变化 关系如图中曲线乙所示
3. (2023河北唐山三模,13)在2 L恒容密闭容器中加入一定量A和B,发生反应aA(g)+bB(g) cC(g)。100 ℃时容器中A、B、C的物质的量随时间的变化关系如图1所示。不同温度下平衡时C的体积分数与A、B起始时的投料比的变化关系如图2所 示。下列结论正确的是 ( )
A.100 ℃时前5 min平均化学反应速率:v(A)=0.04 ml·L-1·min-1B.100 ℃时达到平衡的体系中充入少量C(g),达新平衡前v(逆)>v(正)C.aA(g)+bB(g) cC(g) ΔH>0
D.某温度下平衡时B的转化率随起始 的增大而先增大后减小
4. (2021广东,14,4分)反应X 2Z经历两步:①X Y;②Y 2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是 ( )
A.a为c(X)随t的变化曲线B.t1时,c(X)=c(Y)=c(Z)C.t2时,Y的消耗速率大于生成速率D.t3后,c(Z)=2c0-c(Y)
5. (2024届重庆万州二中8月月考,8)向体积恒定的2 L密闭容器中加入CO(g)和H2O(g)各1 ml,发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。反应分别在不同的温度和催化剂下进行,保持其他初始实验条件不变,经10 min测得CO的转化率如图所示, T2℃下两曲线相交。下列说法正确的是( )
A.相同条件下,催化剂2比催化剂1的效率高B.在A点时,反应一定未达到平衡C.C点时,两种催化剂下反应速率相同,用水蒸气表示速率为v(H2O)=0.02 ml·L-1·min-1D.增大压强对该反应的速率无影响
6. (2024届江苏如皋期初考,13)碳热还原氧化锌反应可用于循环制氢。碳热还原氧化锌的主要反应如下:
反应Ⅰ ZnO+CO Zn+CO2;
反应Ⅱ CO2+C 2CO
在不同容器中分别发生反应Ⅰ、反应Ⅱ,不同压强(p1或p2)下分别达平衡时,两个反应 中c(CO)/c(CO2)随温度变化的关系如图所示。
下列说法正确的是 ( )A.压强大小:p1>p2B.在如图所示条件下,反应Ⅰ可表示为ZnO(s)+CO(g) Zn(s)+CO2(g) ΔH<0C.选择反应Ⅱ的c(CO)/c(CO2)小于反应Ⅰ的条件,将C与ZnO置于同一密闭容器中,碳热 还原氧化锌反应能顺利进行D.一定条件下将C与ZnO置于同一密闭容器中反应,当n(C)/n(ZnO)<1时,增大n(C)/n(ZnO)的值,可减少平衡时气体中CO2的含量
7. (2023北京西城二模,14)中国科学家首次用C60改性铜基催化剂,将草酸二甲酯加氢制乙二醇的反应条件从高压降至常压。草酸二甲酯加氢的主要反应有:① (g)+2H2 CH3OH(g)+ (g)②CH3OOCCH2OH(g)+2H2(g) CH3OH(g)+HOCH2CH2OH(g)③HOCH2CH2OH(g)+H2(g) H2O(g)+C2H5OH(g)
其他条件相同时,相同时间内温度对产物选择性的影响结果如图所示。
已知:ⅰ.物质B的选择性S(B)= ×100%ⅱ.450~500 K,反应③的平衡常数远大于反应①和反应②的平衡常数
下列说法不正确的是 ( )A.制乙二醇适宜的温度范围是470~480 KB.实验条件下反应③的活化能最高,升温更有利于反应③C.减压可提高乙二醇的平衡产率D.铜基催化剂用C60改性后反应速率增大,可以降低反应所需的压强
8. (2023浙江6月选考,14,3分)一定条件下,1-苯基丙炔( )可与HCl发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反 应),下列说法不正确的是 ( )
A.反应焓变:反应Ⅰ>反应ⅡB.反应活化能:反应Ⅰ<反应ⅡC.增加HCl浓度可增加平衡时产物Ⅱ和产物Ⅰ的比例D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
9. (2022北京,14,3分)CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,将恒定组成的N2、CH4混合气,以恒定流速通入反应 器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始 终未检测到CO2,在催化剂上检测到有积炭。下列说法不正确的是 ( )
10. (2023重庆,14,3分)逆水煤气变换体系中存在以下两个反应:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g)
反应Ⅱ:CO2(g)+4H2(g) CH4(g)+2H2O(g)
在恒容条件下,按V(CO2)∶V(H2)=1∶1投料比进行反应,平衡时含碳物质体积分数随温 度的变化如图所示。下列说法正确的是 ( )
A.反应Ⅰ的ΔH<0,反应Ⅱ的ΔH>0B.M点反应Ⅰ的平衡常数K<1C.N点H2O的压强是CH4的3倍D.若按V(CO2)∶V(H2)=1∶2投料,则曲线之间交点位置不变
11. (2023江苏,13,3分)二氧化碳加氢制甲烷过程中的主要反应为CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH=-164.7 kJ·ml-1CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.2 kJ·ml-1
在密闭容器中,1.01×105 Pa、n起始(CO2)∶n起始(H2)=1∶4时,CO2平衡转化率、在催化剂 作用下反应相同时间所测得的CO2实际转化率随温度的变化如图所示。CH4的选择性 可表示为 ×100%。下列说法正确的是 ( )
B.CH4的平衡选择性随着温度的升高而增加C.用该催化剂催化二氧化碳反应的最佳温度范围约为480~530 ℃D.450 ℃时,提高 的值或增大压强,均能使CO2平衡转化率达到X点的值
A.反应2CO(g)+2H2(g) CO2(g)+CH4(g)的焓变ΔH=-205.9 kJ·ml-1
12. (双选)(2023山东,14,4分)一定条件下,化合物E和TFAA合成H的反应路径如下:
相关课件
浙江版高考化学复习专题一0一化学反应速率和化学平衡教学课件:
这是一份浙江版高考化学复习专题一0一化学反应速率和化学平衡教学课件,共49页。
浙江版高考化学复习专题一0化学反应与电能练习课件:
这是一份浙江版高考化学复习专题一0化学反应与电能练习课件,共60页。
浙江版高考化学复习专题一物质的分类及转化练习课件:
这是一份浙江版高考化学复习专题一物质的分类及转化练习课件,共22页。PPT课件主要包含了考点2物质的转化等内容,欢迎下载使用。








