



新高考化学复习专题九化学反应的热效应教学课件
展开考点1 化学反应中的能量变化1.反应热和焓变(1)反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反 应的热效应,简称反应热。(2)焓变:在等压条件下进行的化学反应,其反应热等于焓变,其符号为ΔH,常用单位是kJ /ml或kJ·ml-1。
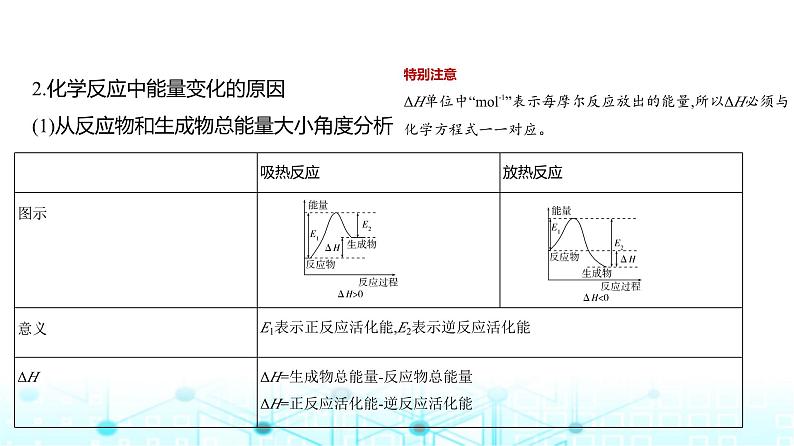
2.化学反应中能量变化的原因(1)从反应物和生成物总能量大小角度分析
特别注意ΔH单位中“ml-1”表示每摩尔反应放出的能量,所以ΔH必须与化学方程式一一对应。
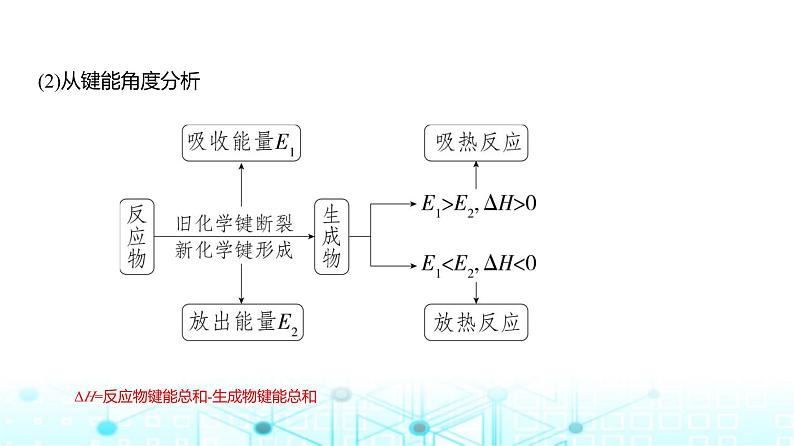
ΔH=反应物键能总和-生成物键能总和
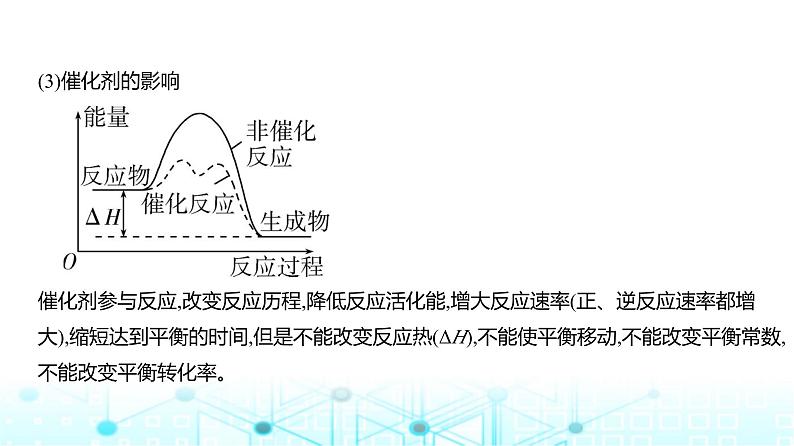
(3)催化剂的影响 催化剂参与反应,改变反应历程,降低反应活化能,增大反应速率(正、逆反应速率都增 大),缩短达到平衡的时间,但是不能改变反应热(ΔH),不能使平衡移动,不能改变平衡常数,不能改变平衡转化率。
(4)常见的吸热、放热反应吸热反应:①大多数分解反应;②盐类的水解;③Ba(OH)2·8H2O与NH4Cl的反应;④C和水 蒸气、C和CO2的反应等。放热反应:①可燃物的燃烧;②中和反应;③大多数化合反应;④金属与酸的置换反应;⑤ 缓慢氧化等。
注意 ①测定燃烧热时可燃物中元素对应的指定产物,如C→CO2(g),H→H2O(l),S→SO2(g),N→N2(g)等。②在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 ml H2O时,放出57.3 kJ的热量。
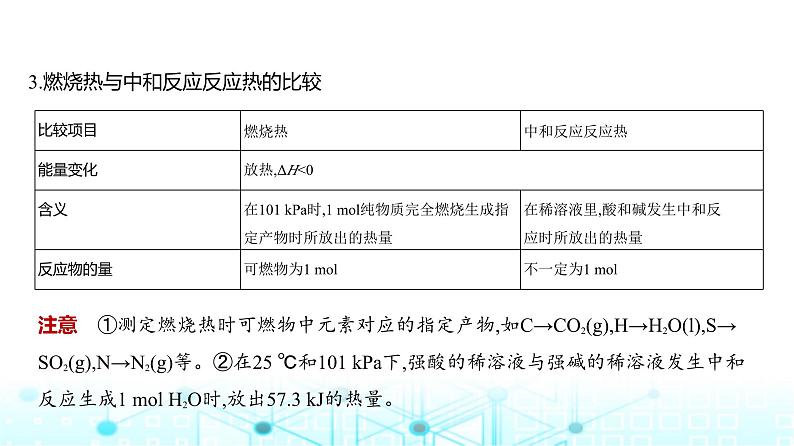
3.燃烧热与中和反应反应热的比较
考点2 热化学方程式 盖斯定律1.热化学方程式(1)意义:表明了化学反应中的物质变化和能量变化。例如2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·ml-1,表示25 ℃和101 kPa下,2 ml氢气和1 ml氧气反应生成2 ml液态 水时放出571.6 kJ的热量。(2)书写要求①写出正确的化学方程式,注明反应的温度和压强(25 ℃、101 kPa下的反应可不注明)。②注明各物质的聚集状态:固态(s)、液态(l)、气态(g)、水溶液(aq),不用“↑”和“↓”。
③热化学方程式中各物质前的化学计量数可以是整数也可以是分数。注意 无论化学反应是否可逆,热化学方程式中的ΔH都表示反应进行到底时的能量变化。归纳总结“五审”法判断热化学方程式的正误
2.盖斯定律(1)内容:不管化学反应是一步完成还是分几步完成,其反应热是相同的,即化学反应的 反应热只与反应体系的始态和终态有关,而与反应的途径无关。
(2)应用:有些反应很难直接测其反应热,可用盖斯定律间接计算。
1.判断正误(正确的打“√”,错误的打“×”)。(1)同温同压下,反应H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的ΔH不同。( )(2)已知H+(aq)+OH-(aq) H2O(l) ΔH=-57.3 kJ·ml-1,则Ba(OH)2和盐酸反应的反应热ΔH=2×(-57.3) kJ·ml-1。( )(3)500 ℃、30 MPa下,将0.5 ml N2和1.5 ml H2置于密闭容器中充分反应生成NH3(g), 放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·ml-1。 ( )
2.在测定中和反应反应热的实验中,下列说法正确的是 ( )A.酸、碱溶液应沿玻璃棒分三次倒入小烧杯B.用铜棒代替环形玻璃搅拌棒,会使测得的反应热的绝对值偏大C.用0.55 ml/L的NaOH溶液分别与0.5 ml/L的盐酸、醋酸溶液反应,所取溶液体积相 等,则测得的反应热数值相同D.测量终止温度时,应当记录混合溶液的最高温度
3.在25 ℃和101 kPa的条件下,1 ml H2(g)和1 ml Cl2(g)完全反应生成HCl(g)的能量变 化如图所示,下列说法不正确的是 ( )
A.H—H键的键能为436 kJ·ml-1B.生成1 ml HCl(g)释放431 kJ的能量C.该反应的热化学方程式:H2(g)+Cl2(g) 2HCl(g) ΔH=-862 kJ·ml-1D.共价键断裂和形成时的能量变化是该化学反应能量变化的主要原因
4.(双选)下列图像分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是 ( )A.石墨转变为金刚石是放热反应B.S(g)+O2(g) SO2(g) ΔH1,S(s)+O2(g) SO2(g) ΔH2,则ΔH1<ΔH2C.白磷比红磷稳定D.CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0
5.假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的转化如图所示。下列 说法不正确的是 ( )
A.|ΔH1|一定大于|ΔH2|B.|ΔH1|<|ΔH3|C.ΔH1+ΔH2+ΔH3=0D.甲→丙过程的ΔH=ΔH1+ΔH2
6.N2H4是一种高效清洁的火箭燃料。已知在25 ℃、101 kPa下,8 g N2H4(g)完全燃烧生 成N2(g)和H2O(l)时,放出133.5 kJ热量。写出表示N2H4(g)燃烧热的热化学方程式: 。
考法1 反应热的计算方法与大小比较一、计算反应热的常用方法1.根据反应物和生成物的能量计算ΔH=生成物的总能量-反应物的总能量2.根据反应物和生成物的键能计算ΔH=反应物的键能总和-生成物的键能总和3.根据反应的活化能计算ΔH=正反应的活化能-逆反应的活化能4.根据盖斯定律计算
注意 ①热化学方程式乘以某一个数时,反应热的数值也必须乘上该数。②将一个热化学方程式颠倒时,ΔH的“+”“-”随之改变,但绝对值不变。③热化学方程式相加减时,物质之间相加减,反应热也必须相加减。
例1 (2023重庆凤鸣山中学5月月考,10)甲醇是重要的化工原料,工业上由CO、CO2和H2 合成甲醇的主要反应如下:Ⅰ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41 kJ·ml-1Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·ml-1Ⅲ.CO(g)+2H2(g) CH3OH(g) ΔH3已知:反应Ⅲ中相关化学键的数据如下表。
则 键的键能a为 ( )A.1 076 B.826 C.779 D.538
解题导引 题表数据中没有CO2的键能数据,则不能通过反应Ⅰ计算 键的键能;但通过反应Ⅲ可以。根据盖斯定律求出ΔH3,再根据ΔH=反应物的总键能-生成物的 总键能,结合表中相关数据计算即可。
解析 反应Ⅲ=反应Ⅱ-反应Ⅰ,根据盖斯定律,ΔH3=ΔH2-ΔH1=-58 kJ·ml-1-41 kJ·ml-1=-99 kJ·ml-1。根据ΔH=反应物的总键能-生成物的总键能,可得a kJ·ml-1+2×436 kJ·ml-1-3×413 kJ·ml-1-343 kJ·ml-1-465 kJ·ml-1=-99 kJ·ml-1,解得a=1 076。
例2 (2023河北石家庄一模,17,节选)二甲醚是重要的有机合成原料。工业上常用合成 气(主要成分为CO、H2)制备二甲醚,其主要反应如下:反应ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1反应ⅱ:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·ml-1反应ⅲ:CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2 kJ·ml-1(1)已知298 K时,由稳定态单质生成1 ml化合物的焓变称为该物质的标准摩尔生成焓 (Δf )。几种物质的标准摩尔生成焓如下表所示,据此计算ΔH1= kJ·ml-1。
解题导引 由题干信息知,298 K时,由稳定态单质生成1 ml化合物的焓变为该物质的标准摩尔生成焓,根据此定义写出生成CO、CH3OH的热化学方程式,然后再根据盖 斯定律进行相关计算。
解析 根据题表数据可写出:①C(s)+ O2(g) CO(g) ΔH=-110.5 kJ·ml-1②C(s)+2H2(g)+ O2(g) CH3OH(g) ΔH=-201.2 kJ·ml-1。根据盖斯定律可知,反应ⅰ=②-①,则ΔH1=[-201.2-(-110.5)] kJ·ml-1=-90.7 kJ·ml-1。
答案 -90.7
二、反应热大小的比较1.放热反应和吸热反应的比较:由于ΔH带“+”和“-”,所以吸热反应的反应热大于 放热反应的反应热。2.同一反应,反应物(或生成物)状态不同,常用的比较方法有:①运用盖斯定律直接计算, 有时还需结合物质的聚集状态比较ΔH的大小;②利用能量图进行比较。如:a.2H2(g)+O2(g) 2H2O(g) ΔH1b.2H2(g)+O2(g) 2H2O(l) ΔH2方法一:a-b,可得2H2O(l) 2H2O(g) ΔH=ΔH1-ΔH2>0,则ΔH1>ΔH2。
方法二:在图像上可以看出放出或吸收热量的多少,若是放热反应,放出热量越多,ΔH越 小;若是吸热反应,吸收热量越多,ΔH越大。上述反应a、b均为放热反应,从图中可看出 b放出热量更多,故ΔH2<ΔH1。 3.两个有联系的不同反应,常利用已知知识进行比较。如:
①C(s)+O2(g) CO2(g) ΔH1<0②C(s)+ O2(g) CO(g) ΔH2<0反应①为C的完全燃烧,反应②为C的不完全燃烧,|ΔH1|>|ΔH2|,所以ΔH1<ΔH2。
例3 (2024届陕西部分学校开学考,7)PCl3和PCl5都是重要的化工产品。磷与氯气反应有 如下转化关系。 已知:在绝热恒容密闭容器中发生反应(1)、反应(2),反应体系的温度均升高。
下列叙述正确的是 ( )A.ΔH3=ΔH1+ΔH2B.4PCl3(g)+4Cl2(g) 4PCl5(s) ΔH>ΔH2C.ΔH1、ΔH2、ΔH3中,ΔH3最大D.PCl5分子中每个原子最外层都达到8电子结构
解题导引 进行ΔH大小比较时,要注意ΔH的正、负,若ΔH为负数,则绝对值越大,ΔH越小。
解析 由图知,反应(3)=反应(1)+反应(2),则ΔH3=ΔH1+ΔH2,A项正确;液态PCl3汽化时吸收热量,故ΔH<ΔH2,B项错误;反应(1)和反应(2)均是放热反应,即ΔH1、ΔH2均小于0,ΔH3=ΔH1+ΔH2<0,ΔH3最小,C项错误;PCl5分子中P原子最外层有10个电子,D项错误。
考法2 反应历程图像分析 物质反应历程与能量图像常见类型有以下三种:
1.曲线图式:曲线图中,通过始态与终态的能量高低可以判断反应是吸热还是放热。若有多步反应,活化能最大的那一步是决速步(决定整个反应速率的步骤)。通过能量高低判断物质的稳定性时,能量越低,物质越稳定。2.能垒图式:能垒图中,过渡态左侧相邻物质“爬坡”至过渡态所需的能量即为能垒, 最大能垒对应的步骤即为决速步。
3.循环图式:分析循环图时,重点在于判断反应物、生成物、催化剂、中间产物。一般来说,通过一个箭头进入循环(“只进不出”)的是反应物;通过一个箭头离开循环(“只出不进”)的是生成物;先参加反应,又在后续反应中生成(“有进有出”)的是催化剂;先生成后又消耗掉(“自生自灭”)的是中间产物。
例1 (双选)(2022湖南,12,4分)反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系 如图所示: 下列有关四种不同反应进程的说法正确的是 ( )A.进程Ⅰ是放热反应
B.平衡时P的产率:Ⅱ>ⅠC.生成P的速率:Ⅲ>ⅡD.进程Ⅳ中,Z没有催化作用
解题导引 解读反应进程图像的关键:反应进程Ⅱ、Ⅲ中,X、Y均为催化剂;反应进程Ⅳ中,生成P·Z,Z为反应物。
解析 A项,由题图可知,进程Ⅰ反应物的总能量比生成物的总能量高,为放热反应,正确;B项,从Ⅱ中可看出S+X→P+X,X为催化剂,只改变反应的速率,对平衡产率没有影 响,错误;C项,从Ⅱ和Ⅲ可看出,进程Ⅱ决速步的活化能比进程Ⅲ的小,所以生成P的速 率:Ⅱ>Ⅲ,错误;D项,由题图可知,进程Ⅳ中产物为P·Z,Z为反应物,没有催化作用,正确。
例2 (2023安徽合肥一模,11)下图是我国科研工作者研究MgO(s)与CH4(g)作用最终生成 Mg(s)与CH3OH(g)的相对能量—反应进程曲线。下列叙述错误的是 ( ) A.中间体OMgCH4(s)比MgOCH4(s)更稳定
B.该反应进程中的最大能垒为350.6 kJ·ml-1C.生成HOMgCH3(s)的过程中有极性键的断裂和形成D.总反应的热化学方程式为MgO(s)+CH4(g) Mg(s)+CH3OH(g) ΔH=-146.1 kJ·ml-1
解题导引 解答此题要熟知以下三点:①从能量角度比较物质的稳定性,能量越低,物质越稳定。②同种元素之间形成的共价键为非极性共价键,不同元素之间形成的共 价键为极性共价键;③ΔH只与反应始态和终态有关,与反应过程无关。
解析 结合题图,中间体OMgCH4(s)比MgOCH4(s)能量更低,故更稳定,A项正确;HOMgCH3(s)到过渡态2的能垒最大,为-21.3 kJ·ml-1-(-321.1)kJ·ml-1=299.8 kJ·ml-1,B 项错误;生成HOMgCH3(s)的过程中CH4中C—H键断裂,同时有O—H键生成,C项正确; 根据题给信息和题图都可以得到反应物为MgO(s)、CH4(g),生成物为Mg(s)、CH3OH (g),再根据题图得出始态和终态物质的总能量,进而得出总反应的热化学方程式为 MgO(s)+CH4(g) Mg(s)+CH3OH(g) ΔH=-146.1 kJ·ml-1,D项正确。
例3 (2023湖南株洲一模,8)制备异丁酸甲酯的某种反应机理如图所示:
下列说法不正确的是 ( )A.上述过程的总反应式可表示为CH3OH+CO+CH3CH CH2 (CH3)2CHCOOCH3B.由化合物4转化为化合物6符合“原子经济性”理念C.化合物8和化合物9互为同分异构体D.上述反应过程中HC(CO)3既改变反应的ΔH,又降低了反应的活化能
解题导引 分析循环图时,一般来说,通过一个箭头进入循环的是反应物,通过一个箭头离开循环的是生成物;先参加反应,又在后续反应中生成的是催化剂,先生成后又 消耗的是中间产物。绿色化学的“原子经济性”是指在化学品合成过程中,合成方法 和工艺应被设计成能把反应过程中所用的所有原材料尽可能都转化到最终产物中。 催化剂能改变反应历程,降低反应的活化能,同等程度地加快正、逆反应的速率,但不 能使化学平衡移动,不能改变平衡转化率和反应焓变。
新高考化学复习专题九化学反应的热效应练习课件: 这是一份新高考化学复习专题九化学反应的热效应练习课件,共51页。
人教版高考化学一轮总复习第7章第1节化学反应的热效应课时教学课件: 这是一份人教版高考化学一轮总复习第7章第1节化学反应的热效应课时教学课件,共60页。PPT课件主要包含了环节1课前自主复习,环节2新情境专项练等内容,欢迎下载使用。
2023版高考化学一轮复习新题精练第六章化学反应的热效应课件: 这是一份2023版高考化学一轮复习新题精练第六章化学反应的热效应课件,共53页。PPT课件主要包含了必备知识新题精练,关键能力强化提升,高频易错高效快攻,题组1热化学方程式,情境创新专练,提升素养拓展思维,题型专练创新集训,全章综合训练等内容,欢迎下载使用。












