

2025届高三化学一轮复习课时小练:侯氏制碱法与Na2CO3含量的测定
展开1.实验室可通过沉淀重量法测定样品纯度,按如图装置测定纯碱(含少量NaCl)的纯度,下列说法正确的是( )
A.装置A中试剂应为浓硫酸,C中试剂应为BaCl2溶液
B.在B、C之间应增添盛有饱和NaHCO3溶液的洗气装置,以除去氯化氢气体
C.只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钠的质量分数
D.反应结束后,需经过过滤、洗涤、干燥、称量等操作测定装置C中沉淀质量
2.过碳酸钠(2Na2CO3·3H2O2),有Na2CO3和H2O2的双重性质,可用作漂白剂和氧化剂,能有效杀灭禽流感病毒。合理组合下列装置能用于测定过碳酸钠中碳酸钠的含量,下列说法不正确的是( )
A.连接顺序为装置Ⅲ→Ⅰ→Ⅱ
B.装置b和e中盛放的试剂相同
C.装置d的作用是防止空气中的H2O和CO2进入装置c中
D.若装置b中盛放的是澄清石灰水,只用装置Ⅰ即可验证过碳酸钠与稀硫酸反应是否生成CO2(不考虑空气中CO2的影响)
3.(2023·浙江绍兴阳明中学段考)某固体混合物由Na2CO3和NaHCO3两种物质组成,将其分成X、Y两等份。标准状况下,X溶于足量盐酸,生成CO2的体积为V1 L;Y充分加热、冷却后再溶于足量盐酸,生成CO2的体积为V2 L。下列说法正确的是( )
A.加热,蒸干X与足量盐酸反应后的溶液,可得固体58.5V222.4 g
B.Y充分加热,固体质量减少44(V1-V2)22.4 g
C.X、Y消耗盐酸的物质的量之比为1∶1
D.混合物中Na2CO3和NaHCO3的物质的量之比为2V2-V1V1-V2
4.(2024·江苏溧阳中学模拟)实验室用下列装置模拟侯氏制碱法制取少量NaHCO3固体,不能达到实验目的的是( )
A.装置Ⅰ制取CO2
B.装置Ⅱ中Na2CO3溶液可除去CO2中的少量HCl
C.装置Ⅲ中冰水浴有利于析出NaHCO3固体
D.装置Ⅳ可获得少量NaHCO3固体
5.1941年,我国科学家侯德榜结合地域条件改进索尔维制碱法,提出纯碱与铵肥(NH4Cl)的联合生产工艺,后被命名为“侯氏制碱法”。主要工艺流程如图。下列说法正确的是( )
已知:侯氏制碱法总反应:2NaCl+H2O+2NH3+CO2===Na2CO3+2NH4Cl
索尔维制碱法总反应:2NaCl+CaCO3===Na2CO3+CaCl2 (CaCl2作为废液排放)
A.气体1、气体2均为CO2
B.溶液2中,含碳微粒主要是HCOeq \\al(-,3)
C.侯氏制碱法和索尔维制碱法中原料NaCl的原子利用率相同
D.盐析池中加入NaCl,c(Cl-)增大,NH4Cl(s)NHeq \\al(+,4)(aq)+Cl-(aq)的平衡逆向移动,NH4Cl析出
6.侯德榜是我国杰出的化学家,“侯氏制碱法”的创始人。NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解,其中不正确的是( )
A.甲同学说:该条件下NaHCO3的溶解度较小
B.乙同学说:NaHCO3不是纯碱
C.丙同学说:析出NaHCO3固体后的溶液中只含氯化铵
D.丁同学说:该反应是在饱和食盐水中先通入氨气,再通入二氧化碳
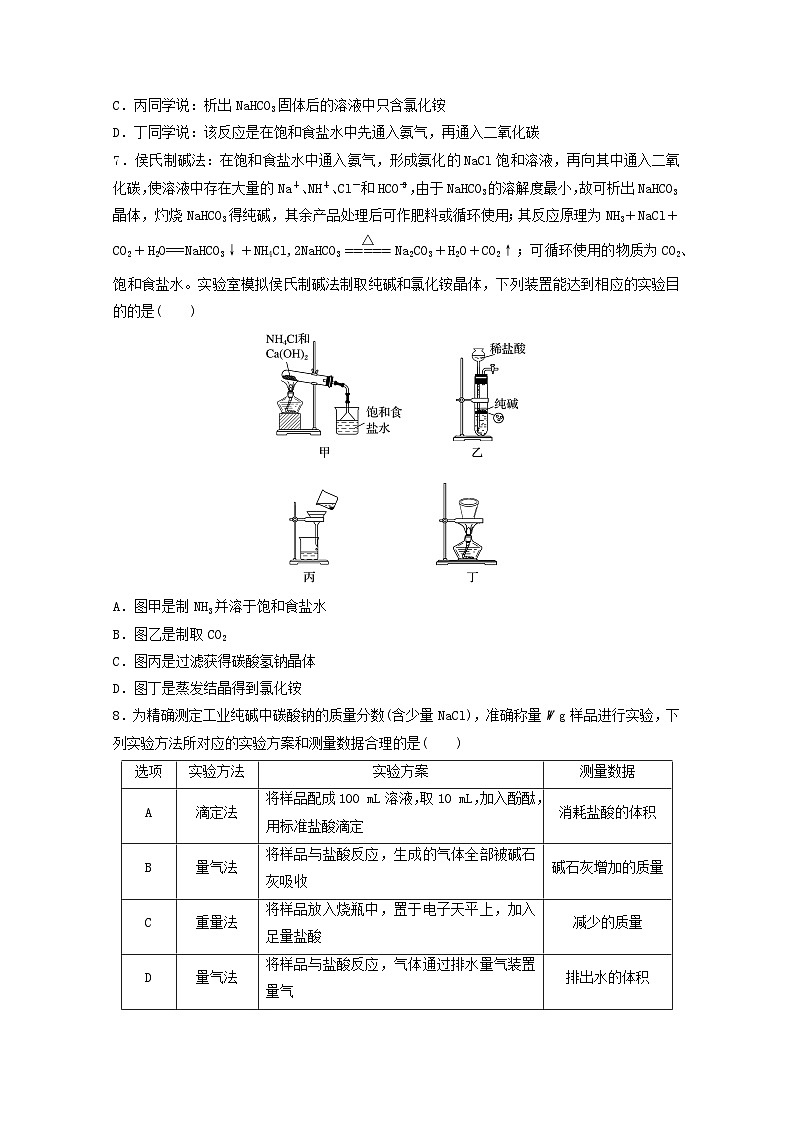
7.侯氏制碱法:在饱和食盐水中通入氨气,形成氨化的NaCl饱和溶液,再向其中通入二氧化碳,使溶液中存在大量的Na+、NHeq \\al(+,4)、Cl-和HCOeq \\al(-,3),由于NaHCO3的溶解度最小,故可析出NaHCO3晶体,灼烧NaHCO3得纯碱,其余产品处理后可作肥料或循环使用;其反应原理为NH3+NaCl+CO2+H2O===NaHCO3↓+NH4Cl,2NaHCO3eq \(=====,\s\up7(△))Na2CO3+H2O+CO2↑;可循环使用的物质为CO2、饱和食盐水。实验室模拟侯氏制碱法制取纯碱和氯化铵晶体,下列装置能达到相应的实验目的的是( )
A.图甲是制NH3并溶于饱和食盐水
B.图乙是制取CO2
C.图丙是过滤获得碳酸氢钠晶体
D.图丁是蒸发结晶得到氯化铵
8.为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W g样品进行实验,下列实验方法所对应的实验方案和测量数据合理的是( )
9.现有不纯的碳酸钠(仅含碳酸氢钠杂质),欲测定其中碳酸钠的质量分数,分别进行以下4个操作,其中不能成功的是( )
A.取m g样品,加热到质量不再变化时称重为n g
B.取m g样品,加入过量的稀盐酸,再将所得溶液加热蒸发、结晶、灼烧,余下物质质量为n g
C.取m g样品,溶于水,向所得溶液中加入过量的CaCl2溶液,将所得沉淀过滤、洗涤、烘干后称重为n g
D.取m g样品,加入过量的稀硫酸,再将所逸出的气体用碱石灰吸收,碱石灰增重n g
10.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列说法正确的是( )
A.盐酸的物质的量浓度为5.0 ml·L-1
B.根据表中数据计算出混合物中NaHCO3的物质的量分数为50%
C.9.2 g混合物中NaHCO3和KHCO3分别为5.0 g和4.2 g
D.15.7 g混合物恰好与盐酸完全反应
11.(2023·浙江回浦中学检测)某化学实验小组探究Na2CO3和NaHCO3与澄清石灰水的反应,实验过程及结果如下。
已知:pH越大,c(OH-)越大,溶液碱性越强。
下列说法不正确的是( )
A.Ⅰ是空白实验,排除因体积变化对Ⅱ、Ⅲ溶液pH的影响
B.Ⅱ和Ⅰ的pH曲线基本重合,说明CO32-与OH-不反应,Ⅱ中发生反应:CO32-+Ca2+===CaCO3↓
C.Ⅲ比Ⅱ的pH曲线降低,说明HCO3-与OH-反应,Ⅲ中初期发生反应:HCO3-+OH-+Ca2+===CaCO3↓+H2O
D.Ⅲ中石灰水恰好完全反应时,溶液pH=7
12.(2023·浙江新河中学月考)实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量。称取1.59 g样品,溶于水配成250.00 mL溶液,取出该溶液25.00 mL用0.1 ml·L-1盐酸进行滴定,得到如下曲线。以下说法或操作正确的是( )
A.计量点①前发生反应的离子方程式为HCO3-+H+===H2O+CO2↑
B.计量点②溶液中大量存在的阴离子是Cl-、HCO3-
C.此样品n(NaHCO3)=(28.1-2×11.9)×10-3 ml
D.使用该方法测定Na2CO3和NaOH混合溶液中氢氧化钠的含量,只会得到1个计量点
二、综合题
13.现有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C和装碱石灰的U形管D的质量。
③打开K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________________。
④关闭K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________________________________、_________________________________。
⑤打开K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_____________________________。
②装置E处干燥管中盛放的药品是________,其作用是____________________,如果实验中没有该装置,则会导致测得的NaHCO3的质量________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为____________(用含w、m1、m2的代数式表示)。
14.某化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验。回答下列问题:
(1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸与样品中的________(填“Na2CO3”或“NaCl”)发生反应,仪器b的名称是________,洗气瓶c中盛装的是浓硫酸,作用是______________________________________________________________________________。
(2)乙同学用图2所示装置,取一定质量的样品(m g)和足量稀硫酸反应进行实验,完成样品中Na2CO3质量分数的测定。
①实验前,检查该装置气密性的方法是先打开活塞a,向仪器b中注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若仪器b下端玻璃管中的________________,则装置气密性良好。
②在实验完成时,能直接测得的数据是CO2的________(填“体积”或“质量”)。
(3)丙同学用下图所示方法和步骤进行实验。
①操作Ⅰ涉及的实验名称有________、洗涤;操作Ⅱ涉及的实验名称有干燥、________。
②丙同学测得样品中Na2CO3的质量分数为______________________________________。
15.侯氏制碱法是在索尔维制碱法的基础上创造出的一种新的制造纯碱的方法。具体工艺流程图如下:
Ⅰ.根据以上流程回答下列问题:
(1)与索尔维制碱法相比,侯氏制碱法最突出的优点是________(填字母)。
A.原料利用率高
B.设备少
C.生产方便
碳酸化这一步的原理是(用化学方程式表示)______________ __________________________。
(2)侯氏制碱法副产品的一种用途为________。
(3)Y物质是________。
(4)向母液中通氨气,加入细小食盐颗粒,降温结晶析出副产品,通氨气的作用有________(填字母)。
A.使Na2CO3结晶析出
B.使NaHCO3转化为Na2CO3,提高析出NH4Cl的纯度
C.使NaHCO3更多地析出
D.增大NHeq \\al(+,4)的浓度,使NH4Cl更多地析出
Ⅱ.工业上碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量的NaCl,现欲测定某碳酸钠样品中Na2CO3的质量分数,某探究性学习小组取样品b g设计了如下实验方案。
该实验的操作步骤如下:
①如图连接装置(除B外)并加入所需药品;
②称量并记录B的质量(a1 g);
③按动鼓气球,持续约1分钟;
④连接上B;
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞;
⑥按动鼓气球,持续约1分钟;
⑦称量并记录B的质量(a2 g);
⑧计算。
(5)操作⑥中,鼓入空气的作用是___________________________________________________;根据题干所给的数据列出样品中Na2CO3的质量分数表达式:________。
(6)经实验发现最终所得的Na2CO3的质量分数超过100%,其可能的原因是_______________
_______________________________________________________________________________。
Ⅲ.现有碳酸钠和氯化钠的混合物样品25 g,将其放入干净的烧杯中,加入200 g水,使其完全溶解。向所得溶液中慢慢加入溶质质量分数为14.6%的盐酸,烧杯中溶液的质量与加入盐酸的质量关系曲线如图所示。请回答下列问题。
(7)在碳酸钠和氯化钠的混合样品中,含碳酸钠的质量为________(结果精确至0.1 g)。
(8)A点时,求此温度下所得不饱和溶液中溶质质量分数为________(计算结果精确至0.1%)。
侯氏制碱法与Na2CO3含量的测定
一、选择题
1.实验室可通过沉淀重量法测定样品纯度,按如图装置测定纯碱(含少量NaCl)的纯度,下列说法正确的是( )
A.装置A中试剂应为浓硫酸,C中试剂应为BaCl2溶液
B.在B、C之间应增添盛有饱和NaHCO3溶液的洗气装置,以除去氯化氢气体
C.只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钠的质量分数
D.反应结束后,需经过过滤、洗涤、干燥、称量等操作测定装置C中沉淀质量
答案 D
2.过碳酸钠(2Na2CO3·3H2O2),有Na2CO3和H2O2的双重性质,可用作漂白剂和氧化剂,能有效杀灭禽流感病毒。合理组合下列装置能用于测定过碳酸钠中碳酸钠的含量,下列说法不正确的是( )
A.连接顺序为装置Ⅲ→Ⅰ→Ⅱ
B.装置b和e中盛放的试剂相同
C.装置d的作用是防止空气中的H2O和CO2进入装置c中
D.若装置b中盛放的是澄清石灰水,只用装置Ⅰ即可验证过碳酸钠与稀硫酸反应是否生成CO2(不考虑空气中CO2的影响)
答案 B
3.(2023·浙江绍兴阳明中学段考)某固体混合物由Na2CO3和NaHCO3两种物质组成,将其分成X、Y两等份。标准状况下,X溶于足量盐酸,生成CO2的体积为V1 L;Y充分加热、冷却后再溶于足量盐酸,生成CO2的体积为V2 L。下列说法正确的是( )
A.加热,蒸干X与足量盐酸反应后的溶液,可得固体58.5V222.4 g
B.Y充分加热,固体质量减少44(V1-V2)22.4 g
C.X、Y消耗盐酸的物质的量之比为1∶1
D.混合物中Na2CO3和NaHCO3的物质的量之比为2V2-V1V1-V2
答案 C
4.(2024·江苏溧阳中学模拟)实验室用下列装置模拟侯氏制碱法制取少量NaHCO3固体,不能达到实验目的的是( )
A.装置Ⅰ制取CO2
B.装置Ⅱ中Na2CO3溶液可除去CO2中的少量HCl
C.装置Ⅲ中冰水浴有利于析出NaHCO3固体
D.装置Ⅳ可获得少量NaHCO3固体
答案 B
5.1941年,我国科学家侯德榜结合地域条件改进索尔维制碱法,提出纯碱与铵肥(NH4Cl)的联合生产工艺,后被命名为“侯氏制碱法”。主要工艺流程如图。下列说法正确的是( )
已知:侯氏制碱法总反应:2NaCl+H2O+2NH3+CO2===Na2CO3+2NH4Cl
索尔维制碱法总反应:2NaCl+CaCO3===Na2CO3+CaCl2 (CaCl2作为废液排放)
A.气体1、气体2均为CO2
B.溶液2中,含碳微粒主要是HCOeq \\al(-,3)
C.侯氏制碱法和索尔维制碱法中原料NaCl的原子利用率相同
D.盐析池中加入NaCl,c(Cl-)增大,NH4Cl(s)NHeq \\al(+,4)(aq)+Cl-(aq)的平衡逆向移动,NH4Cl析出
6.侯德榜是我国杰出的化学家,“侯氏制碱法”的创始人。NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解,其中不正确的是( )
A.甲同学说:该条件下NaHCO3的溶解度较小
B.乙同学说:NaHCO3不是纯碱
C.丙同学说:析出NaHCO3固体后的溶液中只含氯化铵
D.丁同学说:该反应是在饱和食盐水中先通入氨气,再通入二氧化碳
答案 C
7.侯氏制碱法:在饱和食盐水中通入氨气,形成氨化的NaCl饱和溶液,再向其中通入二氧化碳,使溶液中存在大量的Na+、NHeq \\al(+,4)、Cl-和HCOeq \\al(-,3),由于NaHCO3的溶解度最小,故可析出NaHCO3晶体,灼烧NaHCO3得纯碱,其余产品处理后可作肥料或循环使用;其反应原理为NH3+NaCl+CO2+H2O===NaHCO3↓+NH4Cl,2NaHCO3eq \(=====,\s\up7(△))Na2CO3+H2O+CO2↑;可循环使用的物质为CO2、饱和食盐水。实验室模拟侯氏制碱法制取纯碱和氯化铵晶体,下列装置能达到相应的实验目的的是( )
A.图甲是制NH3并溶于饱和食盐水
B.图乙是制取CO2
C.图丙是过滤获得碳酸氢钠晶体
D.图丁是蒸发结晶得到氯化铵
答案 A
答案 D
8.为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W g样品进行实验,下列实验方法所对应的实验方案和测量数据合理的是( )
答案 A
9.现有不纯的碳酸钠(仅含碳酸氢钠杂质),欲测定其中碳酸钠的质量分数,分别进行以下4个操作,其中不能成功的是( )
A.取m g样品,加热到质量不再变化时称重为n g
B.取m g样品,加入过量的稀盐酸,再将所得溶液加热蒸发、结晶、灼烧,余下物质质量为n g
C.取m g样品,溶于水,向所得溶液中加入过量的CaCl2溶液,将所得沉淀过滤、洗涤、烘干后称重为n g
D.取m g样品,加入过量的稀硫酸,再将所逸出的气体用碱石灰吸收,碱石灰增重n g
答案 D
10.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列说法正确的是( )
A.盐酸的物质的量浓度为5.0 ml·L-1
B.根据表中数据计算出混合物中NaHCO3的物质的量分数为50%
C.9.2 g混合物中NaHCO3和KHCO3分别为5.0 g和4.2 g
D.15.7 g混合物恰好与盐酸完全反应
答案 B
11.(2023·浙江回浦中学检测)某化学实验小组探究Na2CO3和NaHCO3与澄清石灰水的反应,实验过程及结果如下。
已知:pH越大,c(OH-)越大,溶液碱性越强。
下列说法不正确的是( )
A.Ⅰ是空白实验,排除因体积变化对Ⅱ、Ⅲ溶液pH的影响
B.Ⅱ和Ⅰ的pH曲线基本重合,说明CO32-与OH-不反应,Ⅱ中发生反应:CO32-+Ca2+===CaCO3↓
C.Ⅲ比Ⅱ的pH曲线降低,说明HCO3-与OH-反应,Ⅲ中初期发生反应:HCO3-+OH-+Ca2+===CaCO3↓+H2O
D.Ⅲ中石灰水恰好完全反应时,溶液pH=7
答案 D
12.(2023·浙江新河中学月考)实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量。称取1.59 g样品,溶于水配成250.00 mL溶液,取出该溶液25.00 mL用0.1 ml·L-1盐酸进行滴定,得到如下曲线。以下说法或操作正确的是( )
A.计量点①前发生反应的离子方程式为HCO3-+H+===H2O+CO2↑
B.计量点②溶液中大量存在的阴离子是Cl-、HCO3-
C.此样品n(NaHCO3)=(28.1-2×11.9)×10-3 ml
D.使用该方法测定Na2CO3和NaOH混合溶液中氢氧化钠的含量,只会得到1个计量点
答案 C
二、综合题
13.现有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C和装碱石灰的U形管D的质量。
③打开K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________________。
④关闭K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________________________________、_________________________________。
⑤打开K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_____________________________。
②装置E处干燥管中盛放的药品是________,其作用是____________________,如果实验中没有该装置,则会导致测得的NaHCO3的质量________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为____________(用含w、m1、m2的代数式表示)。
答案 (1)①检查装置的气密性 ③除去装置中的水蒸气和二氧化碳 ④2NaHCO3eq \(=====,\s\up7(△))Na2CO3+H2O↑+CO2↑ Na2CO3·10H2Oeq \(=====,\s\up7(△))Na2CO3+10H2O↑
(2)①Na2CO3·10H2O和NaHCO3的质量分数测定结果偏小,NaCl的质量分数测定结果偏大
②碱石灰 防止空气中的CO2和水蒸气进入D中影响测定结果 偏大 ③eq \f(286m1-\f(18m2,44),180w)×100%
14.某化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验。回答下列问题:
(1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸与样品中的________(填“Na2CO3”或“NaCl”)发生反应,仪器b的名称是________,洗气瓶c中盛装的是浓硫酸,作用是______________________________________________________________________________。
(2)乙同学用图2所示装置,取一定质量的样品(m g)和足量稀硫酸反应进行实验,完成样品中Na2CO3质量分数的测定。
①实验前,检查该装置气密性的方法是先打开活塞a,向仪器b中注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若仪器b下端玻璃管中的________________,则装置气密性良好。
②在实验完成时,能直接测得的数据是CO2的________(填“体积”或“质量”)。
(3)丙同学用下图所示方法和步骤进行实验。
①操作Ⅰ涉及的实验名称有________、洗涤;操作Ⅱ涉及的实验名称有干燥、________。
②丙同学测得样品中Na2CO3的质量分数为______________________________________。
答案 (1)Na2CO3 分液漏斗 除去CO2中的水蒸气 (2)①液面上升 ②体积
(3)①过滤 称量 ②eq \f(106y,197x)×100%
15.侯氏制碱法是在索尔维制碱法的基础上创造出的一种新的制造纯碱的方法。具体工艺流程图如下:
Ⅰ.根据以上流程回答下列问题:
(1)与索尔维制碱法相比,侯氏制碱法最突出的优点是________(填字母)。
A.原料利用率高
B.设备少
C.生产方便
碳酸化这一步的原理是(用化学方程式表示)______________ __________________________。
(2)侯氏制碱法副产品的一种用途为________。
(3)Y物质是________。
(4)向母液中通氨气,加入细小食盐颗粒,降温结晶析出副产品,通氨气的作用有________(填字母)。
A.使Na2CO3结晶析出
B.使NaHCO3转化为Na2CO3,提高析出NH4Cl的纯度
C.使NaHCO3更多地析出
D.增大NHeq \\al(+,4)的浓度,使NH4Cl更多地析出
Ⅱ.工业上碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量的NaCl,现欲测定某碳酸钠样品中Na2CO3的质量分数,某探究性学习小组取样品b g设计了如下实验方案。
该实验的操作步骤如下:
①如图连接装置(除B外)并加入所需药品;
②称量并记录B的质量(a1 g);
③按动鼓气球,持续约1分钟;
④连接上B;
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞;
⑥按动鼓气球,持续约1分钟;
⑦称量并记录B的质量(a2 g);
⑧计算。
(5)操作⑥中,鼓入空气的作用是___________________________________________________;根据题干所给的数据列出样品中Na2CO3的质量分数表达式:________。
(6)经实验发现最终所得的Na2CO3的质量分数超过100%,其可能的原因是_______________
_______________________________________________________________________________。
Ⅲ.现有碳酸钠和氯化钠的混合物样品25 g,将其放入干净的烧杯中,加入200 g水,使其完全溶解。向所得溶液中慢慢加入溶质质量分数为14.6%的盐酸,烧杯中溶液的质量与加入盐酸的质量关系曲线如图所示。请回答下列问题。
(7)在碳酸钠和氯化钠的混合样品中,含碳酸钠的质量为________(结果精确至0.1 g)。
(8)A点时,求此温度下所得不饱和溶液中溶质质量分数为________(计算结果精确至0.1%)。
答案 (1)A NH3·H2O+CO2===NH4HCO3、NaCl+NH4HCO3===NaHCO3↓+NH4Cl(或NH3·H2O+NaCl+CO2===NH4Cl+NaHCO3↓)
(2)制化肥、制干电池等(任答一点) (3)CO2
(4)BD (5)使产生的CO2气体全部赶入碱石灰中被吸收 eq \f(53a2-a1,22b)×100% (6)碱石灰吸收了外界空气中的水蒸气和CO2 (7)21.2 g
(8)8.6%
选项
实验方法
实验方案
测量数据
A
滴定法
将样品配成100 mL溶液,取10 mL,加入酚酞,用标准盐酸滴定
消耗盐酸的体积
B
量气法
将样品与盐酸反应,生成的气体全部被碱石灰吸收
碱石灰增加的质量
C
重量法
将样品放入烧瓶中,置于电子天平上,加入足量盐酸
减少的质量
D
量气法
将样品与盐酸反应,气体通过排水量气装置量气
排出水的体积
50 mL盐酸
50 mL盐酸
50 mL盐酸
m(混合物)
9.2 g
15.7 g
27.6 g
V(CO2)(标况)
2.24 L
3.36 L
3.36 L
实验
装置
试剂X
实验结果
Ⅰ
Ⅱ
Ⅲ
①Ⅱ、Ⅲ均产生白
色沉淀
②烧杯中溶液pH
变化如下:
蒸
馏
水
0.05
ml·L-1
Na2CO3
溶液
0.05
ml·L-1
NaHCO3
溶液
选项
实验方法
实验方案
测量数据
A
滴定法
将样品配成100 mL溶液,取10 mL,加入酚酞,用标准盐酸滴定
消耗盐酸的体积
B
量气法
将样品与盐酸反应,生成的气体全部被碱石灰吸收
碱石灰增加的质量
C
重量法
将样品放入烧瓶中,置于电子天平上,加入足量盐酸
减少的质量
D
量气法
将样品与盐酸反应,气体通过排水量气装置量气
排出水的体积
50 mL盐酸
50 mL盐酸
50 mL盐酸
m(混合物)
9.2 g
15.7 g
27.6 g
V(CO2)(标况)
2.24 L
3.36 L
3.36 L
实验
装置
试剂X
实验结果
Ⅰ
Ⅱ
Ⅲ
①Ⅱ、Ⅲ均产生白
色沉淀
②烧杯中溶液pH
变化如下:
蒸
馏
水
0.05
ml·L-1
Na2CO3
溶液
0.05
ml·L-1
NaHCO3
溶液
高考化学一轮复习微专题5侯氏制碱法碳酸钠含量的测定学案: 这是一份高考化学一轮复习微专题5侯氏制碱法碳酸钠含量的测定学案,共6页。试卷主要包含了侯氏制碱法等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第一节 钠及其化合物练习: 这是一份人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第一节 钠及其化合物练习,共8页。
鲁科版 (2019)选择性必修1微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用达标测试: 这是一份鲁科版 (2019)选择性必修1微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用达标测试,共7页。












