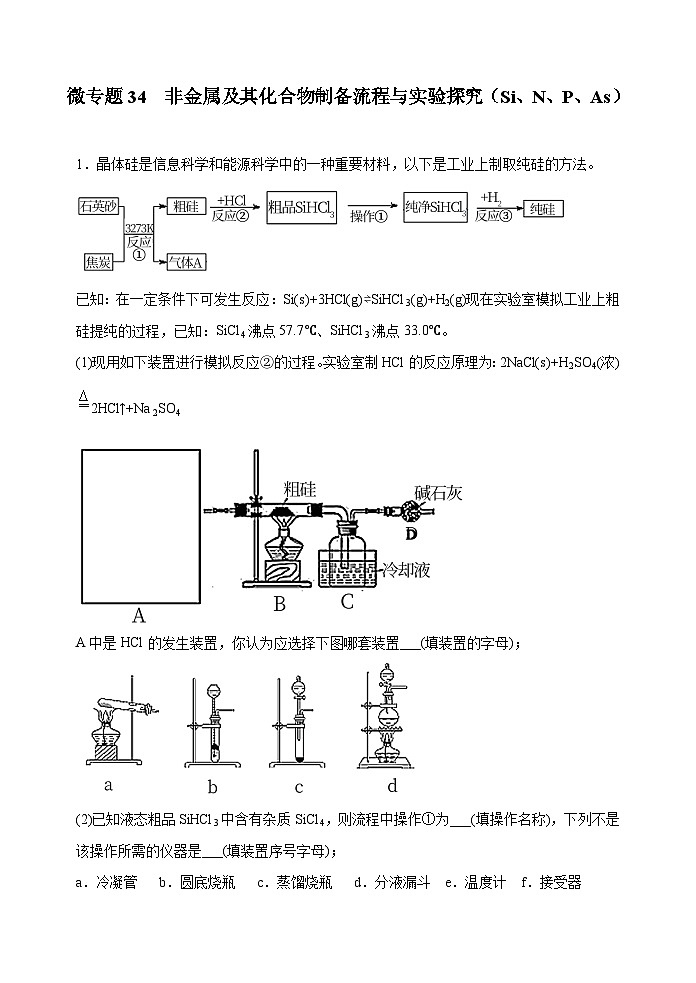

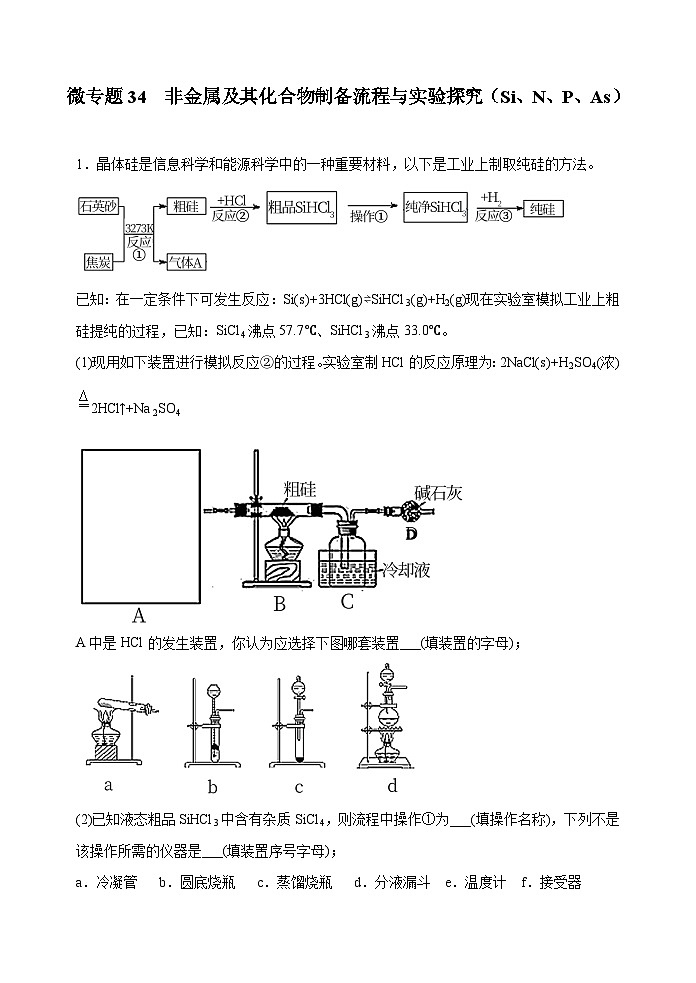


新高考化学一轮复习考点巩固练习34 非金属及其化合物制备流程与实验探究(Si、N、P、As)(解析版)
展开已知:在一定条件下可发生反应:Si(s)+3HCl(g)⇌SiHCl3(g)+H2(g)现在实验室模拟工业上粗硅提纯的过程,已知:SiCl4沸点57.7℃、SiHCl3沸点33.0℃。
(1)现用如下装置进行模拟反应②的过程。实验室制HCl的反应原理为:2NaCl(s)+H2SO4(浓)2HCl↑+Na2SO4
A中是HCl的发生装置,你认为应选择下图哪套装置___(填装置的字母);
(2)已知液态粗品SiHCl3中含有杂质SiCl4,则流程中操作①为___(填操作名称),下列不是该操作所需的仪器是___(填装置序号字母);
a.冷凝管 b.圆底烧瓶 c.蒸馏烧瓶 d.分液漏斗 e.温度计 f.接受器
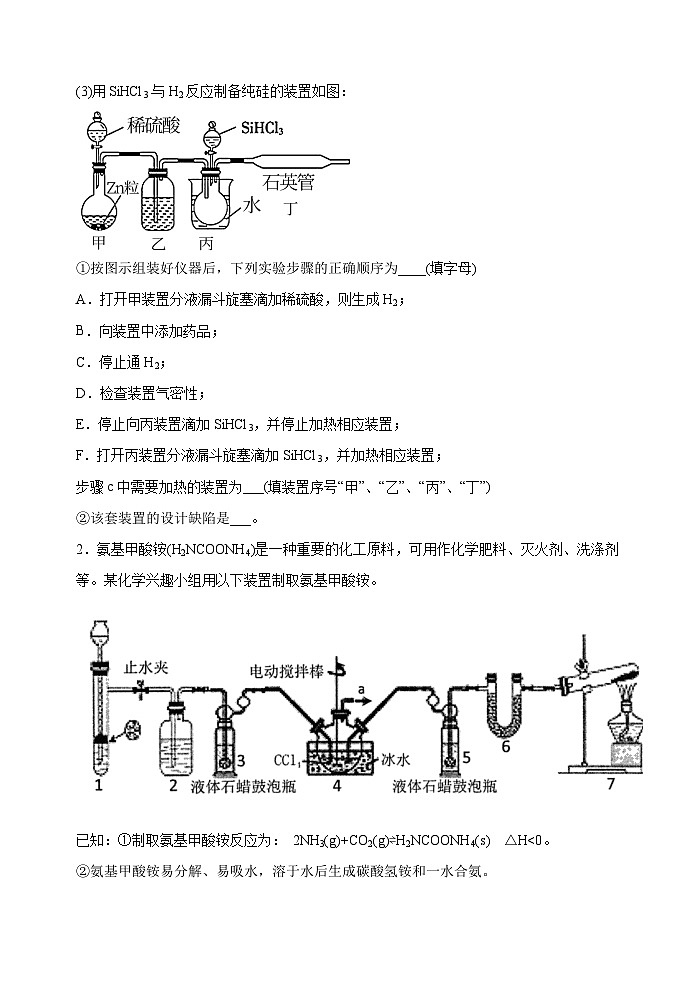
(3)用SiHCl3与H2反应制备纯硅的装置如图:
①按图示组装好仪器后,下列实验步骤的正确顺序为____(填字母)
A.打开甲装置分液漏斗旋塞滴加稀硫酸,则生成H2;
B.向装置中添加药品;
C.停止通H2;
D.检查装置气密性;
E.停止向丙装置滴加SiHCl3,并停止加热相应装置;
F.打开丙装置分液漏斗旋塞滴加SiHCl3,并加热相应装置;
步骤c中需要加热的装置为___(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是___。
【答案】(1)d (2) 分馏 bd (3) DBAFEC 丙和丁 装置中无尾气处理装置
【分析】
工业上制取纯硅的方法,是将焦炭和石英砂在高温下反应生成粗硅和一氧化碳,再发生反应Si(s)+3HCl(g)⇌SiHCl3(g)+H2(g),液态粗品SiHCl3中含有杂质SiCl4等,根据物质的沸点相差不大,可选择分馏的方法进行除杂,根据分馏操作的装置可选择仪器,最后用SiHCl3与H2反应制备纯硅;根据题中制HCl的实验原理2NaCl(s)+H2SO4(浓)2HCl↑+Na2SO4,为固体和液体加热,据此选择装置,反应中有剩余的氯化氢气体未反应,要吸收,同时SiHCl3易水解,要防止空气中的水分进入装置,所以使用碱石灰;用SiHCl3与H2反应制备纯硅,组装好仪器后,要先进行气密性检验,再在装置中通氢气,排尽空气后再进行SiHCl3与H2的反应,实验结束时还要继续通氢气,直到装置冷却,防止空气中的成分对反应干扰,根据装置可知,丙处是水浴,丁处进行SiHCl3与H2的反应,都要进行加热,实验尾气中有氯化氢等气体不能直接排到空气中,据此分析。
【解析】
(1)根据题中制HCl的实验原理2NaCl(s)+H2SO4(浓)2HCl↑+Na2SO4,为固体和液体加热,所以选择d装置;
(2)液态粗品SiHCi中含有杂质SiCls,根据这些物质的沸点不同,可选择分馏的方法进行除杂,所以流程中操作①为分馏,根据分馏操作的装置可知,分馏需要使用冷凝管进行冷凝蒸气,在蒸馏烧瓶中进行加热,用温度计测量蒸汽的温度,用接受器接收冷凝后的蒸汽,圆底烧瓶和分液漏斗不是分馏操作所需的仪器;
(3)③用SiHCl3与H2反应制备纯硅,组装好仪器后,要先进行气密性检验,再在装置中通氢气,排尽空气后再进行SiHCl3与H2的反应,实验结束时还要继续通氢气,直到装置冷却,防止空气中的成分对反应干扰,所以实验步骤的顺序为DBAFEC,根据装置可知,丙处是水浴,丁处进行SiHCl与H2的反应,都要进行加热,所以步骤F中需要加热的装置为丙、丁;
②实验尾气中有氯化氢等气体不能直接排到空气中,而根据装置可知,装置中无尾气处理装置。
2.氨基甲酸铵(H2NCOONH4)是一种重要的化工原料,可用作化学肥料、灭火剂、洗涤剂等。某化学兴趣小组用以下装置制取氨基甲酸铵。
已知:①制取氨基甲酸铵反应为: 2NH3(g)+CO2(g)⇌H2NCOONH4(s) △H<0。
②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
回答下列问题:
(1)检查装置1气密性的操作是_______
(2)装置6中的试剂是_______,导管a出口直接与尾气处理装置连接,该尾气处理装置中的试剂是_______。
(3)装置7中发生反应的化学方程式为_______
(4)三颈烧瓶需用冰水浴冷却,其目的是_______
(5) CCl4液体中产生较多晶体悬浮物时,即停止反应。停止反应的操作是_______,从三颈烧瓶中分离出粗产品的操作是_______
(6)因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173g,用足量石灰水充分反应后,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为1.500g。样品中氨基甲酸铵的质量分数是_______[Mr(H2NCOONH4)=78、Mr(NH4HCO3)=79]
【答案】(1)关闭止水夹,向长颈漏斗中加水至长颈漏斗中液面高于试管中液面,静置一段时间,观察液面高度差是否变化 (2) 碱石灰 浓硫酸 (3) 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O (4) 防止氨基甲酸铵分解;促进生成氨基甲酸铵反应正向移动 (5) 关闭止水夹,熄灭酒精灯 过滤 (6) 79.80%
【分析】
根据题中已知原理,制取氨基甲酸铵,需要二氧化碳和氨气,又由于氨基甲酸铵易分解、易吸水,所以二氧化碳和氨气必须干燥,且在冰水低温环境中反应,根据实验室制取二氧化碳和制氨气的原理,1中为碳酸钙和盐酸混合制二氧化碳的反应,经过2中浓硫酸干燥二氧化碳,7中为固体加热制氨气的反应(比如氯化铵和氢氧化钙混合加热),6中碱石灰干燥氨气,干燥的氨气和二氧化碳分别通过5,3的液体石蜡鼓泡瓶,通过气泡硫酸控制反应物的用量,在4中三颈烧瓶中发生反应制取氨基甲酸铵,尾气为氨气和二氧化碳,其中氨气有毒,在a处接酸液进行吸收处理,又由于氨基甲酸铵易吸水,要用浓硫酸进行尾气处理。
【解析】
(1)装置1为带分液漏斗的试管,故检查装置气密性的操作为:关闭止水夹,向长颈漏斗中加水至长颈漏斗中液面高于试管中液面,静置一段时间,观察液面高度差是否变化
(2)据分析,装置6为氨气的干燥装置,氨气为碱性气体,故6中试剂为:碱石灰;该反应尾气为氨气和二氧化碳,其中氨气有毒,需要尾气处理,故a处应接的尾气处理装置中应装有酸液,又由于产物氨基甲酸铵易吸水,故需要用浓硫酸,不能用稀硫酸,故答:浓硫酸;
(3)装置7为实验室固体加热制氨气的反应,用氯化铵和熟石灰混合加热制氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;
(4)已知2NH3(g)+CO2(g)⇌H2NCOONH4(s) △H<0,反应放热,降低温度可以使平衡正向移动,提高产率,同时,产物氨基甲酸铵易分解,低温下可以防止其分解,故答:防止氨基甲酸铵分解;促进生成氨基甲酸铵反应正向移动;
(5)停止反应需要停止反应物CO2和氨气的生成,故要停止反应需要关闭1处的止水夹,和熄灭7处的酒精灯;得到产物在CCl4中是悬浮晶体,固液分离需要过滤操作;
(6)设碳酸氢铵为xml,氨基甲酸铵为yml,由样品总质量可得:79g/mlxml+78g/mlyml=1.173g,又因为n(C)=n(CaCO3)==0.015ml,由碳原子守恒可得:xml+yml=0.015ml,解x=0.003,y=0.012,则m(H2NCOONH4)=0.012ml78g/ml=0.936g,则氨基甲酸铵的质量分数=79.80%
3.三氯氧磷(POCl3)是一种工业化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知PCl3和三氯氧磷的性质如表:
(1)装置A中的分液漏斗能否用长颈漏斗代替?做出判断并分析原因:_______
(2)装置B的作用是______________(填标号)。
a.气体除杂 b.加注浓硫酸
c.观察气体流出速度 d.调节气压
(3)仪器丙的名称是__________,实验过程中仪器丁的进水口为________(填“a”或“b”)口。
(4)写出装置C中发生反应的化学方程式_______,该装置中用温度计控制温度为60~65 ℃,原因是________。
(5)称取16.73 g POCl3样品,配制成100 mL溶液;取10.00 mL溶液于锥形瓶中,加入3.2 ml·L-1的AgNO3溶液10.00 mL,并往锥形瓶中滴入5滴Fe2(SO4)3溶液;用0.20 ml·L-1的KSCN溶液滴定,达到滴定终点时消耗KSCN溶液10.00 mL(已知:Ag++SCN-=AgSCN↓)。则加入Fe2(SO4)3溶液的作用是________,样品中POCl3的纯度为_____________。
【答案】(1)否,长颈漏斗不能调节滴液速度 (2) acd (3) 三颈烧瓶 a (4)2PCl3+O2=2POCl3 温度过低反应速度过慢;温度过高,PCl3易挥发,利用率低 (5) 指示剂 91.8%
【分析】
A装置中用双氧水与二氧化锰反应制备氧气,通过加入双氧水的量,可以控制产生氧气的速率,氧气中含有的水蒸气用浓硫酸除去,装置B中有长颈漏斗,可以平衡装置内外的压强,起到安全瓶的作用,纯净的氧气与三氯化磷在装置C中反应生成POCl3,为了控制反应速率,同时防止三氯化磷挥发,反应的温度控制在60~65℃,所以装置C中用水浴加热,POCl3遇水剧烈水解为含氧酸和氯化氢,为防止空气中水蒸汽进入装置,同时吸收尾气,所以在装置的最后连有碱石灰的干燥管,据此分析解答(1)~(4);
(5)测定POCl3产品含量,用POCl3与水反应生成氯化氢,然后用硝酸银标准溶液沉淀溶液中的氯离子,KSCN溶液滴定过量的AgNO3溶液,根据KSCN的物质的量可计算出溶液中剩余的AgNO3,结合AgNO3的总物质的量得知与氯离子反应的硝酸银,进而计算出溶液中氯离子的物质的量,根据元素守恒可计算出样品中POCl3的质量,进而确定POCl3的质量分数。
【解析】
(1)装置A中的分液漏斗不能用长颈漏斗代替,因为长颈漏斗不能调节滴液速度,故答案为否,长颈漏斗不能调节滴液速度;
(2)装置B中装有浓硫酸,可作干燥剂,另外气体通过液体时可观察到气泡出现,长颈漏斗,可以平衡装置内外的压强,起到安全瓶的作用,则装置B的作用是观察O2的流速、平衡气压、干燥氧气,故答案为acd;
(3)根据装置图,仪器丙为三颈烧瓶,为了提高冷却效果,应该从冷凝管的下口进水,即进水口为a,故答案为三颈烧瓶;a;
(4)氧气氧化PCl3生成POCl3,根据原子守恒,反应的化学方程式2PCl3+O2=2POCl3,根据上面的分析可知,反应温度应控制在60~65℃,原因是温度过低,反应速率小,温度过高,三氯化磷会挥发,利用率低,故答案为2PCl3+O2=2POCl3;温度过低,反应速率小,温度过高,三氯化磷会挥发,利用率低;
(5)Fe3+的溶液中滴加KSCN溶液,溶液显红色,则用 KSCN溶液滴定过量的AgNO3溶液时,可选择硫酸铁溶液为指示剂,达到终点时的现象是溶液会变红色;KSCN的物质的量为0.20ml•L-1×0.010L=0.002ml,根据反应Ag++SCN-=AgSCN↓,可知溶液中剩余的银离子的物质的量为0.002ml,POCl3与水反应生成氯化氢的物质的量为3.2ml•L-1×0.01L-0.002ml=0.03ml,即16.73 g POCl3产品中POCl3的物质的量为×=0.1ml,则所得产品中POCl3的纯度为×100%=91.8%,故答案为指示剂;91.8%。
4.As2O3为白色霜状粉末,俗称砒霜,为剧毒物质,对人的致死量为0.1g,法医学中可采用马氏(Marsh)试砷法验证砒霜中毒。某实验室使用马氏试砷法检验某待测试样中As2O3的含量,如图所示。马氏试砷法的原理是将Zn、盐酸和待测试样混合,若试样中含砒霜,则可反应生成AsH3,将其导入硬质玻璃试管中,在250-300℃时AsH3分解,会在玻璃管壁上生成黑色的“砷镜”。
已知:AsH3是一种有大蒜味的有毒气体,易自燃,As的熔点为817℃,在6149℃时升华。
(1)仪器B的名称为____。
(2)AsH3的还原性极强,能与大多数无机氧化剂反应,例如与AgNO3溶液反应可生成As2O3和一种黑色沉淀,相关化学方程式为:__。
(3)若试样中含有砒霜,则仪器B中发生的用锌还原砒霜反应的离子方程式为___。
(4)打开仪器A的活塞前,应先打开K1、K2通一段时间H2,其目的是__,反应过程中还应继续通入H2,但流速不应过快,原因是___。
(5)仪器D的作用是收集储存尾气,C的作用是___。
(6)实验时应严格控制硬质玻璃管处加热温度,原因是___。
(7)若实验时试样质量为10.00g,当实验结束时,AsH3传感器未检测出AsH3,玻璃管中收集到0.020mgAs,则试样(假设试样中的含砷化合物只有As2O3)中As2O3的含量为___mg/100g(结果取三位有效数字)。
【答案】(1)三颈圆底烧瓶(或三口烧瓶) (2)2AsH3+12AgNO3+3H2O=As2O3+12HNO3+12Ag↓ (3) 6Zn+As2O3+12H+=6Zn2++2AsH3↑+3H2O (4) 排净装置内的空气,防止AsH3发生自燃 将AsH3全部带入玻璃管中反应,并防止流速过快导致AsH3没有完全分解(或损耗) (5) 接收D中储存尾气时排出的水 (6) 防止As升华,不易形成砷镜 (7) 0.264
【解析】
(1)仪器B的名称为三颈圆底烧瓶(或三口烧瓶);
(2)AsH3的还原性极强,能与大多数无机氧化剂反应,例如与AgNO3溶液反应可生成As2O3和一种黑色沉淀,As的化合价升高,则Ag化合价降低,黑色沉淀为:Ag。相关化学方程式为:2AsH3+12AgNO3+3H2O=As2O3+12HNO3+12Ag↓;
(3) 在酸性溶液中,锌还原砒霜,锌氧化为锌离子,As2O3还原为AsH3,反应的离子方程式为:6Zn+As2O3+12H+=6Zn2++2AsH3↑+3H2O;
(4)打开仪器A的活塞前,应先打开K1、K2通一段时间H2,其目的是排净装置内的空气,防止AsH3发生自燃。反应过程中还应继续通入H2,但流速不应过快,原因是:将AsH3全部带入玻璃管中反应,并防止流速过快导致AsH3没有完全分解(或损耗);
(5)仪器D的作用是收集储存尾气,C的作用是接收D中储存尾气时排出的水;
(6)实验时应严格控制硬质玻璃管处加热温度,原因是防止As升华,不易形成砷镜;
(7)实验所用试样为10.00g当实验结束时,AsH3传感器未检测出AsH3,说明AsH3全部在玻璃管中受热分解为0.020mgAs,则试样中As2O3的含量为=0.264mg/100g。
5.氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺流程如下:
注:原料中的N2是采用空气分离法制备。
(1)净化N2和H2时,铜屑的作用是_______;硅胶的作用是_______。
(2)氮化炉中发生反应:3SiO2(s)+2N2(g)=Si3N4(s),同时会剧烈放热,反应时要严格控制氮气的流速以控制_______,原因是_______。
(3)X可能是_______(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)如何说明氮化硅产品已用水洗干净?_______。
(5)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为:_______。
【答案】(1)除去原料气中残存的氧气 除去生成的水蒸气 (2) 温度 防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触 (3) 硝酸 (4) 用pH试纸测得最后一次洗涤的滤出液呈中性 (5) 9Si+4NaN33Si3N4 +4Na↑
【分析】
将N2和H2分别分别经过无水氯化钙、铜屑、硅胶除去水和氧气;净化后的N2和H2在氮化炉中与粉碎的硅在1200~1400℃反应生成氮化硅,制取的氮化硅中混有Cu,用硝酸酸洗除去杂质铜,再用蒸馏水水洗、后处理得到纯净的氮化硅,据此分析解答。
【解析】
(1) 原料中的N2是采用空气分离法制备的其中混有少量氧气,Cu能与氧气反应,可以除去原料气中的氧气;高温下,氢气能够与氧气反应生成水,硅胶具有吸水性,可除去生成的水蒸气,故答案为:除去原料气中残存的氧气;除去生成的水蒸气;
(2)氮化炉中3SiO2(s)+2N2(g)=Si3N4(s),该反应为放热反应,硅的熔点是1420℃,反应过快,温度过高,会导致硅熔化熔合成团,阻碍与N2的接触,故应严格控制温度,故答案为:温度;防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;
(3)氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉,为除去混有的Cu,可选择硝酸,Cu与硝酸能够反应,而氮化硅与硝酸不反应,故答案为:硝酸;
(4)氮化硅不溶于水、不溶于酸(HF酸除外),若氮化硅产品用水洗干净,则洗涤后的滤出液呈中性,故可以使用pH试纸测得最后一次洗涤的滤出液的酸碱性,故答案为:用pH试纸测得最后一次洗涤的滤出液呈中性;
(5)硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧发生置换反应生成氮化硅,同时生成Na,反应的化学方程式为9Si+4NaN33Si3N4+4Na,故答案为:9Si+4NaN33Si3N4+4Na。
6.工业上利用氨氧化获得的高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3,工艺流程如下:
已知:Na2CO3+NO+NO2=2NaNO2+CO2
(1)中和液所含溶质除NaNO2及少量Na2CO3外,还有__________(填化学式)。
(2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是_______。蒸发Ⅰ产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的_______(填操作名称)最合理。
(3)母液Ⅰ进行转化时加入稀HNO3的目的是_______。母液Ⅱ需回收利用,下列处理方法合理的是________。
a.转入中和液 b.转入结晶Ⅰ操作
c.转入转化液 d.转入结晶Ⅱ操作
(4)若将NaNO2、NaNO3两种产品的物质的量之比设为2:1,则生产1.38吨NaNO2时,Na2CO3的理论用量为______吨(假定Na2CO3恰好完全反应)。
【答案】(1)NaNO3 (2) 防止NaNO2的析出 溶碱 (3) 将NaNO2氧化为NaNO3 c、d (4) 1.59
【解析】
(1)NO2与碱液反应可生成NaNO3;
(2)浓度过大时,NaNO2可能会析出;NaNO2有毒,不能直接排放,回收后可用于流程中的溶碱;
(3)NaNO2在酸性条件下易被氧化,加入稀硝酸可提供酸性环境;母液Ⅱ的溶质主要是NaNO3,所以回收利用时应转入转化液,或转入结晶Ⅱ操作,故c、d正确;
(4)1.38吨NaNO2的物质的量为:1.38×106÷69g/ml=2×104ml,则生成的NaNO3物质的量为:1×104ml,故Na2CO3的理论用量=×(2×104+1×104)ml×106g/ml=1.59×106g=1.59吨。
7.从废旧磷酸铁理电池的正极材料(含LiFePO4、石墨粉和铝箔等)中综合回收锂、铁和磷等的工艺流程如图所示:
回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为________。
(2)完成“溶浸2”反应的离子方程式:____LiFePO4+___H2O2+____=_____Li++____+_____+____H2O
__________
(3)“滤渣2”的主要成分是__________。
(4) “滤渣2”循环两次的目的是_______。
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为_______。实验中,铁、磷的沉淀率结果如图所示。碳酸钠浓度大于30%后,铁沉淀率仍然升高,磷沉淀率明显降低,其可能原因是_________。
(6)为了充分沉淀,“沉锂”时所用的X和适宜温度是_______(填标号)。
A.NaOH 20-40℃ B.NaOH 80-100℃ C.Na2CO3 20-40℃ D.Na2CO3 60-80℃
【答案】(1)2Al+2NaOH+2H2O═2NaAlO2+3H2↑ (2) 2LiFePO4+H2O2+6H+═2Li++2Fe3++2H2PO+2H2O (3) 石墨 (4) 提高浸出液浓度 Fe3++H2PO+CO=FePO4↓+CO2↑+2H2O (5) 碳酸钠水解产生的氢氧根离子浓度增大,与铁离子反应生成氢氧化铁沉淀,而使留在溶液中的磷酸根离子浓度增加 (6) D
【分析】
由流程可知,溶浸1中发生2Al+2OH-+2H2O═2AlO+3H2↑,滤液中通入二氧化碳生成氢氧化铝,溶浸2中发生2LiFePO4+H2O2+6H+═2Li++2Fe3++2H2PO+2H2O,过滤分离出滤渣2为石墨,滤液2两次循环可提高浸出液浓度(或提高过氧化氢和硫酸的利用率),滤液2中加碳酸钠溶液发生Fe3++H2PO+CO=FePO4↓+CO2↑+2H2O,若碳酸钠浓度较大时,生成氢氧化铁,导致磷沉淀率明显降低,X为碳酸钠溶液,结合表中数据可知60-80℃时生成碳酸锂沉淀易分离,沉淀转化时发生FePO4+3OH-⇌Fe(OH)3+PO,以此来解答。
【解析】
(1)“溶浸1”中铝溶解的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(2)“溶浸2”过程中LiFePO4和H2O2在酸性条件下发生氧化还原反应,离子方程式为2LiFePO4+H2O2+6H+═2Li++2Fe3++2H2PO+2H2O,故答案为:2LiFePO4+H2O2+6H+═2Li++2Fe3++2H2PO+2H2O;
(3)“滤渣2”的主要成分是石墨,故答案为:石墨;
(4)“滤液2”循环两次的目的是提高浸出液浓度,故答案为:提高浸出液浓度;
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为Fe3++H2PO+CO=FePO4↓+CO2↑+2H2O,实验中,铁、磷的沉淀率 结果如图所示。碳酸钠浓度大于30%后,铁沉淀率仍然升高,磷沉淀率明显降低,其可能原因是碳酸钠水解产生的氢氧根离子浓度增大,与铁离子反应生成氢氧化铁沉淀,而使留在溶液中的磷酸根离子浓度增加,故答案为:Fe3++H2PO+CO=FePO4↓+CO2↑+2H2O;碳酸钠水解产生的氢氧根离子浓度增大,与铁离子反应生成氢氧化铁沉淀,而使留在溶液中的磷酸根离子浓度增加;
(6)由表中数据可知,相同温度下碳酸锂的溶解度比LiOH小,且升高温度碳酸锂的溶解度减小,为了充分沉淀,需要碳酸锂的溶解度小,温度控制在60−80℃,则“沉锂”时所用的X和适宜温度是Na2CO3、60−80℃,故答案为:D。
8.砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
(l)冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
已知:I .As2S3与过量的S2一存在以下反应:As2S3(s)+3S2—(aq) 2AsS33—(aq);
II.亚砷酸盐的溶解性大于相应砷酸盐。
①亚砷酸中砷元素的化合价为______;
②砷酸的第一步电离方程式为____________________________;
③“一级沉砷”中FeSO4的作用是________________;
④“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________________;
⑤沉淀X为_________________(填化学式)。
(2)冶炼废渣中的砷元素主要以As2O3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10 g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成H3As气体。
步骤2:将H3As气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
①AsH3的电子式为______________;
②步骤2的离子方程式为_________________________;
③固体废弃物的排放标准中,砷元素不得高于4.0×10一5g·kg一1,请通过计算说明该排放的废渣中砷元素的含量(填“符合”、“不符合”)排放标准,原因是_____________________。
【答案】(l)+①3 ② H3AsO4H++H2AsO4— ③ 沉淀过量的S2—,使As2S3(s)+3S2—(aq) 2AsS33—(aq)平衡左移,提高沉砷效果 ④ H3AsO3+H2O2=H3AsO4+H2O ⑤ CaSO4 (2)① ②12Ag++2H3As+3H2O==12Ag↓+As2O3+12H+ ③ 不符合,因为该废渣砷含量为(3.0×10-6g÷10g)×1000g/kg=3.0×10—4g/kg大于排入标准4.0×10一5g·kg一1
【解析】
试题分析:(1)①根据H3AsO3,氧元素显-2价,H元素显+1价,化合价代数和为0,As的价态为+3价;②砷酸为弱酸,要分步电离,第一步电离:H3AsO4H++H2AsO4—;③根据流程图,以及信息I,得出一级沉砷中加入FeSO4的作用是:沉淀过量的S2—,使As2S3(s)+3S2—(aq) 2AsS33—(aq)平衡左移,提高沉砷效果;④根据流程图,H2O2作氧化剂,把+3价As氧化成+5价,化合价升高2价,H2O2中O的化合价降低2价,最小公倍数为2,因此化学反应方程式为:H3AsO3+H2O2=H3AsO4+H2O;⑤一级沉砷中加入FeSO4,硫酸钙微溶于水,因此沉淀X为CaSO4;(2)①As和N同主族,因此AsH3的电子式,与NH3电子式相似,因此AsH3的电子式为:;②银镜为Ag,AgNO3作氧化剂,化合价有+1价→0价,化合价降低1价,H3As作还原剂,化合价由-3价→+3价,化合价升高6价,最小公倍数为6,离子反应方程式为:12Ag++2H3As+3H2O==12Ag↓+As2O3+12H+;③千克溶液中含As的质量为3.0×10-6×1000/10g/kg=3.0×10-4>4.0×10-5,因此不合格。
熔点/℃
沸点/℃
其他物理或化学性质
PCl3
-112.0
76.0
PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl
POCl3
1.25
106.0
0
20
40
60
80
100
LiOH
11.9
12.4
13.2
14.6
16.6
19.1
Li2CO3
1.54
1.33
1.17
1.01
0.85
0.72
新高考化学一轮复习考点巩固练习17 金属及其化合物制备流程(Zn)(解析版): 这是一份新高考化学一轮复习考点巩固练习17 金属及其化合物制备流程(Zn)(解析版),文件包含新高考化学一轮复习考点巩固练习17金属及其化合物制备流程Zn原卷版doc、新高考化学一轮复习考点巩固练习17金属及其化合物制备流程Zn解析版doc等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
新高考化学一轮复习考点巩固练习17 金属及其化合物制备流程(Ti)(解析版): 这是一份新高考化学一轮复习考点巩固练习17 金属及其化合物制备流程(Ti)(解析版),文件包含新高考化学一轮复习考点巩固练习17金属及其化合物制备流程Ti原卷版doc、新高考化学一轮复习考点巩固练习17金属及其化合物制备流程Ti解析版doc等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
新高考化学一轮复习考点巩固练习17 金属及其化合物制备流程(Pb)(解析版): 这是一份新高考化学一轮复习考点巩固练习17 金属及其化合物制备流程(Pb)(解析版),文件包含新高考化学一轮复习考点巩固练习17金属及其化合物制备流程Pb原卷版doc、新高考化学一轮复习考点巩固练习17金属及其化合物制备流程Pb解析版doc等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。












