





新高考化学一轮复习讲义课件 第7章 第34讲 微专题18 应用“等效平衡”判断平衡移动的结果
展开1.等效平衡的含义在一定条件下(恒温恒容或恒温恒压)下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,还是正、逆反应同时投料,达到化学平衡状态时,任何相同组分的百分含量(质量分数、物质的量分数、体积分数等)均相同。
2.等效平衡的判断方法(1)恒温恒容条件下反应前后体积改变的反应判断方法:极值等量即等效。例如:2SO2(g)+O2(g) 2SO3(g)① 2 ml 1 ml 0② 0 0 2 ml③ 0.5 ml 0.25 ml 1.5 ml④ a ml b ml c ml上述①②③三种配比,按化学方程式的化学计量数关系均转化为反应物,则SO2均为2 ml,O2均为1 ml,三者建立的平衡状态完全相同。④中a、b、c三者的关系满足:c+a=2, +b=1,即与上述平衡等效。
(2)恒温恒压条件下反应前后体积改变的反应判断方法:极值等比即等效。例如:2SO2(g)+O2(g) 2SO3(g)① 2 ml 3 ml 0② 1 ml 3.5 ml 2 ml③ a ml b ml c ml按化学方程式的化学计量数关系均转化为反应物,则①②中 ,故互为等效平衡。③中a、b、c三者关系满足: ,即与①②平衡等效。
(3)恒温条件下反应前后体积不变的反应判断方法:无论是恒温恒容,还是恒温恒压,只要极值等比即等效,因为压强改变对该类反应的化学平衡无影响。例如:H2(g)+I2(g) 2HI(g)① 1 ml 1 ml 0② 2 ml 2 ml 1 ml③ a ml b ml c ml①②两种情况下,n(H2)∶n(I2)=1∶1,故互为等效平衡。③中a、b、c三者关系满足 =1∶1或a∶b=1∶1,c≥0,即与①②平衡等效。
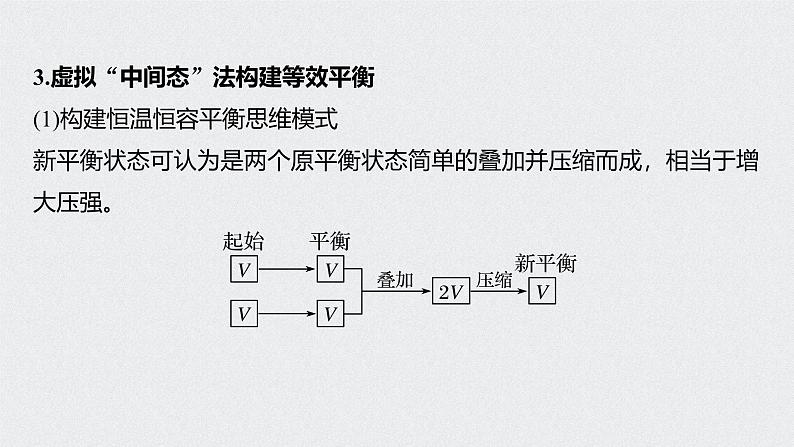
3.虚拟“中间态”法构建等效平衡(1)构建恒温恒容平衡思维模式新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
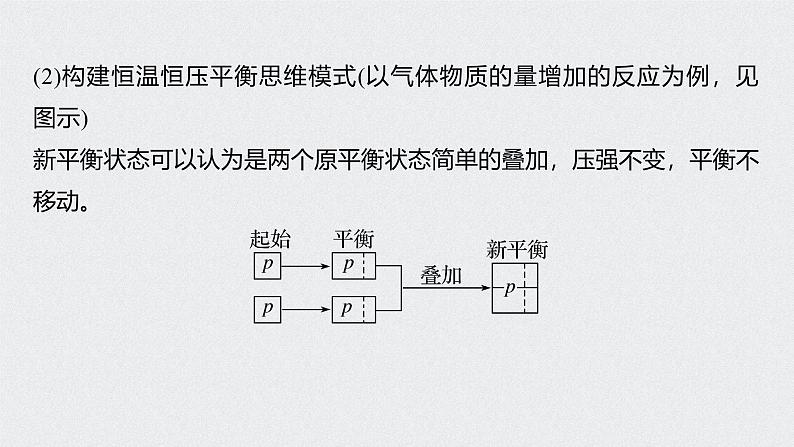
(2)构建恒温恒压平衡思维模式(以气体物质的量增加的反应为例,见图示)新平衡状态可以认为是两个原平衡状态简单的叠加,压强不变,平衡不移动。
对于以下三个反应,从反应开始进行到达到平衡后,保持温度、体积不变,按要求回答下列问题。(1)PCl5(g) PCl3(g)+Cl2(g)再充入PCl5(g),平衡向________方向移动,达到平衡后,PCl5(g)的转化率_______,PCl5(g)的百分含量______。(2)2HI(g) I2(g)+H2(g)再充入HI(g),平衡向________方向移动,达到平衡后,HI的分解率_______,HI的百分含量________。
(3)2NO2(g) N2O4(g)再充入NO2(g),平衡向________方向移动,达到平衡后,NO2(g)的转化率______,NO2(g)的百分含量________。(4)mA(g)+nB(g) pC(g)同等倍数的加入A(g)和B(g),平衡_____移动,达到平衡后,①m+n>p,A、B的转化率都_____,体积分数都_____;②m+n=p,A、B的转化率、体积分数都_____;③m+n
平衡转化率的分析与判断方法反应aA(g)+bB(g) cC(g)+dD(g)的转化率分析①若反应物起始物质的量之比等于化学计量数之比,达到平衡后,它们的转化率相等。②若只增加A的量,平衡正向移动,B的转化率提高,A的转化率降低。③若按原比例同倍数地增加(或降低)A、B的浓度,等效于压缩(或扩大)容器体积,气体反应物的转化率与化学计量数有关。
同倍增大c(A)和c(B)
1.已知2SO2 (g)+O2 (g) 2SO3 (g) ΔH=-197 kJ·ml-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 ml SO2和1 ml O2;(乙) 1 ml SO2和0.5 ml O2 ;(丙) 2 ml SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是A.容器内压强p:p甲=p丙>2p乙B.SO3的质量m:m甲=m丙>2m乙C.c(SO2)与c(O2)之比为k:k甲=k丙>k乙D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
解析 因为反应2SO2(g)+O2(g) 2SO3(g)在恒温、恒容的条件下进行。根据等效平衡的原理可知,甲与丙最后达到平衡时SO2、O2、SO3的物质的量、容器内的压强、SO2与O2的比值都相同;乙相当于在甲容器达到平衡后,将容器的体积瞬间扩大为原来的2倍。设甲达到平衡时容器内的压强为p甲,此时容器内瞬间压强减小为 ,此时平衡向逆反应方向移动,气体的物质的量增加,SO3的质量减小,所以容器内气体的压强增大,则p乙> ,则2p乙>p甲=p丙,SO3的质量,m甲=m丙>2m乙,A错、B对;
当甲容器达到平衡后瞬间将容器体积扩大2倍,平衡向逆反应方向移动,但是生成的SO2与O2的物质的量之比为2∶1,这与开始两者加入的物质的量之比相同,所以在此过程中SO2与O2的物质的量之比一直是2∶1不变,C错;甲与丙为等效平衡,但达到平衡时,甲容器中SO2的转化率与丙容器中SO3的转化率不一定相等,即Q甲不一定等于Q丙,D错。
2.一定条件下存在反应:2SO2(g)+O2(g) 2SO3(g),其正反应放热。图1、图2表示起始时容器甲、丙体积都是V,容器乙、丁体积都是 ;向甲、丙内都充入2a ml SO2和a ml O2并保持恒温;向乙、丁内都充入a ml SO2和0.5a ml O2并保持绝热(即与外界无热量交换),在一定温度时开始反应。下列说法正确的是A.图1达平衡时,浓度c(SO2): 甲=乙B.图1达平衡时,平衡常数K:甲<乙C.图2达平衡时,所需时间t:丙<丁D.图2达平衡时,体积分数φ(SO3):丙>丁
解析 甲和乙若都是恒温恒压,则两者等效,但乙为绝热恒压,又该反应正反应为放热反应,则温度:甲<乙,温度升高平衡向逆反应方向移动,浓度c(SO2):甲<乙,平衡常数K:甲>乙,故A、B项错误;丙和丁若都是恒温恒容,则两者等效,但丁为绝热恒容,则温度:丙<丁,温度越高,反应速率越快,到达平衡的时间越短,所用的时间:丙>丁,C项错误;温度升高平衡向逆反应方向移动,体积分数φ(SO3):丙>丁,D项正确。
3.Ⅰ.恒温、恒压下,在一可变容积的容器中发生如下反应:A(g)+B(g) C(g)。(1)若开始时放入1 ml A和1 ml B,达到平衡后,生成a ml C,这时A的物质的量为________ml。
解析 由反应A(g)+B(g) C(g)可知,生成a ml C必消耗a ml A,则n(A)=(1-a)ml。
(2)若开始时放入3 ml A和3 ml B,达到平衡后,生成C的物质的量为_______ml。
解析 因(2)与(1)为恒温恒压条件下的等效平衡,且(2)开始时A和B的物质的量为(1)开始时A和B物质的量的3倍,则达到平衡后(2)生成C的物质的量为(1)生成C的物质的量的3倍,故生成C的物质的量为3a ml。
(3)若开始时放入x ml A、2 ml B和1 ml C,达到平衡后,A和C的物质的量分别是y ml和3a ml,则x=_____ml,y=________ml。平衡时,B的物质的量________(填字母)。A.大于2 mlB.等于2 mlC.小于2 mlD.可能大于、等于或小于2 ml作出此判断的理由是____________________________________________________________________________________________。
若3a>1,B的物质的量小于2 ml;若3a=1,B的物质的量等于2 ml;若3a<1,B的物质的量大于2 ml
解析 因(3)与(2)为恒温恒压条件下的等效平衡,若1 ml C全部生成A和B,则可得到1 ml A和1 ml B,则x ml+1 ml=3 ml,解得x=2。 A(g)+B(g) C(g)开始物质的量(ml) 2 2 1转化物质的量(ml) 3a-1 3a-1 3a-1平衡物质的量(ml) 3-3a 3-3a 3a从而可得y=3-3a,n(B)平=(3-3a)ml。由此可知,若3a>1,则B的物质的量小于2 ml;若3a=1,则B的物质的量等于2 ml;若3a<1,则B的物质的量大于2 ml。
(4)若在(3)的平衡混合物中再加入3 ml C,待再次达到平衡后,C的物质的量分数是________。
解析 因(4)与(1)和(2)均为等效平衡,则(4)与(1)和(2)中C的物质的量分数均相等,
Ⅱ.若维持温度不变,在一个与(1)反应前起始体积相同且容积固定的容器中发生上述反应。(5)开始时放入1 ml A和1 ml B达到平衡后生成b ml C,将b与(1)小题中的a进行比较:________(选填一个编号)。甲:ab丙:a=b 丁:不能比较作出此判断理由是________________________________________________________________________________________________________________________________________________________________。
因为(5)小题中容器的容积不变,而(1)小题中容器的容积缩小,所以随着反应进行,(5)小题的容器中的压强小于(1)小题容器中的压强,有利于平衡逆向移动,故反应达到平衡后a>b
新高考化学一轮复习讲义课件 第7章 第34讲 化学平衡状态 化学平衡的移动: 这是一份新高考化学一轮复习讲义课件 第7章 第34讲 化学平衡状态 化学平衡的移动,共60页。PPT课件主要包含了复习目标,真题演练明确考向,课时精练巩固提高,内容索引,知识梳理·夯基础,同一条件,质量或浓度,2建立,3平衡特点,错误的写明原因等内容,欢迎下载使用。
新高考化学一轮复习讲义课件第7章 第43讲 化学平衡移动原理及应用(含解析): 这是一份新高考化学一轮复习讲义课件第7章 第43讲 化学平衡移动原理及应用(含解析),共60页。PPT课件主要包含了复习目标,化学平衡的移动,正反应方向,不发生,逆反应方向,正反应,逆反应,减弱这种改变,减小不变,不移动等内容,欢迎下载使用。
2022年高考化学一轮复习 第7章 第34讲 微专题18 应用“等效平衡”判断平衡移动的结果 (含解析)课件PPT: 这是一份2022年高考化学一轮复习 第7章 第34讲 微专题18 应用“等效平衡”判断平衡移动的结果 (含解析)课件PPT,共24页。PPT课件主要包含了正反应,练后反思,续上页,1-a,3-3a等内容,欢迎下载使用。












